同位素内标-UPLC-MS/MS法同时测定羊肉中金刚烷胺和金刚乙胺的残留量*
2022-03-11王兰兰
张 季,凌 蕾,卢 叶,杨 沙,王兰兰,李 霞
(遵义市产品质量检验检测院,国家茶及茶制品质量监督检验中心,贵州 遵义 563099)
金刚烷胺和金刚乙胺属于三环癸烷的结构,广泛应用于畜禽养殖业,对流感病毒和抗帕金森综合征有很好的抑制效果[1]。但是随着养殖规模的不断增加,各类传染病此起彼伏,这类药物的用量和频率也随之出现正增长[2]。金刚烷胺类药物用量的不断增加会导致畜禽产生耐药性,也会过多地残留在体内,食用后影响人的健康[3]。例如会导致动物中毒,导致人体产生神经毒性等副作用[4]。所以,目前明令禁止金刚烷胺和金刚乙胺在畜禽养殖业上的使用已是大势所趋。在我国,农业部2005年就已明令禁止金刚烷胺、金刚乙胺等抗病毒药,参见农业部560号公告[5]。由于此类药物的可替代产品少有,相关畜禽养殖业人食品缺乏对药物残留的认识,所以此类药物违规超量使用的现象时有发生[6]。所以,对于金刚烷胺类药物在畜禽类食品中残留量的检测,是当前需要解决的现实问题[7]。
当前已报道的检测动物源性食品中金刚烷胺和金刚乙胺的方法主要有液相色谱法和液相色谱-串联质谱法[8]。例如高效液相色谱-示差折光检测器(HPLC-RID)测定金刚烷胺的含量[9],基于超高效液相色谱串联质谱法建立了一种测定禽粪便中金刚烷胺残留量方法[10],一种液相色谱-串联质谱法测定牛奶中金刚烷胺药物残留的方法被建立[11]。除此以外,一些其它类型的检测方法也相继确立。例如,建立快速检测禽肉中金刚烷胺和氯霉素的间接竞争化学发光酶联免疫分析方法[12],在筛选金刚烷胺单克隆抗体的基础上,建立酶联免疫检测方法,并研制出检测动物组织中金刚烷胺残留的试剂盒[13],基于具备气相色谱仪的中小型实验室进行金刚烷胺的监控,建立了金刚烷胺药物的气相色谱检测法[14],一种基于羟丙基-β-环糊精主客体竞争性包合作用的金刚烷胺药物荧光色谱检测方法被设计研究[15]。
目前还没有报道在羊肉中金刚烷胺类药物残留量的检测,所以本文建立了一种位素内标-UPLC-MS/MS法同时测定羊肉中金刚烷胺和金刚乙胺的残留量,该方法快速高效、准确度高、重现性好,适用于羊肉中金刚烷胺类药物的检测。
1 实 验
1.1 材料与试剂
甲醇、乙腈(质谱纯),购自德国默克公司;实验用水为Milli-Q超纯水;金刚烷胺、金刚烷胺-D15、金刚乙胺、金刚乙胺-D4标准物质,购自Bepure公司;正己烷(分析纯)、无水硫酸钠(分析纯),购置科密欧公司;微孔滤头孔径 0.22 μm,购置安谱公司。羊肉供试样品均为当地农贸市场购买。
1%甲酸乙腈溶液:量取1 mL甲酸,加乙腈至100 mL,摇匀即得。20%乙腈溶液:取乙腈20 mL,加水至100 mL,要摇匀即得。20%乙腈溶液饱和的正己烷:取20%乙腈溶液适量,与正己烷混合,振摇后静止使分层。
1.2 仪器与设备
UPLCXevo TQ-S超高效液相串联三重四级杆质谱仪,美国Waters公司产品;Milli-Q Reference超纯水发生器,美国Millipore公司;ALC-210.4型电子天平,德国Sartorius公司;台式高速冷冻离心机,美国Sigma公司。
1.3 标准溶液的配制
金刚烷胺和金刚乙胺标准储备液:准确称取金刚烷胺和金刚乙胺标准物质10 mg于10 mL容量瓶中,用甲醇定容至刻度,得到浓度为1.0 mg/mL的标准储备液。-20℃保存,有效期1年。
金刚烷胺-D15和金刚乙胺-D4内标储备液:准确移取金刚烷胺-D15和金刚乙胺-D4标准物质1.0 mg/mL于10 mL容量瓶中,用甲醇定容至刻度,得到浓度为100 μg/mL的标准储备液。-20 ℃保存,有效期1年。
标准工作液:分别精密量取上述金刚烷胺和金刚乙胺标准储备液0.1 mL和金刚烷胺-D15和金刚乙胺-D4内标储备液1.0 mL于100 mL量瓶中,用甲醇稀释至刻,配制成金刚烷胺和金刚乙胺、金刚烷胺-D15和金刚乙胺-D4浓度为1.0 μg/mL的标准工作液的标准工作液。2~8 ℃保存,有效期2周。
1.4 样品前处理
试样的制备与保存:取适量新鲜或冷冻的空白或供试组织,绞碎并使均质,-20 ℃以下贮存备用。称取试样2 g置于50 mL离心管中,加金刚烷胺-D15和金刚乙胺-D4内标中间工作液20 μL,再加无水硫酸钠3 g,1%甲酸乙腈溶液10 mL,2500 r/min下涡旋混匀10 min。常温下8000 r/min离心8 min,取上清液5 mL于50 ℃下氮气吹干。
加入20%乙腈溶液1.0 mL,充分涡旋溶解,再加入20%乙腈溶液饱和的正己烷2 mL,充分涡旋混匀,常温下8000 r/min离心5 min。吸取下层溶液至1.5 mL离心管中,常温下 16000 r/min离心5 min,取下层清液过0.22 μm滤膜,上机检测。
1.5 仪器参数与测定
1.5.1 色谱条件
色谱柱:Waters Acquity UPLC BEH C18(1.7 μm, 2.1 mm×100 mm),柱温:40 ℃,流动相:A:乙腈;B:0.1%甲酸水溶液,进样量:5 μL,梯度洗脱程序见表2。

表1 梯度洗脱程序Table 1 Gradient elution procedure
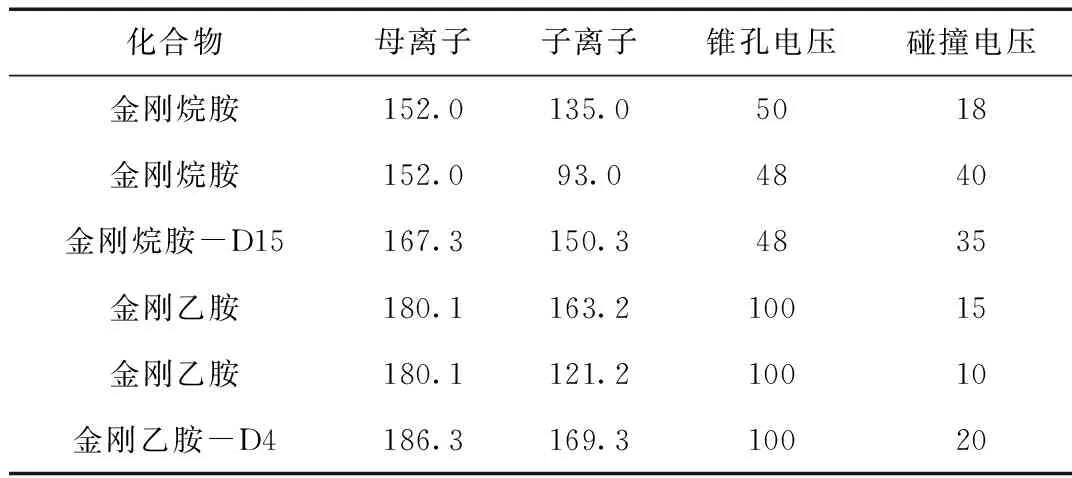
表2 定性、定量离子和电压Table 2 Qualitative, quantitative ions and voltages
1.5.2 质谱条件
离子源:电喷雾ESI+,采集模式:多反应监测MRM,毛细管电压:3.1 kV,脱溶剂气温度:500 ℃,定性、定量离子和电压见表3。
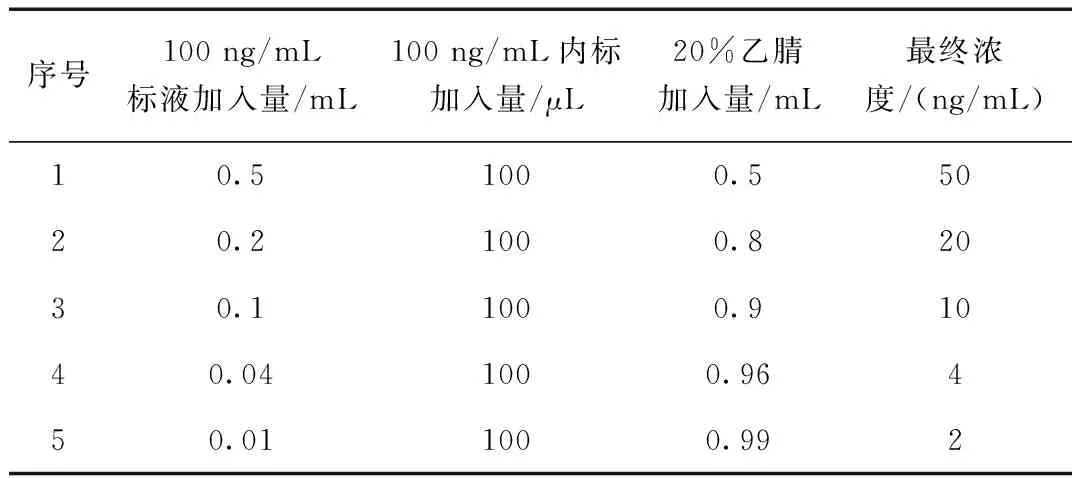
表3 标准工作液配制Table 3 Standard working fluid
2 结果与讨论
2.1 标准工作液的制备
准确量取金刚烷胺和金刚乙胺标准工作液,用20%乙腈溶液稀释成浓度为2、4、10、20、50 ng/mL的系列标准工作液。
2.2 上机条件优化
金刚烷胺和金刚乙胺及其内标中含有氨基,在ESI+模式下进行检测,能够形成加氢的离子,在摸索质谱条件时,配置浓度较高的标准溶剂不经过色谱直接打入质谱中,根据实时调节毛细管电压,锥孔电压,碰撞电压等条件的方法进行方法优化。优化后的目标物特征离子色谱图见图1~图4。
图1 金刚烷胺标准溶液特征离子色谱图(20 ng/mL)Fig.1 Characteristics ion chromatogram ofAmantadine standard solution

图2 金刚烷胺-D15标准溶液特征离子色谱图(20 ng/mL)Fig.2 Characteristics ion chromatogram ofAmantadine-D15 standard solution

图3 金刚乙胺标准溶液特征离子质量色谱图(20 ng/mL)Fig.3 Characteristics ion chromatogram ofRimantadine standard solution
图4 金刚乙胺-D4标准溶液特征离子质量色谱图(20 ng/mL)Fig.4 Characteristics ion chromatogram ofRimantadine-D4 standard solution
2.3 前处理条件摸索
同位素内标的选择:比较了使用同位素内标和外标法定量两种实验,结果显示,不使用同位素内标的实验回收率较低,不能满足实验需求,添加了同位素内标的实验,内标法定量,校正了回收率,能满足实验需求。
净化方式的选择:比较了正己烷除脂净化和过SPE小柱净化两种方式,SPE小柱选择了Prime HLB和Captive EMR两种无需活化的固相萃取柱,结果显示,两种SPE小柱净化效果尚可,但均对金刚烷胺和金刚乙胺具有一定的吸附作用,导致提取效率不足,而正己烷除脂净化价格便宜,效率高,也不会对目标物进行吸附,能满足实验需求。
2.4 添加回收实验
试剂空白和空白样品:试剂空白不加试样外,与待测试样同步处理。空白样品取空白试样,与待测试样同步处理。添加样品:取空白试样2 g,添加100 ng/mL的标准中间工作液 100 μL,制得含量为5 μg/kg的阳性试样,与待测试样同步处理。回收率实验数据见表4。
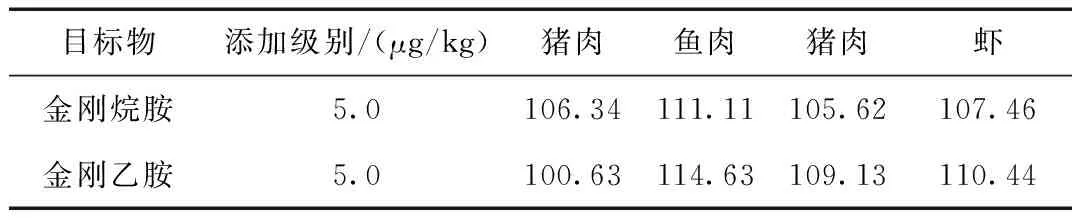
表4 金刚烷胺和金刚乙胺的添加浓度及其平均回收率的试验数据Table 4 Test data for adding concentrations of sterogantamine and diamine and its average recovery
3 讨 论
本研究依托超高效液相色谱-三种四级杆质谱仪和同位素内标法,建立了一种羊肉中金刚烷胺和金刚乙胺的检测方法,该方法采用1%甲酸乙腈溶液提取,正己烷除脂净化后上机检测,线性条件为2~50 ng/mL,检测限为2.5 μg/kg,定量限为5.0 μg/kg,在5.0 μg/kg添加浓度水平上的回收率为100.63%~114.63%。整个检测过程,前处理简单易操作,成本低,检测结果稳定准确,为羊肉中金刚烷胺和金刚乙胺的检测提供了相关性研究。
