碳酸镁结晶过程离子团簇与扩散成核机制
2022-03-11任文芝强伟丽廉士俊
任文芝,强伟丽,廉士俊,兰 忠
(辽宁省化工资源清洁利用重点实验室,大连理工大学化学工程研究所,辽宁大连 116024)
无水碳酸镁(AMC)是一种新型无机功能材料,具有极高的应用价值[1]。晶型完整、形貌均匀的AMC不仅在光学、地球化学及材料科学等众多领域具有广阔的应用前景[2-4],还能作为前驱体制备多孔氧化镁,用于吸附[5]、催化[6]和抗菌[7]等领域。
在溶液结晶过程中,由于Mg2+与H2O的强结合,非常容易生成水合碳酸镁[8]和碱式碳酸镁[9],严重影响AMC产品的品质。目前实验室制备AMC晶体的方法有很多,尽管采用了高能耗和复杂的操作,仍不易得到均匀形态的高质量AMC。其中,大部分方法从原理上都是向体系中通入CO2或加入尿素等来提供过量的CO32-,并采用高温或加入添加剂的方式来干扰Mg2+与H2O的强结合,从而有利于CO32-与Mg2+碰撞成核,形成MgCO3[10-12]。此外,SWANSON等[13]还发现,在体系中加入AMC晶体引导溶质离子吸附生长也可以得到AMC晶体。无论采用哪种制备方法,溶液结晶过程都是形成AMC的重要过程,在这个过程中晶体分子的排列方式与所处的外在环境和晶体成核与生长这两个方面相互影响和制约,而晶体成核与生长的特点最终将影响晶体产品的品质[14-15]。晶体成核或生长的单元可能是溶质分子、原子或离子,也可能是团簇[16]。团簇演化是晶体成核与生长过程中重要的控制过程,所以其规律也将是晶体产品调控涉及的重要机制之一。
对于微小团簇的演化规律以及结晶过程的机理研究而言,分子动力学模拟是重要的研究手段之一[17-18]。研究者们对结晶过程中团簇的演化现象进行了大量模拟研究。比如,LANARO等[19]研究了NaCl水溶液晶体成核的影响因素,发现团簇结晶度对等尺寸团簇的寿命和晶体成核的概率有很大的影响;CHAKRABORTY等[20]研究了NaCl溶液中晶体成核与生长的微观机理,发现晶体成核发生在局部浓度较高的区域,早期晶核较为松散且含有大量水分;窦翔宇[21]研究了CaCO2水溶液的结晶过程,发现晶体成核早期主要的成核单体是单个溶质离子,后期才有大的团簇参与成核;KADOTA等[22]研究了团簇对晶体生长的影响,发现团簇可以作为晶体生长单元在晶体表面吸附时比单个离子更稳定;YAMANAKA等[23]研究了NaCl水溶液在Pt(100)和NaCl(100)表面的团簇行为,发现团簇的形成在很大程度上取决于界面的水取向。总的来说,团簇动态行为和演化机制的研究对于结晶成核与生长过程有着重要意义,但对于团簇演化的工艺条件的影响以及成核与生长的演化机理不够清晰。另外,AMC溶液结晶过程还涉及到由于扩散竞争等机制而耦合的脱水过程的调控,过程的微观机理尚不清晰,特别是工艺参数调控的策略与效果更需要进一步深入分析。
因此,笔者构建碳酸镁溶液-界面模型,探索结晶温区及不同溶质离子浓度下晶界附近离子团簇与扩散的演化机制以及体系的成核和生长能力,希望为晶体缺陷的修复及获得晶型完整、形貌均匀的AMC等工艺技术提供理论依据和指导。
1 模型构建与分析方法
1.1 结晶体系模型构建与优化
主要应用Materials Studio(MS)2017软件进行模拟。以溶质离子浓度为1.71 mol/L的体系说明建模方法。参考Materials Project信息,碳酸镁晶体属于空间群,晶胞参数a=b=0.462 nm、c=1.499 nm、α=β=90°、γ=120°。取其主要生长面之一晶面构建晶体壁面模型,其尺寸为2.772 nm×2.998 nm×0.800 2 nm。利用Amorphous Cell模块建立碳酸镁溶液模型,包含1000个水分子、30个CO32-和30个Mg2+,盒子尺寸为2.772 nm×2.998 nm×3.511 nm。溶液密度为1.17 g/cm3,是通过NPT弛豫得到的合理密度值,与实际溶液密度相符。去除溶液模型和壁面模型的周期性,在溶液两侧放置碳酸镁晶体壁面,放置于周期性盒子中,组成碳酸镁溶液-界面模型(见图1)。为得到不同浓度的碳酸镁溶液体系,保持1 000个水分子不变,在模拟单元中添加不同数量的CO32-和Mg2+,具体设置见表1。
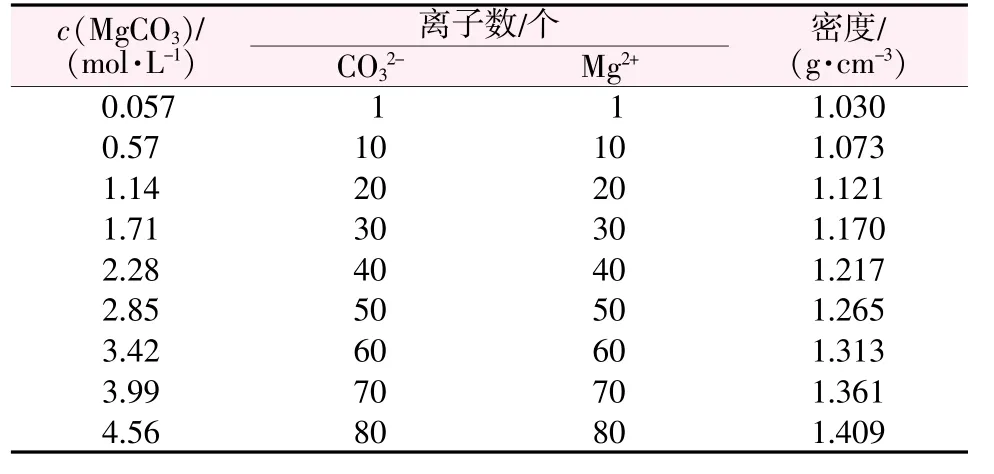
表1 不同浓度碳酸镁溶液体系的具体设置Table 1 Specific setting of MgCO3 solution system with different concentration
对模型进行能量和电荷分配(见表2),电荷赋值方法为COMPASS力场自带电荷。然后进行几何优化,优化后体系能量达到平衡,并且收敛性很好。参考KADOTA等[22]研究表明,这种溶液与晶体表面直接接触的晶界模型适于研究团簇成核与生长过程。

表2 体系力场与电荷分配Table 2 Systemforce field and charge distribution
1.2 模拟计算策略
结晶体系构建并优化完成后,对体系进行分子动力学模拟计算。模拟采用COMPASS力场,该力场适用于预测盐溶液结晶过程中离子的团聚过程以及在晶界的吸附过程[24-27]。结晶过程一般可忽略壁面的晶格振动,故计算过程中壁面始终固定。x方向和y方向采用周期性边界条件,z方向采用固壁和镜像边界条件。
首先在NVT系综下弛豫100 ps,使系统达到初始平衡状态,温度恒定。采用Velocity Verlet积分法解析牛顿运动过程,原子初始速度使用Boltzmann随机分布方法来确定,步长设为1 fs。采用Andersen方法进行控温,范德华相互作用和静电相互作用的计算分别采用Atom-based求和法和Ewald求和法,截断半径为1.25 nm。
然后,在NVE系综下对体系进行5 000 ps的仿真模拟,以研究溶液结晶成核的初始过程。初始速度设置为Current,来自于初始结构,其他设置与NVT一致。模拟完成后得到轨迹文件,并对结果进行分析。采用的计算参数和策略来自多数文献的参考建议,通过观察模拟轨迹以及溶液配置进行了参数无关性验证,选取了不同的计算精度,截断半径分别为1.25、1.55、1.85 nm,发现计算精度对模拟结果基本没有影响。为节省计算时间,选取了较小的截断半径1.25 nm。
1.3 团簇的区分
为确认离子间的聚集是否可以认为具有新相形成的特点,可以通过径向分布函数(RDF)来量化聚集的程度。为此,绘制了不同溶质离子浓度下Mg2+和CO32-中C原子及O原子的RDF图,见图2。从图2发现,不同溶质离子浓度下Mg2+-C的RDF最大峰均位于0.203 nm处,Mg2+-O的RDF最大峰均位于0.168nm处。而在碳酸镁晶体中,r(Mg2+-C)=0.295 nm、r(Mg2+-O)=0.209 nm。因此可以认为,如果r(Mg2+-C)在0.203 nm左右或r(Mg2+-O)在0.168 nm左右就可以将其定义为团簇。考虑到模拟过程中团簇的形成是离子互相靠近聚集的过程,形成团簇的区域范围可视为略宽于径向分布函数的峰值半径,因此取r(Mg2+-C)<0.21 nm或r(Mg2+-O)<0.175 nm时认为溶质离子属于同一团簇。根据团簇的区分方法可以统计出团簇尺寸(包含CO32-和Mg2+的个数)和不同尺寸团簇的数量。
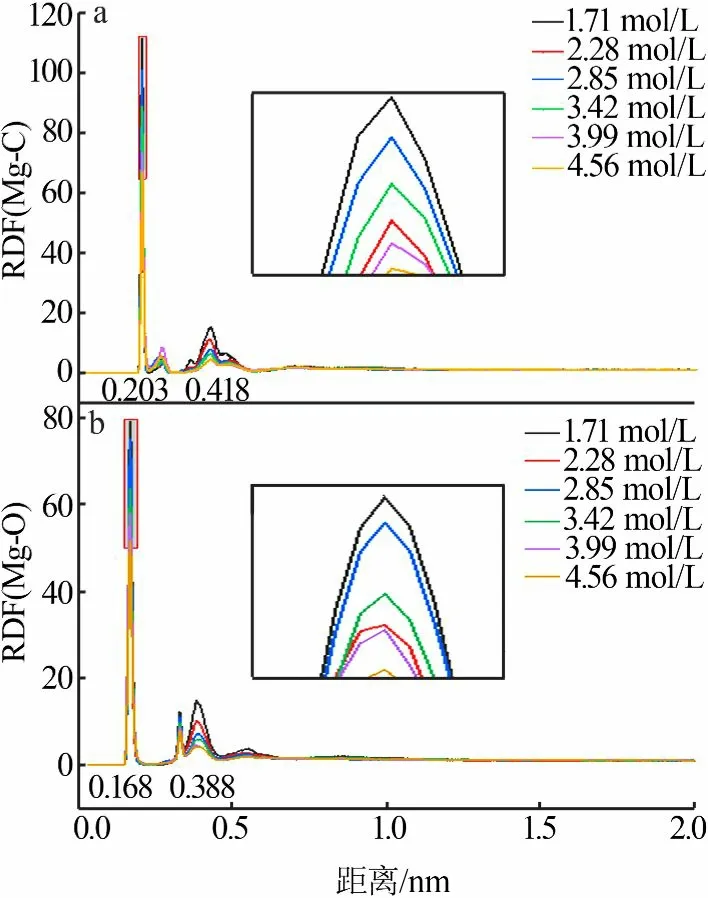
图2 不同溶质离子浓度下Mg2+-C(a)和Mg2+-O(b)的RDF图Fig.2 RDFof Mg2+-C(a)and Mg2+-O(b)with different solute ion concentration
2 模拟结果与讨论
2.1 粒子扩散特性
在溶液结晶过程中,水分子和溶质离子做无规则布朗运动,其运动速度与温度、物质结构及分子间作用力有关。通过计算不同条件下体系中各粒子的扩散系数研究了粒子的扩散特性及影响机理。
2.1.1 温度对扩散系数的影响
通过分子动力学(MD)模拟求得各温度下(283~388 K)水分子的均方根位移(MSD)随时间的变化曲线,然后求各条曲线的斜率得到水分子的扩散系数,见图3a。由图3a看出,水分子自扩散系数变化的大体趋势是随着温度的升高而增大。这是因为温度升高水分子的动能迅速增加,破坏了部分氢键,使得单个水分子数增多、扩散能力增强。用同样的方法可以计算出不同温度下体系中Mg2+和CO32-在水溶液中的扩散系数,见图3b。从图3b看出,CO32-和Mg2+的扩散系数随着温度的升高呈现不规律的变化,388 K时CO32-和Mg2+的扩散系数几乎相等,且都取到最小值。若只考虑温度对动能的影响,溶质离子也应该像水分子一样在温度升高时其扩散速率增大,很显然它们的运动速度受到物质结构及分子间作用力的影响。

图3 不同温度下水分子的自扩散系数(a)以及Mg2+和CO32-的扩散系数(b)Fig.3 Self-diffusivity of H2O(a)and diffusivity of Mg2+and CO32-(b)at different temperature
绘制了一定状态体系中处于不同位置Mg2+的MSD曲线,见图4。从图4看出,沉积到晶界的Mg2+扩散能力非常弱,而溶液中的Mg2+随着所在团簇尺寸的增大扩散能力逐渐降低,游离的Mg2+扩散能力最强。这就证明了溶质离子扩散系数的降低机制确实是由物质结构及分子间作用力的影响造成的,并且与成核或晶界生长过程的团簇演化相互作用。
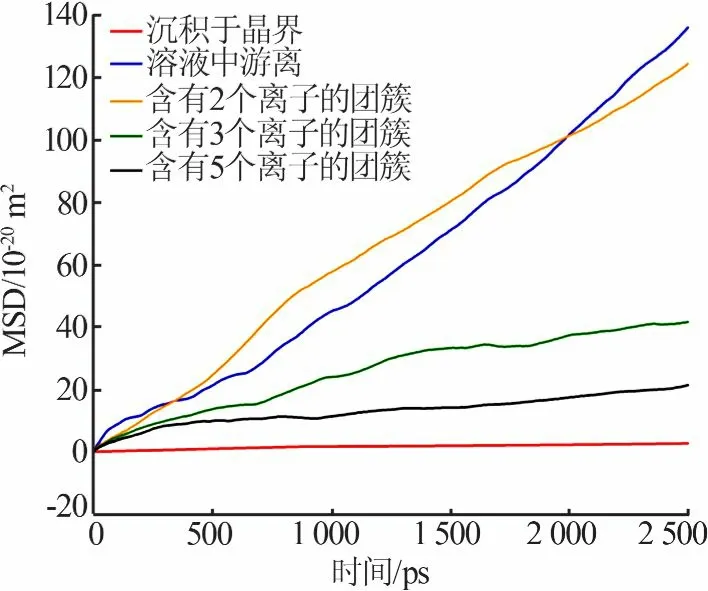
图4 不同位置及不同尺寸团簇中Mg2+的MSD曲线Fig.4 MSDcurves of Mg2+in clusters of different position and size
2.1.2 溶质离子浓度对扩散系数的影响
考察了溶质离子浓度为0.057~4.56 mol/L的体系中各粒子的扩散系数,结果见图5。从图5看出,溶质离子浓度增大,水分子和溶质离子的扩散系数都呈现逐渐降低的趋势。首先是因为体系的尺寸有限,溶质离子浓度升高则体系中的粒子数增加,彼此间距离更近,相互作用力也就越强,导致体系粒子的扩散能力下降。另外,溶质离子浓度进一步升高后,溶液中出现了更多的离子稠密区域并形成了大量团簇,离子间相互作用增强,扩散能力自然下降。溶质离子浓度为3.99 mol/L时,水分子的扩散系数出现一个极大值,说明水分子的扩散能力较强。这可能是因为该浓度条件形成了相应的作用力场,对Mg2+和水分子的强结合产生了较大的影响,从而使水分子摆脱Mg2+的束缚变得活跃。

图5 不同溶质离子浓度下水分子(a)以及Mg2+和CO32-(b)的扩散系数Fig.5 Diffusivity of H2O(a),Mg2+and CO32-(b)at different solute ion concentration
2.2 团簇演化规律分析
2.2.1 团簇数量、尺寸及分布
通过粒子扩散特性的分析表明,扩散速率与物质结构和分子间作用力有关,并且与成核或晶界生长过程的团簇演化相互作用。进一步观察了不同温度和不同溶质离子浓度条件下5 000 ps时溶液的物理图景(见图6),并统计了各个条件下体系中的团簇尺寸以及团簇数量(见图7)。结合图6和图7发现,溶质离子浓度一定时在较低温度下溶质离子较为分散,团簇尺寸较小且数量较少;温度升高时团簇数量增加且尺寸增大,溶液中出现了离子密度稠密区域。343 K时在近晶界处出现了一个范围较大、结构紧密的离子稠密区域;388 K时溶液中形成的多个离子稠密区域距离晶界非常近,离子间的相互作用以及晶界对离子的静电吸引使得溶质离子的扩散能力大大下降;373 K时没有出现较为集中的离子稠密区域,比较分散,这可能是因为该温度下水分子与Mg2+的结合作用占优势,Mg2+周围包围了较多的水分子,很难与CO32-碰撞,且难以向晶界沉积。温度一定时,随着溶质离子浓度的增加溶液中出现了更多、范围更广的离子稠密区域,团簇数量增加,尺寸增大。在较低溶质离子浓度下溶质离子很明显地分布于晶界附近,而溶质离子浓度较高时成核离子就近结合,优先在体相中成核,而不是向晶界沉积。

图6 不同温度和不同溶质离子浓度下5 000 ps时溶液的物理图景Fig.6 Physical picture of solution with 5 000 ps at different temperature and solute ion concentration

图7 不同温度(a)和不同溶质离子浓度(b)下5 000 ps时团簇数量和团簇尺寸Fig.7 Number and size of clusterswith 5 000 psat different temperature(a)and solute ion concentration(b)
对团簇沿z轴的分布情况进行了量化,结果见图8。从图8看出,在较低温度下团簇较为均匀地分布在溶液中,在晶界处形成较多的团簇;温度升高,团簇明显集中于晶界附近,在溶液中出现了团簇浓度为零的点。说明在较高温度下溶质离子更多地用于晶体生长而不是成核。但是在373 K时团簇均匀分布在溶液中,没有向晶界聚集。在较低溶质离子浓度下,团簇集中于晶界附近,溶液中的团簇分布较少;而在高溶质离子浓度下,团簇几乎均匀分布在整个溶液中,包括晶界附近。
图8 不同温度(a)和不同溶质离子浓度(b)下团簇的分布情况Fig.8 Distribution of clustersat different temperature(a)and solute ion concentration(b)
2.2.2 形成团簇的溶质离子分数
为明晰温度和溶质离子浓度对体系成核与生长能力的影响,研究了不同温度和不同溶质离子浓度下体系中形成团簇的溶质离子数占总溶质离子数的比率以及沉积在晶体表面的溶质离子分数,结果见图9。从图9发现,温度升高时形成团簇的溶质离子分数显著增加,343 K和388 K时溶液中形成团簇的溶质离子分数达到63%以上,而较低温度下则低于50%,甚至只有36.7%的溶质离子形成了团簇。各温度下沉积到晶界的溶质离子分数变化不大,但在343 K和388 K时仍然是最高的。说明这两个温度条件不仅有利于溶质离子团簇成核,而且有利于无水碳酸镁晶体的继续生长。当温度一定时体系中形成团簇的溶质离子分数随着溶质离子浓度的增加而逐渐升高,当溶质离子浓度为4.56 mol/L时溶液中形成团簇的溶质离子分数达到76.87%。而对于沉积到晶界的溶质离子分数,则随着溶质离子浓度的升高并没有增长的趋势,除溶质离子浓度为3.99 mol/L时沉积到晶界的溶质离子分数明显较高(32.14%)外,其余各浓度下的溶质离子分数都比较低。说明在高溶质离子浓度条件下溶质离子易于在溶液本体中形成团簇,进而成核。

图9 不同温度(a)和不同溶质离子浓度(b)下形成团簇的溶质离子分数Fig.9 Ratio of solute ion numbersof clustersformed at different temperature(a)and soluteion concentration(b)
2.2.3 团簇稳定性及其演化
为进一步研究温度和溶质离子浓度对于碳酸镁溶液结晶成核团簇演化的影响机制,通过计算不同时刻体系中形成团簇的溶质离子分数,分析了不同条件下团簇的稳定性以及演化规律,结果见图10。从图10a看出,在较低温度下随着模拟时间的增加形成团簇的溶质离子分数首先呈波动状态,2 500 ps后基本保持不变。说明前期形成的团簇是不稳定的,不断地形成与破坏,一段时间后才能达到稳定状态,团簇数量和尺寸基本保持不变。而在较高温度下随着模拟时间的增加形成团簇的溶质离子分数呈不断增长的趋势,团簇数量逐渐增加,并且在后期形成了尺寸较大的团簇。说明高温有利于团簇的进一步生长,团簇较稳定,能够形成尺寸较大的团簇。从图10b看出,溶质离子浓度对于团簇的稳定性没有明显的影响,因为溶质离子浓度主要影响的是团簇形成的数量,而团簇演化的特点则是由体系中粒子能量的差异决定。在一定的溶质离子浓度范围内,不同粒子所能获得的能量差异与溶质离子浓度的关系并不大,因此溶质离子浓度对团簇的演化特性影响不大。

图10 不同温度(a)和不同溶质离子浓度(b)条件下团簇的演化规律Fig.10 Evolution of clustersat different temperature(a)and solute ion concentration(b)
2.2.4 团簇的水合特征
为比较不同条件对Mg2+和H2O结合的干扰能力,进而指导无水碳酸镁的形成,对不同条件下水分子的O和Mg2+的RDF进行了分析,结果见图11。从图11看出,不同条件下出峰的位置均相同,但峰高不同。第一个峰出现在0.196 nm处,峰型非常尖锐和狭窄,表明Mg2+的第一配位层被一定数量的水分子包围,峰值越高Mg2+周围的水分子就越多。从图11a看出,高温有利于Mg2+脱水,388 K时Mg2+周围的水分子是最少的。从图11b看出,高溶质离子浓度下溶质离子数目增加,碰撞几率增大,周围水分子相对较少。当溶质离子浓度为3.99 mol/L时Mg2+第一配位层的水分子是最少的。Mg2+周围的水分子越少,单个溶质离子越易于脱水从而与CO32-碰撞结合形成团簇,团簇的进一步成核和生长对无水碳酸镁的形成非常有利。

图11 不同温度(a)和不同溶质离子浓度(b)下Mg2+-O的RDF图Fig.11 RDFof Mg2+-Oat different temperature(a)and solute ion concentration(b)
3 结论
1)碳酸镁溶液体系中溶质离子在不同条件下扩散系数的降低机制,是由离子密度稠密区域和其中团簇的形成以及团簇趋向于晶界面沉积的特点所决定,特别是在较高浓度时存在尺寸效应的影响。
2)团簇在高温时更多地用于晶体生长,可以得到较大的无水碳酸镁晶体,晶型也更加完整。在研究范围内,溶质离子浓度一定(1.71 mol/L)时,343 K和388 K为团簇成核和生长的最佳温度,溶液中形成团簇的溶质离子分数达到60%以上,吸附在晶界的溶质离子分数分别为26.7%和28.33%,而在较低温度下只有6.7%的溶质离子吸附于晶界。另外,388 K对Mg2+和H2O的结合干扰最大,对无水碳酸镁的形成非常有利。
3)高溶质离子浓度时团簇更多地在溶液本体中成核,当溶质离子浓度为4.56 mol/L时溶液中形成团簇的溶质离子分数为76.87%,结晶器内具有较高的生产能力,可以在较短的时间内得到一定大小的晶体产品。在研究条件范围内,温度一定(298 K)时溶质离子浓度为3.99 mol/L最有利于晶体生长,吸附在晶界的溶质离子分数为32.14%,且该溶质离子浓度起到了最佳的脱水效果,有利于形成无水碳酸镁。
