肝切除术后急性门静脉血栓形成的诊疗进展
2022-03-11陈宝君王良严哲童翾王开宇肖鸣黄鑫张琪佳张启明张凌凯李德才项灿宏
陈宝君,王良,严哲,童翾,王开宇,肖鸣,黄鑫,张琪佳,张启明,张凌凯,李德才,项灿宏
(1.青海大学研究生院,青海西宁810000;2.北京清华长庚医院肝胆胰中心,北京102218;3.青海大学附属医院肝胆胰外科,青海西宁810000)
门静脉血栓(portal vein thrombosis,PVT) 是指产生于门静脉系统和(或)其分支的血栓[1],是腹部手术后需警惕的严重并发症之一。以往的研究多聚焦在肝移植、脾切除和胰腺术后,近年来,肝切除术后PVT 开始在临床上引起注意,它通常起源于手术操作区域[2]。肝切除术后急性与慢性PVT 是同一疾病的连续阶段[3],有研究[4-5]提出术后30 d 内发生的为急性PVT,也有文献[3,6]将PVT 发生后,门静脉没有形成侧支循环定义为急性PVT。其发病隐匿,临床表现不典型,早期诊断困难,然而病情进展迅速,若无及时干预血栓会沿着门静脉系统蔓延扩展,入肝血流急剧减少,可能导致肝衰竭、肠道瘀血坏死、多器官功能衰竭等严重的并发症甚至死亡,且目前尚未形成诊疗共识。
笔者以(“肝切除”或“肝脏术后”) 和(“门静脉血栓”或“血栓”)为关键词在中国知网、维普和万方数据库检索中文文献,以“hepatectomy” OR “hepatic resection” OR “hepatic surgery” OR “liver,resection” OR “liver,surgery”AND “portal vein” OR “portal,vein” AND“thrombosis” 为 关 键 词 在 Web of Science、ScienceDirect、Springer、PubMed、Medline、Wiley Online Library 和Ovid 等数据库检索英文文献,发现国内外报道的肝切除术后PVT 的发生率和病死率存在较大差异(表1),国内的文献报道较少,发生率为0.21%~24.72%,病死率高达50%以上,大部分死于肝衰竭;国外,尤其是日本学者的研究较多,发生率为2.1%~20.0%,病死率低于10%,甚至没有死亡病例。对比发现,国内对肝切除术后PVT 的预防和诊疗还需进一步规范,以提高患者存活率,改善患者预后。现对肝切除术后PVT的病因、临床表现、诊断、治疗、预防和预后进行探索和研究。
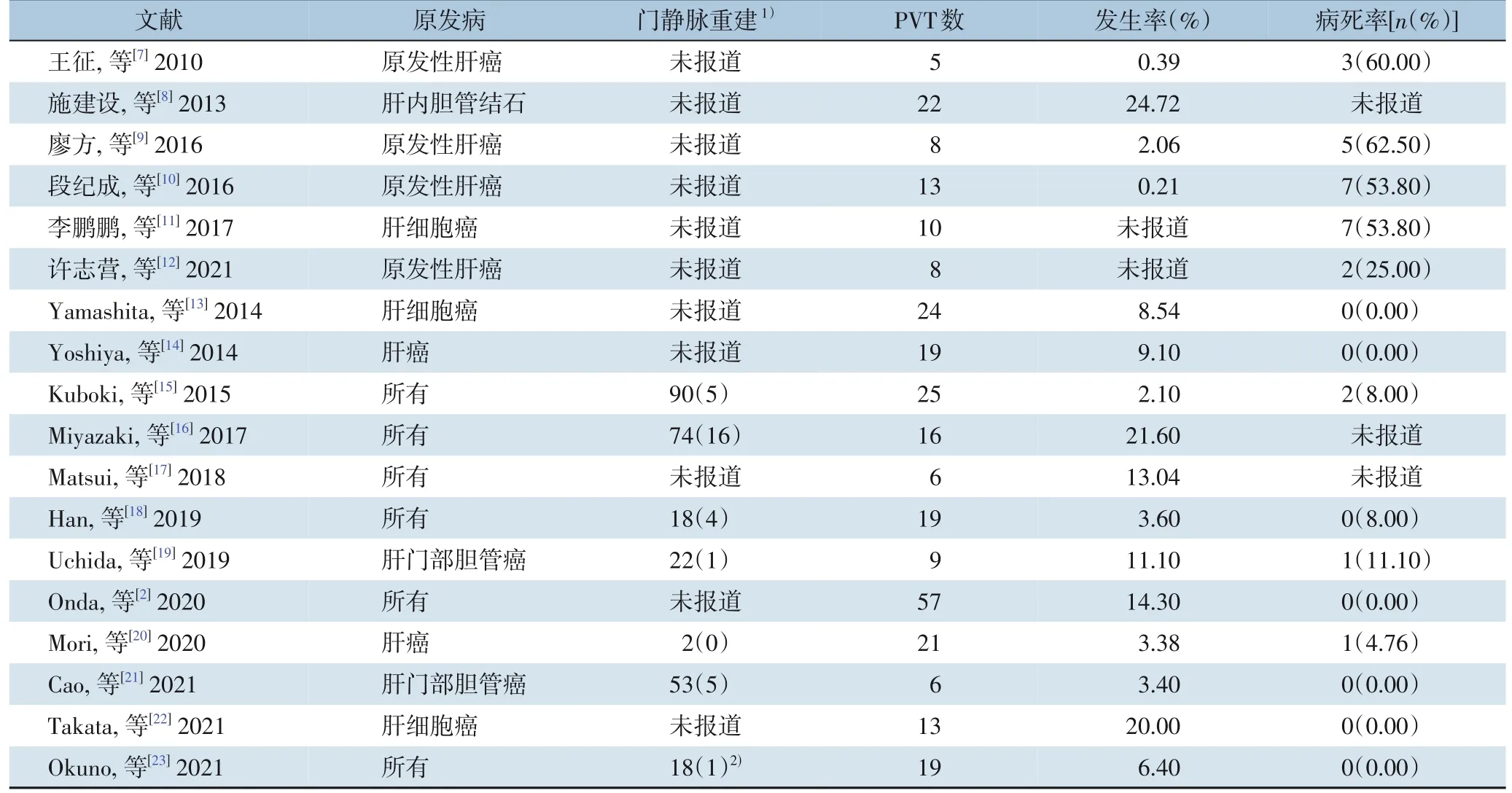
表1 国内外关于肝切除术后PVT形成的文献报道Table 1 Chinese and foreign literature on PVT after hepatectomy
1 病因
肝切除术后PVT 发生的危险因素包括非手术因素和手术因素。非手术因素包括术前存在肝硬化[2,23]、肝细胞癌[13]、高龄(>70 岁)[20]和D-二聚体升高[8,23]等;手术因素包括:术中频繁的肝门阻断和长时间的肝门阻断[2,14,18-19,22,24]、合并门静脉重建[16,18,21,25-26]、右三肝或右半肝切除[14-15]、大范围肝切除[2,14,20]、尾状叶切除[15]、合并脾切除[15]、手术时间长[2,13-14]、胆汁漏[2,15]、合并肝外胆管切除[15]等。肝切除术后PVT 形成与门静脉高压、血流缓慢、手术导致血管内皮损伤、凝血功能紊乱等多方面因素相关[27]。据报道[28],70%的肝硬化患者术前即存在血栓形成倾向。术中行肝门阻断会损伤血管内皮细胞,使内皮下胶原暴露,促使PVT 形成[24],Onda 等[2]发现,肝切除术中行选择性或全肝门间断性阻断(阻断15 min,再灌注5 min,重复进行),总阻断时间超过75 min 是PVT 形成的独立危险因素。Miyazaki 等[16]发现肝胆胰手术合并不同的门静脉重建术式,术后PVT 发生率有显著差异(P<0.05)。右侧肝切除术后PVT 发生率高,与术后残肝体积小、腹腔内位置不固定,导致门静脉扭曲、血流瘀滞有关[16,20],术后超声监测门静脉血流速度<15 cm/s 是预测PVT 发生的独立危险因素[29-30]。Cao 等[21]研究显示术后门静脉夹角<100°;残余肝内门静脉直径<5.77 mm 是PVT 发生的危险因素(图1),而Uchida 等[19]进行同样的研究显示术后门静脉夹角<90°;残余肝内门静脉与门静脉主干直径比<45%是PVT 形成的危险因素,这些研究解释了术后门静脉扭曲导致PVT 发生,但两者的研究都受限于病例数量,无法得出一致临界值。手术时间越长,肝缺血和门静脉受牵拉的时间越久,也增加了腹腔感染的机会,手术时间超过360~430 min 是PVT 形成的独立危险因素[2,13]。有报道[31]称多次手术增加了腹腔感染的机会,从而导致术后PVT 形成。

图1 肝切除术前及术后门静脉夹角A:术前门静脉夹角;B:右半肝切除术后门静脉夹角(改画自Cao,等[21])Figure 1 The portal vein angle before and after hepatectomyA:The portal vein angle before surgery;B:The portal vein angle after right hepatectomy(adapted from Cao,et al.[21])
2 诊断
肝切除术后PVT 平均在术后第7 天被发现[12,20,22,24,32],患者无任何症状体征或临床表现缺乏特异性,常不能引起临床医生的重视。Kuboki等[15]总结急性肝切除术后25 例PVT 患者显示:20.0%无症状,80.0%出现发热,60.0%出现腹痛、腹胀等症状,32.0%的患者出现肝衰竭。Onda 等[2]目前最大样本量的研究发现,肝切除术后42.0%(n=24)的PVT 患者无任何症状,主要由术后影像学检查发现。Takata 等[22]对13 例肝切除术后PVT 患者的研究显示,62.0% 的PVT 患者无任何症状,38.0%的患者出现Clavien‐Dindo 1~2 级与PVT 相关的腹水,无Clavien‐Dindo 3 级以上的并发症。Okuno等[23]发现肝切除术后100%的PVT 患者(n=19)无任何症状体征,全部由术后第7 天腹部增强CT 确诊。因此,单纯依靠临床表现诊断PVT 不具备可行性。术后D-二聚体明显变化[8,15,22-23]和肝功能指标丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST) 和胆红素等好转过程中突然急剧恶化[9,11-12]提示PVT 形成,但在某些病例中会有延迟,仅通过实验室检验诊断PVT 可能会错失最佳治疗时机。
肝切除术后PVT 主要通过影像学检查确诊(图2)。超声对PVT 的敏感度为89.0%,特异度为92.0%[33],但研究发现超声对肝切除术后PVT 的诊断易受腹部手术的影响,如肠气的干扰、解剖位置的改变等,其敏感度仅为56%[15],相比之下,腹部增强CT 具有较高的敏感度(90.0%) 和特异度(99.0%)[34],因此在临床高度怀疑PVT 而超声检查阴性时,应立即行增强CT 检查。超声和CT 检查并不能发现所有的PVT,文献[22]报道即使术后超声或CT 未发现PVT,增强CT 显示有肝坏死表现,也应按PVT 处理。磁共振血管成像受到费用和耗时的限制,不适合应用于术后急性PVT 形成检查。门静脉造影是诊断PVT 的金标准,现已不作为常规检查,但其可在确诊后同期行溶栓治疗。对于肝癌肝切除术后PVT 形成,影像学上须与肿瘤复发导致的门静脉癌栓相鉴别[35]。为了在肝切除术后尽早诊断PVT,Kuboki 等[15]建议术后每日超声监测门静脉血流直至术后第3 天或更久,术后第7 天复查腹部增强CT 筛查;Onda 等[2,14]建议肝切除术后第7 天常规行增强CT 检查以筛查PVT,而不是出现肝功能异常的临床表现后才进行CT 检查[36]。
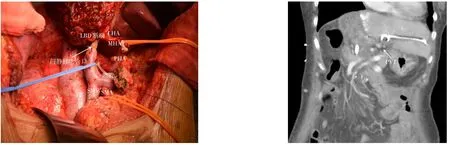
图2 69岁女性肝门部胆管癌患者,行右半肝联合胰十二指肠切除,术中行门静脉重建,术后第9天增强CT提示PVT(图片来自北京清华长庚医院收治的1例急性肝切除术后PVT患者的术中照片和术后CT图像)Figure 2 A 69-year-old women with hilar cholangiocarcinoma undergoing right hepatectomy and pancreaticoduodenectomy with intraoperative portal vein reconstruction and the Enhanced CT showing PVT(from the intraoperative photos and postoperative CT images of a patient with acute PVT after hepatectomy in Beijing Tsinghua Changgung Hospital)
3 治疗和预后
肝切除术后PVT 患者的预后差异很大,从血栓完全消失到血栓沿门静脉系统蔓延直至死亡。在未接受任何治疗的患者自然病程中,48.0%的患者PVT 蔓延扩大,可导致肠系膜缺血、肠梗死、脓毒症和消化道大出血而危及生命,45.0%的患者临床症状自发改善,7.0%的患者血栓长期稳定[14]。肝切除术后PVT 的治疗目标为清除血栓、门静脉再通和阻止血栓蔓延,其主要治疗方式包括:抗凝、溶栓和手术等,主要依靠经验进行个体化治疗。总结抗凝治疗对于肝切除术后PVT 的再通率和并发症发生率的文献报道(表2),抗凝治疗有较好的有效性和安全性,由于部分再通的门静脉有血栓复发的风险,文献认为抗凝时间至少3 个月,对于有血栓形成遗传倾向的患者,抗凝时间至少6 个月,甚至需要终身抗凝[3,37]。但文献中抗凝方案不一,而且小的PVT 无需抗凝即可自发消退,这些因素限制了研究结果的可靠性,因此需要更大样本量的研究来验证抗凝治疗的价值。目前尚无肝切除术后PVT 溶栓治疗价值及时机方面的研究,肝切除术后PVT 的溶栓治疗只见于极少数的病例报道。Kuboki 等[15]比较了抗凝治疗和手术治疗的疗效,对于肝切除术后5 d 及以内发生的新鲜血栓,手术取栓门静脉再通率显著高于抗凝治疗[100% (n=7)vs.80.0% (n=4),P=0.013];但对术后6 d 及以后发生的血栓,手术取栓效果较差[50.0%(n=2)vs.88.9%(n=9),P=0.891],此时建议首选抗凝治疗。Miyazaki 等[16]的研究同样证实,肝切除术后3 d 以内比5 d 以后施行手术能更有效地恢复门静脉血流[83.3% (5/6)vs.0 (0/3),P<0.02]。血栓机械抽吸和血管球囊扩张也被用于PVT的治疗[38-39],Woo 等[40]总结了数例肝移植后使用介入技术(包括溶栓、球囊扩张、机械抽吸等)治疗PVT 的病例,提示效果良好,但尚无应用于肝切除术后的文献报道。

表2 关于肝切除术后PVT抗凝治疗的文献报道Table 2 Reports about the anticoagulant therapy for PVT after hepatectomy
Han 等[18]提出肝切除术后PVT 患者只要没有抗凝禁忌证应立即开始抗凝治疗,对于合并门静脉重建的患者,应先手术取栓,然后抗凝治疗。Onda 等[2]提出了以PVT 分类(图3)为导向的新治疗策略,建议门静脉外周和主干1 级血栓仅观察即可,门静脉主干2 级和肝门部血栓行抗凝治疗,门静脉主干3 级血栓行血栓切除术,该治疗策略在其研究中显示较高的血栓清除率(91.0%)。总结目前已有的研究结果,对于肝切除术后早期(3~5 d内)发现的门静脉主干完全或接近完全阻塞的PVT患者,多项研究已形成基本共识,即立即手术取栓,结合抗凝和/或溶栓治疗;而对于术后较晚期(3~5 d 后)发现的患者,一般手术取栓效果不佳,建议采取抗凝、溶栓等治疗方式;门静脉主干未完全阻塞的PVT 患者,可暂观察,或结合患者个体情况,选择抗凝、溶栓,对于这一部分患者的治疗,还需进一步探索旨在改善预后的治疗组合和模式。
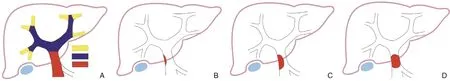
图3 PVT的分类和分级A:红色示门静脉主干血栓,紫色示肝门部PVT,黄色示外周PVT;B:门静脉主干1级血栓;C:门静脉主干2级血栓;D:门静脉主干3级血栓(改画自Onda,等[2])Figure 3 Classification and grading of PVTA:Red color showing the thrombus in main truck of the portal vein,purple color showing the hilar PVT,and yellow color showing the peripheral PVT;B:Grade 1 thrombus in main truck of the portal vein;C:Grade 2 thrombus in main truck of the portal vein; D:Grade 3 thrombus in main truck of the portal vein(adapted from Onda,et al.[2])
4 预测和预防
Takata 等[22]提出肝癌肝切除术后第1 天血清凝血酶-抗凝血酶III 复合物(thrombin‐antithrombin III complex,TAT) 水平和第3 天D-二聚体水平分别是术前的5.73 倍和7.22 倍以上时,即可怀疑为PVT。Okuno 等[23]发现肝切除术后第3 天血浆抗凝血酶III (antithrombin III,AT‐III) 活性≤60% 预测PVT 形成的灵敏度和特异度分为74%和59%,但预防性补充AT‐III 对降低术后PVT 发生率无显著意义[5.4% (n=3)vs.10.7% (n=6),P=0.489]。Matsui等[17]发现可溶性糖蛋白VI (soluble form of glycoprotein VI,sGPVI)是血小板活化的特异性标志物,血管性假血友病因子(Von Willebrand factor,VWF) 和血管性假血友病因子前肽(VWF propeptide,VWFpp) 是血管内皮细胞损伤的标志物,可以通过检测血清sGPVI/血小板的比值和VWF、VWFpp 水平来预测肝切除术后PVT 形成。
对于存在肝切除术后PVT 风险的患者,目前没有公认的预防方案,有研究[13,15,20]认为预防性抗凝、改善术中操作、改进手术器械能降低PVT 发生率。预防性抗凝对降低肝切除术后PVT 发生率的价值尚存在争议(表3)。Kuboki 等[15]术中将冗长的门静脉后壁与下腔静脉前壁缝合,以减轻门静脉扭曲,血栓发生率有所降低但差异无统计学意义。Onda 等[2]提出术中在门静脉周围柔和的拉伸和仔细的解剖可预防PVT 形成。Mori 等[20]发现腹腔镜肝切除术后PVT 发生率高,可能与止血器械对门静脉壁的热损伤有关,改用短时间的软凝系统进行止血后,PVT 发生率由3.4%下降到1.9%。
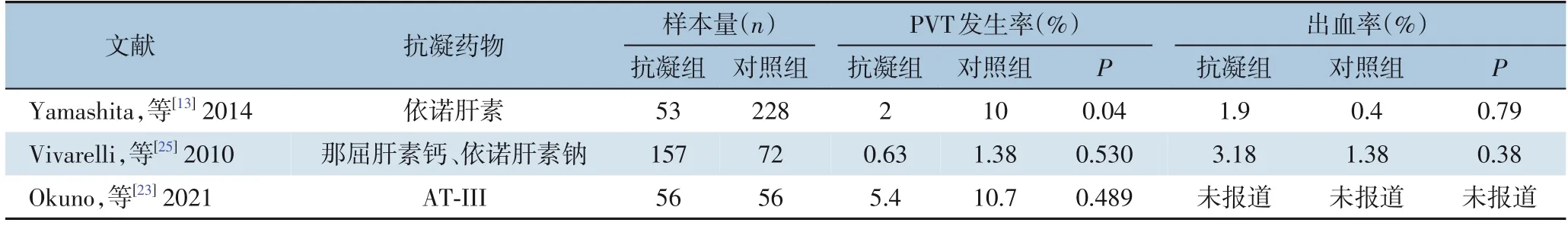
表3 肝切除术后预防性抗凝对PVT发生的影响的文献报道Table 3 Reports about influence of prophylactic anticoagulant therapy on occurrence of PVT after hepatectomy
5 总结
肝切除术后PVT 成因复杂,危险因素众多,包括非手术因素(肝硬化、肝细胞癌、高龄)和手术因素(术中频繁的肝门阻断和长时间的肝门阻、合并门静脉重建、右三肝或右半肝切除、大范围肝切除、尾状叶切除、合并脾切除、手术时间长、胆汁漏、合并肝外胆管切除等)。其临床表现无特异性、部分患者无任何临床表现,早期诊断困难,肝切除术后D-二聚体和胆红素等实验室指标有诊断意义,但主要由腹部增强CT 确诊。PVT 形成后,若不及时干预,发展为肝衰竭等严重并发症的风险高,病死率高。对于肝切除术后PVT,目前尚无明确的防治方案和指南,需要引起肝胆胰外科医生的重视。早发现、早治疗是改善患者预后的关键,关于肝切除术PVT 的诊疗还需进一步研究和探索。
利益冲突:所有作者均声明不存在利益冲突。
