脂质运载蛋白2在乳腺癌侵袭转移中的作用机制
2022-03-11叶芸李彦姝张红艳李丰
叶芸,李彦姝,张红艳,李丰
(中国医科大学生命科学学院分子细胞生物学教研室,国家卫生健康委员会细胞生物学重点实验室暨教育部医学细胞生物学重点实验室,沈阳 110122)
乳腺癌是女性最常见的恶性肿瘤之一,发病率呈逐年上升趋势,是一种严重影响妇女身心健康甚至危及生命的恶性肿瘤[1]。虽然近半个世纪以来其综合治疗取得了重要进展,但每年仍约有30%以上的患者死于复发和转移。乳腺癌的转移是一个复杂的过程,涉及多种信号通路和分子[2]。因此,寻找和分析乳腺癌转移的机制非常重要。
脂质运载蛋白2(lipocalin-2,LCN2)是lipocalin蛋白超家族的成员,是一种分泌的糖蛋白,可转运小的亲脂性配体。Lipocalin蛋白超家族显示出有限的氨基酸序列相似性,但共有高度保守的3D结构。该结构由单个8链,反平行的β-桶组成,该桶形成一个封闭的结构,能够灵活结合并允许脂环蛋白转运和呈递配体,与细胞表面受体结合并形成大分子复合物,从而在细胞调节、增殖和分化中执行各种重要功能[3]。在过去的二十年中,已经发现LCN2在多种器官的病理条件下异常表达,包括炎症[4],肾脏功能损害[5],肝脏功能损害[6]和几种人体器官肿瘤[7]。目前,LCN2作为人类癌症的一个潜在生物标志物和调节剂而备受关注,成为预测肿瘤和肿瘤防治的研究热点。本研究旨在探讨LCN2在乳腺癌细胞和组织中的表达、定位,以及LCN2对于乳腺癌细胞侵袭转移的影响,为后续研究打下基础。
1 材料与方法
1.1 材料
1.1.1 细胞系与乳腺癌组织切片:人乳腺上皮细胞HBL100、人乳腺癌MCF-7、ZR-75-1、ZR-75-30、MDAMB-231、T47D细胞购自中科院上海细胞所。10例人乳腺癌组织切片样本来自中国医科大学附属第一医院。
1.1.2 试剂:RIPA裂解液购自普利莱基因技术有限公司;转染试剂Lipofectamine 2000购自美国Invitrogen公司;GAPDH抗体购自上海康成生物工程有限公司;LCN2抗体、E-cadherin抗体、Claudin-1抗体和Slug抗体购自美国cell signaling生物公司;β-actin抗体、细胞培养基和血清购自上海life公司;ECL发光液购自美国Thermo Fisher公司;Alexa Fluor 488标记二抗购自美国Thermo Fisher Scientific公司;DAPI核染料购自美国Sigam公司;S-P免疫组化试剂盒购自福州迈新生物技术开发有限公司。Flag-LCN2过表达慢病毒购自上海吉凯公司。
1.2 方法
1.2.1 细胞培养:HBL100、T47D、ZR-75-30和ZR-75-1细胞系在RPMI-1640培养基中培养,MCF-7细胞系在含有0.01 mg/mL人胰岛素的最低必需培养基(Eagle’s minimum essential medium,EMEM)中培养,MDA-MB-231细胞在L-15培养基中培养。培养基中含有10%胎牛血清和青链霉素等,培养条件为37℃、5%CO2,将细胞培养至对数生长期。
1.2.2 Western blotting:将乳腺癌细胞系常规培养至对数生长期,加入200 μL含有蛋白酶抑制剂的RIPA裂解液,冰上放置20 min,裂解乳腺癌细胞。12 000g,4 ℃ 离心20 min,收集上清蛋白,取上清5 μL进行总蛋白定量。30 μg总蛋白经10% SDS-PAGE凝胶分离,4 ℃过夜恒压转移至PVDF膜上,5%脱脂奶粉封闭2 h,洗膜15 min×3次。分别用兔抗人LCN2抗体(1∶2 000稀释),E-钙黏连蛋白(E-cadherin)抗体,紧密连接蛋白(Claudin-1)抗体,波形蛋白(Vimentin)抗体以及锌指转录因子(Slug)抗体,4 ℃孵育过夜,TBST洗膜15 min×3次。再用辣根过氧化物酶标记的山羊抗兔、山羊抗鼠(1∶5 000稀释)二抗常温孵育1 h,TBST洗膜15 min × 3 次。ECL显色,压片。GAPDH作为上样量是否一致的内参。
1.2.3 免疫组织化学:10例乳腺癌组织切片经过脱蜡和水合后,进行高压锅抗原修复、山羊血清封闭。切片用稀释的LCN2抗体(1∶200)在4 ℃孵育过夜。PBS洗3次,辣根过氧化物酶标记山羊抗兔IgG常温孵育2 h。DAB辣根过氧化物酶底物显色。苏木素染核后,组织切片脱水,中性树胶封片。光学显微镜进行图片采集。
1.2.4 激光共聚焦扫描显微镜:过表达LCN2的MCF-7细胞培养于盖片上,去除培养基,用预冷PBS清洗2次。加入4%多聚甲醛常温固定细胞10 min;加入0.1%的Triton X-100对细胞膜进行透化10 min,PBS清洗5 min×3次;山羊血清封闭30 min,弃掉封闭液;加入稀释的LCN2抗体(1∶200),4 ℃孵育过夜,PBS洗5 min×3次;加入Alexa Flour594标记的二抗(1∶200)室温避光孵育2 h,PBS洗5 min×3次;DAPI(1∶1 000)室温避光孵育10 min,PBS洗5 min×3次。甘油封片,应用激光共聚焦扫描显微镜观察LCN2在MCF-7细胞中的定位。激发光波长分别为594 nm和340 nm,可看到LCN2蛋白在细胞内的定位处呈现红色,DNA染色呈现蓝色。
1.2.5 慢病毒感染细胞构建稳定过表达LCN2细胞系:利用LCN2过表达慢病毒感染MCF-7和T47D细胞系,并成功构建MCF-7/LCN2稳定表达细胞系以及T47D/LCN2稳定表达细胞系,感染步骤按照吉凯公司慢病毒说明书进行,感染24 h后,换成正常培养基培养,3 d后,2 μg/mL嘌呤霉素筛选阳性细胞,收集细胞提取蛋白进行Western blotting 检测。Western blotting 数据结果利用ImageJ软件进行灰度值分析。
1.2.6 Transwell迁移能力检测:24孔板中每孔加入500 μL含血清培养基,置入Transwell小室,对T47DCON细胞和T47D-LCN2细胞分别进行细胞计数后,于小室中各加入20 000个细胞(不含血清的培养基),孵箱培养18 h,取出小室,镜下观察有细胞穿过,终止。95%乙醇固定,结晶紫染色,镜下拍照。
1.3 统计学分析
采用GraphPad Prism v6.0和SPSS 17.0软件对各组细胞中蛋白灰度值进行Student’st检验(双侧)分析差异表达。P< 0.05为差异有统计学意义。
2 结果
2.1 LCN2在乳腺癌细胞系中的表达
结果显示,LCN2在HBL100细胞系中几乎不表达,在ZR-75-1细胞系和MDA-MB-231细胞系中高表达,β-actin为内参对照,见图1。
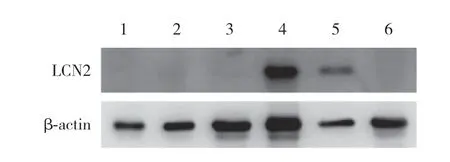
图1 LCN2在正常人乳腺上皮细胞及不同乳腺癌细胞系中的表达Fig.1 The expression of LCN2 protein in normal mammary epithelial cells and different human breast cancer cell lines
2.2 LCN2在乳腺癌组织中的定位
免疫组织化学检测LCN2在乳腺肿瘤组织切片中的表达,以苏木素染细胞核。结果显示,LCN2主要表达于乳腺癌组织细胞质中(图2),图2A展示LCN2低表达,图2C展示LCN2高表达,图2B和图2D分别是图2A和图2C放大后的图像。
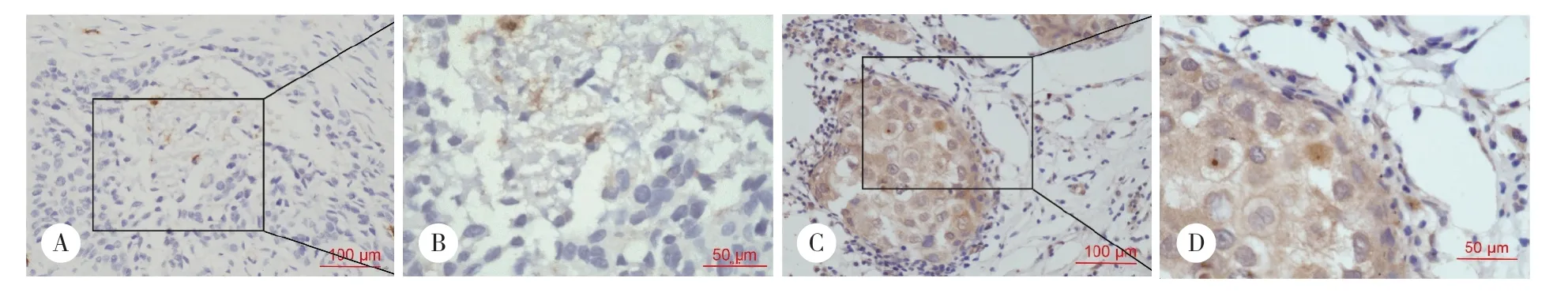
图2 LCN2主要表达于乳腺癌组织的细胞质内Fig.2 LCN2 protein was localized mainly in the cytoplasm of breast cancer cells
2.3 LCN2在乳腺癌MCF-7/LCN2细胞系中的定位
利用LCN2过表达慢病毒感染MCF-7细胞系,并成功构建MCF-7/LCN2稳定表达细胞系。激光共聚焦扫描显微镜下观察LCN2蛋白为红色,细胞核为蓝色,两图叠加显示为完整图像。结果显示,红色的LCN2蛋白主要定位于细胞质中,见图3。
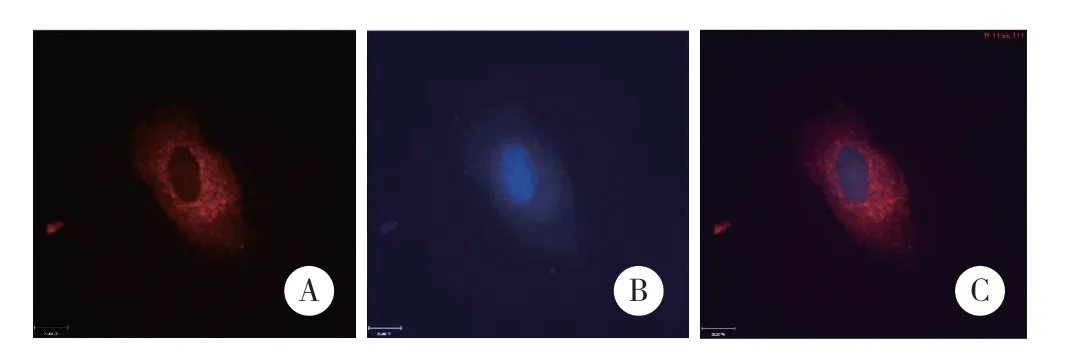
图3 激光共聚焦扫描显微镜观察LCN2在MCF-7/LCN2细胞内的定位 ×600Fig.3 The localization of LCN2 was determined by laser scanning confocal microscopy ×600
2.4 LCN2促进乳腺癌细胞的侵袭转移
采用Flag标签的LCN2过表达慢病毒感染T47D细胞,构建稳定表达LCN2的T47D细胞系。Western blotting验证成功构建了过表达LCN2的乳腺癌T47D细胞系(图4A)。本研究检测了E-cadherin,Claudin-1,Vimentin和Slug等与上皮间质转化(epithelial mesenchymal transition,EMT)发生相关的标志物,结果显示,E-cadherin和Claudin-1蛋白表达明显降低(图4B、4D),而Slug以及Vimentin表达明显增高,GAPDH为内参对照(图4C、4E)。
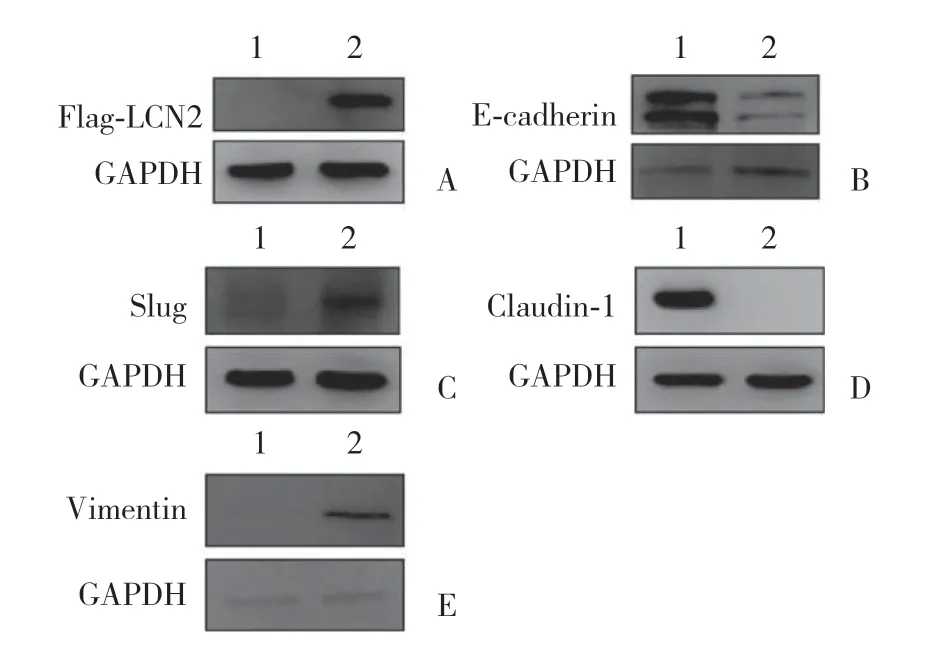
图4 蛋白印迹法检测过表达LCN2的人乳腺癌细胞T47D中的E-cadherin和Claudin-1、Vimentin、Slug的蛋白表达Fig.4 Western blotting analysis shows the protein level of Claudin-1,E-cadherin,Vimentin,and Slug in human T47D breast cancer cells overexpressing LCN2
2.5 LCN2促进乳腺癌细胞的迁移
Transwell实验结果显示,与对照组T47D-CON组相比,稳定表达LCN2的T47D细胞的迁移能力增强,见图5。

图5 Transwell实验检测过表达LCN2的人乳腺癌细胞T47D的迁移Fig.5 The migration of human T47D breast cancer cells overexpressing LCN2 is detected by Transwell
3 讨论
LCN2是一种分泌的糖蛋白,在大多数人体组织中呈低水平表达,但在侵袭性肿瘤亚型中含量很高,包括乳腺癌,胰腺癌,甲状腺癌,卵巢癌,结肠癌和胆管癌。高水平的LCN2与细胞增殖,血管生成,细胞侵袭和转移有关,解释和支持LCN2致癌和转移潜能的机制包括多种信号途径的激活[8]。因此,LCN2已成为对抗多种癌症的潜在治疗靶标。
本研究检测了LCN2在不同分子亚型乳腺癌细胞系中的表达水平,结果显示,LCN2在不同乳腺癌细胞系中表达水平不同,这提示LCN2表达水平或许与乳腺癌的分子分型相关[9]。据此,本研究选择低表达LCN2的MCF-7及T47D细胞构建MCF-7/LCN2稳定表达细胞系以及T47D/LCN2稳定表达细胞系,为后续研究打下基础。值得注意的是,在癌症中,EMT与侵袭性细胞的产生和癌症干细胞特性的获得有关,是肿瘤细胞获得转移特征的潜在机制[10-11],且 JIN等[12]的研究结果显示,LCN2衍生的环状RNA(hsa_circ_0088732)抑制胶质瘤中的细胞凋亡并促进EMT。另有研究[13]报道,在前列腺肿瘤中CXCL1-LCN2轴激活Src信号传导触发EMT,从而促进前列腺癌细胞的迁移,导致肿瘤转移增强。故本研究检测了过表达LCN2的乳腺癌细胞系T47D中的E-cadherin,Claudin-1,Vimentin和Slug等 与EMT发 生相关的标志物的表达水平,结果显示,LCN2可能通过诱发EMT促进乳腺癌细胞的侵袭转移,为进一步研究LCN2在乳腺癌中侵袭转移的机制打下基础,后续本研究亦通过transwell实验证实LCN2促进乳腺肿瘤细胞的迁移。另外,1项近期的有关乳腺癌的研究[14]分析了LCN2的表达和亚细胞定位与临床病理因素和患者预后的关系,结果显示,LCN2核表达的缺乏或减少与侵略行为的特征有关,这与本研究中免疫组织化学以及激光共聚焦扫描显微镜的研究结果相符,在乳腺肿瘤组织和细胞中,LCN2主要定位于细胞质。本研究为寻找LCN2诱发EMT进而促进乳腺癌细胞侵袭转移的分子机制打下基础。
总之,LCN2可能是乳腺肿瘤进展的一种非侵入性诊断和预后生物标记,使乳腺癌细胞中的LCN2沉默可以抑制肿瘤的进展,研究LCN2在乳腺肿瘤发生发展中的作用,揭示涉及到的信号通路和分子机制,对于预防和治疗乳腺癌具有重要意义。本研究为今后探讨LCN2促进乳腺癌侵袭转移的分子机制提供了一定的理论根据,具体相关的作用通路及靶点还有待深入研究。
