利伐沙班片经鼻胃管给药方式的体外试验研究
2022-03-11郭艳超马雯霞
唐 谦,郭艳超,周 璐,马雯霞
1 浙江省药品化妆品审评中心,杭州 310012;2 杭州朱养心药业有限公司,杭州 310018
口服固体仿制药一致性评价旨在仿制药的研究过程中,力求在质量和疗效上与参比制剂一致性,是一系统评价工程,其内容包含体外药学研究、体内生物等效性研究。对于临床吞咽困难的患者,采用鼻饲管给药可以解决口服给药存在的缺陷和困难,此类药物在体外药学研究中,除了常规的溶出曲线对比,还应进行仿制药与参比制剂在经鼻饲管给药时、各物理指标的一致性,确保仿制药质量与参比制剂相同。
利伐沙班片在“用法用量”项下标明对于不能吞咽的患者可将药品分散于水中,通过鼻管或胃管给药。借鉴2020 年8 月美国FDA 发布的个药指南《Draft Guidance on Rivaroxaban》[1],提出了本品除体内生物等效性试验外,还包括体外鼻胃管给药的试验研究。本实验参考了相关文献[2],结合药物特性,开发鼻饲管给药体外研究方法,分别开展了沉降试验、粒径分析试验和回收试验等,经对比研究,在模拟鼻饲管给药的情况下,所选研究指标稳定,药物损耗可控,自制制剂与参比制剂均一致。本研究除了证明本公司自制品与参比制剂在特殊给药方式下、具有相同的体外给药效果,还给予同样给药方式的其他药物体外研究提供了参考。
1 仪器与药材
仪器:高效液相色谱仪Agilent1260;马尔文激光粒度仪Mastersizer 3000;电子天平XSE205。
药材:16 Fr(Fr 为管径单位French 的简称,1French=0.33 mm)规格的鼻胃管,灌注器;利伐沙班片自制品(批号:180601,含量103.5%,杭州朱养心药业有限公司);参比制剂(批号:BJ50488,含量100.9%,拜耳医药保健有限公司);利伐沙班对照品(批号:20200310,含量:100.0%,浙江省食品药品检验研究院标化);水为纯化水。
2 方法与结果
2.1 沉降试验
结合临床用药过程的时间,选0 min(代表刚配制完的时间,下同)和15 min 进行对比研究。
取12 片自制品压碎,倒入60 mL 注射器中,抽取50 mL 纯化水,剧烈振摇30 s 后,倒置注射器,静止15 min。记录0 min 和15 min 的沉降高度,重复以上操作,平行制备6 份供试品溶液。结果见表1。
从表1 可知,自制制剂与参比制剂的沉降情况无明显差异。
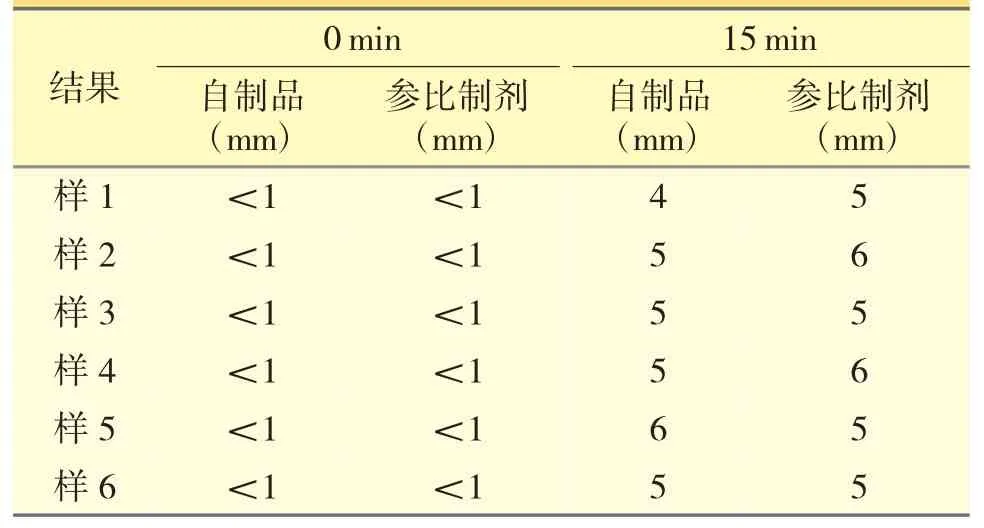
表1 沉降高度
2.2 粒径分析试验
《中国药典》收载的粒度及粒度分布测定法有3种,分别为显微镜法、筛分法、光散射法。其中光散射法更能准确对比自制品和参比制剂的粒度分布情况,结合临床用药过程,选择选0min 和15min 进行对比试验,两个时间点配制两组供试品溶液进行比较。
2.2.1 供试品溶液配制将自制品12 片压碎成小块状,全部投入60 mL 规格的灌注器内;吸取40 mL纯化水,上下剧烈振摇30 s,立即将灌注器与16 Fr规格的鼻胃管连接,将颗粒分散液收集到烧杯中;吸取分散介质5 mL,纯化水冲洗灌注器和鼻管,冲洗2 次,并收集到同一份烧杯中,即得0 min 供试品混悬液;剧烈振摇灌注器30 s,倒置灌注器15 min后再进行操作,得15 min 供试品混悬液。每个试验制备6 份样品,每份样品测3 次,取平均值。
2.2.2 粒径检测方法验证 样品折光率1.63,吸收率0.01,转速1000 r·min-1,遮光率10%~15%,内置超声关闭,分散介质为纯化水。按照“2.2.1”制备6份0 min 供试品溶液进行精密度试验。结果见表2。

表2 粒径检测精密度试验结果(μm,n=6)
12 份自制品的D50 的RSD%不大于10%,D10、D90 的RSD%不大于15%,中间精密度符合要求。
2.2.3 粒径分析对比试验取自制品与参比制剂按照“2.2.1”方法制备0 min 和15 min 样品进行粒径检测,粒径对比结果见表3。
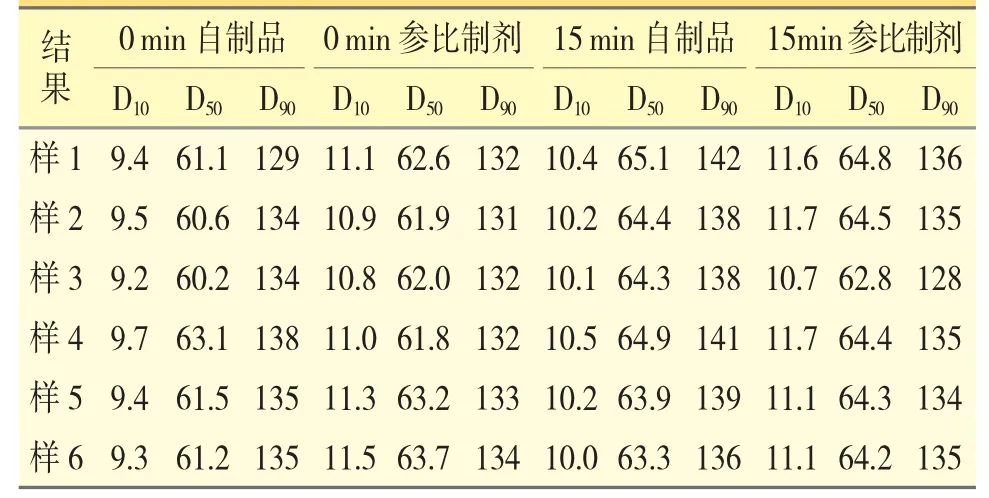
表3 自制品与参比制剂粒径测试结果(μm,n=6)
从表3 可知,自制品与参比制剂0 min 与15 min结果均无明显差异,说明经鼻胃管给药的粒径一致。
2.3 回收试验
利伐沙班属于难溶性药物,故在设计回收试验时,同时对比了直接加水混悬(模拟临床鼻胃管给药)和加稀释剂助溶后自制制剂与参比制剂的回收情况。
2.3.1 检测方法验证按照高效液相色谱法,用十八烷基硅烷键合硅胶为填充剂(Purospher Star RP endcapped,55 mm×4.0 mm,3 μm),乙腈-水(30∶70)为流动相,检测波长为250 nm,柱温为40 ℃,进样量10 μL。对检测方法进行方法验证,结果为:浓度在2.03~12.18 μg·mL-1,r 为0.999 9;回收率在99.71%~102.71%,RSD 为1.2%;6 份供试品重复性的RSD 为0.3%,12 份供试品中间精密度的RSD 为0.6%。从验证结果可知,方法准确可靠。
2.3.2 自制品与参比制剂回收对比试验精密称取利伐沙班对照品约10 mg,置20 mL 量瓶中,加稀释剂(乙腈-0.01 mol·L-1磷酸溶液,3∶2)超声溶解,冷却至室温,稀释至刻度,摇匀,吸取1 mL 置50 mL量瓶中,加入纯化水稀释至刻度,摇匀即得。
供试品溶液的制备:取自制品1 片压碎,全部投入60 mL 规格的灌注器内,吸取40 mL 纯化水,上下剧烈振摇30 s,立即将灌注器与16 Fr 规格的鼻胃管连接,然后使颗粒分散液经由灌注器和鼻胃管推入50 mL 量瓶内。吸取5 mL 的稀释剂后轻轻摇晃灌注器,使液体经由鼻饲管推入量瓶,对系统进行冲洗,重复两次,加入稀释剂稀释定容至刻度线。摇匀后过滤,取续滤液即得0 min 供试品溶液;振摇30 s,将灌注器倒置15 min 再行同法操作,即得15 min 供试品溶液。平行制备12 份样品。计算自制制剂(T)与参比制剂(R)的初始剂量回收率,并报告T/R 回收率比以及T/R 回收率比的可信区间,结果见表4、表5。
由表4、表5 回收试验结果可知,自制制剂在难溶的情况下(纯化水作为溶剂,模拟临床给药)和完全溶解情况下(纯化水作为溶剂,并加入助溶剂),主成分回收情况均与参比制剂一致。

表4 供试品溶液1(稀释剂为水)回收试验结果(%)
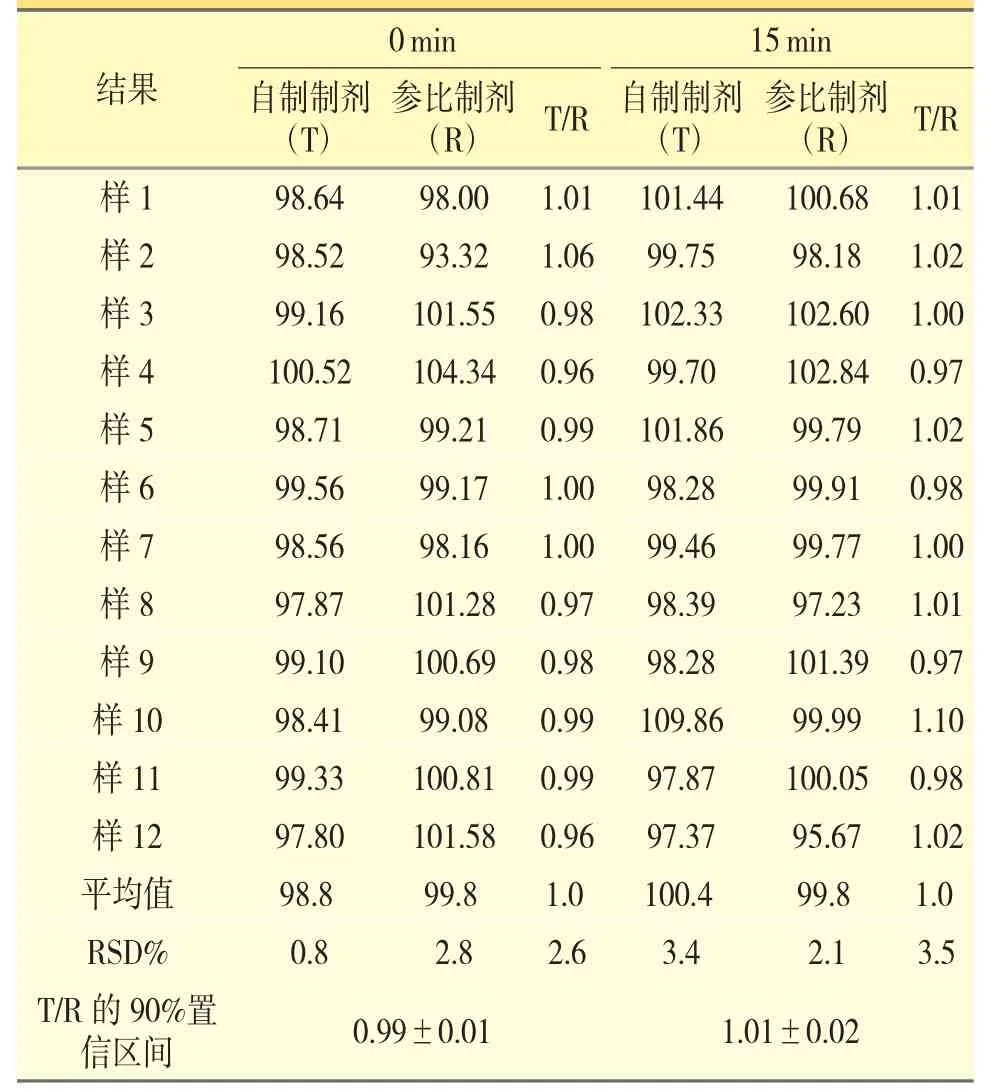
表5 供试品溶液2(稀释剂为乙腈)回收试验结果(%)
3 讨论
本实验样品属于普通口服固体制剂,且无pH依赖性,故在研究过程中未考察不同来源纯化水pH 值的影响,如为肠溶制剂可参考相关文献[2]进行不同类型的水及耐酸性进行对比考察。
在临床给药过程中,样品处于混悬状态,考察自制品与参比制剂的混悬液的粒度是否一致显得尤为重要;检测粒度的方法虽然比较多,但筛分法和显微镜法都存在明显的局限性,而光散射法可以充分对比,说明自制品与参比制剂混悬液状态是否一致。同时,对于试验中的难溶类药物,有必要进行两种溶剂的回收试验:一种模拟临床实际用药,采用50mL 水作为溶剂,经鼻胃管给药;另一种以50mL水作为溶剂,经鼻胃管后加助溶剂使药品主成分完全溶解,这样可以更充分表明鼻胃管对药品有无吸附,以及吸附情况是否一致。
本实验就特殊给药途径的药物作了体外对比研究,包括沉降试验、粒径分析试验及回收试验,为自制品与参比制剂具有相同的给药效果提供了数据支持,也希望对同仁提供借鉴。