过表达野生大豆S-腺苷甲硫氨酸合成酶基因GsSAMS提高水稻耐盐碱性
2022-03-11才晓溪胡冰霜孙明哲贾博为孙晓丽
才晓溪 沈 阳 胡冰霜 王 研 陈 悦 孙明哲 贾博为 孙晓丽
(黑龙江八一农垦大学农学院作物逆境分子生物学实验室,黑龙江 大庆 163319)
土壤盐碱化严重制约了作物的产量和品质,高盐与高pH环境会破坏植物细胞和组织内外的离子稳态与渗透平衡,从而抑制植物生长发育。据不完全统计,我国共有盐碱地9 913万公顷,占我国土地总面积的10%,其中,东北地区盐碱地总面积达766万公顷[1]。开发利用盐碱地等中低产田,是保证我国农业持续高效发展和粮食安全的重要举措。其中,利用分子标记辅助育种、基因编辑等分子育种技术培育耐盐碱作物新品种,是盐碱地资源开发利用的重要途径[2]。
S-腺苷甲硫氨酸合成酶(S-adenosyl-L-methionine synthetase,SAMS)以L-甲硫氨酸为底物,ATP提供能量,催化S-腺苷甲硫氨酸合成[3]。S-腺苷甲硫氨酸是甲硫氨酸的活性形式,在动植物体内广泛存在,是生物体内各种生理生化反应过程中主要的甲基供体[4]。研究表明SAMS在植物响应逆境中具有非常重要的作用[5-7],其中盐胁迫会诱导番茄幼苗[8]和人参[9]SAMS基因的表达;黄瓜CsSAMs[10]和盐地碱蓬SsSAMS2[11]在烟草中过表达,可提高转基因烟草的耐盐性。但目前关于SAMS基因的研究多集中于盐胁迫下的表达检测和模式植物烟草中的耐盐功能验证,对SAMS基因调控作物耐盐碱性的相关研究较少。
野生大豆(GlycinesojaL.)在我国分布广、种类多,具有极强的耐盐碱能力,是应用于耐盐碱基因挖掘的重要资源。本研究前期已从野生大豆中克隆出多个耐盐碱作用显著的功能基因[12],其中包括S-腺苷甲硫氨酸合成酶基因GsSAMS,利用过表达技术确定GsSAMS可通过提高抗氧化物酶活性提高豆科植物的盐碱胁迫耐受性[13-14]。鉴于GsSAMS优异的耐盐碱功能,本研究将其在单子叶植物水稻中过量表达,通过对比野生型和转基因水稻在盐碱处理下的表型、形态、生理指标以及相关基因表达,分析GsSAMS对水稻耐盐碱胁迫耐受性的作用。探究GsSAMS在不同物种中的耐盐碱普适性,同时培育耐盐碱水稻新材料,对盐碱地的开发利用具有重要意义。
1 材料与方法
1.1 试验材料
试验选用的水稻品种为农丰1701,由黑龙江八一农垦大学水稻中心自主培育,转基因水稻使用T2代纯合株系,于2019年进行盐碱胁迫表型分析。大肠杆菌DH5α、农杆菌EHA105菌株和植物载体pCAMBIA130035SU由黑龙江八一农垦大学作物逆境分子生物学实验室保存。
1.2 GsSAMS基因的植物超量表达载体构建
采用USER克隆[15]引物5′-GGC TT AA U GGCAGAGACATTCCT-3′和5′-GGTTT AA U T AGGCCTTC TCC CA-CT-3′扩增GsSAMS基因的蛋白质编码区(coding sequence, CDS)序列。PCR总反应体系15 μL,包括2× Easy Taq PCR Super Mix 7.5 μL,上下游引物(10 μmol·L-1)各0.3 μL,ddH2O 4.9 μL以及野生大豆cDNA 2 μL。反应条件为:95℃预变性5 min;95℃变性30 s,60℃退火30 s,72℃延伸30 s,30个循环;72℃终延伸10 min。扩增产物与PacⅠ及Nt.BbvcⅠ消化的pCAMBIA130035SU片段连接构建栽体,转化大肠杆菌DH5α,PCR鉴定阳性菌落并送交Thermo公司(北京)测序。
1.3 GsSAMS对水稻的遗传转化
将构建的GsSAMS过表达载体转化农杆菌EHA105,并利用农杆菌介导法对水稻愈伤组织进行遗传转化[16]。将饱满的、无菌斑的成熟水稻种子消毒后平铺于水稻愈伤诱导培养基上(营养琼脂,nutrient broth, NB, pH值5.8),28℃条件下暗培养,诱导愈伤组织。挑选黄色颗粒状愈伤组织依次转接入继代培养基(NB,pH值5.8)、共培养培养基(NB+20 mg·L-1乙酰丁香酮,pH值5.2)、筛选培养基(NB+15 mg·L-1固杀草+100 mg·L-1阿莫西林克拉维酸钾,pH值5.8)中,筛选获得的抗性苗转移至生根培养基(Murashige and skoog, MS+100 mg·L-1阿莫西林克拉维酸钾,pH值5.8)中,得到T0代植株。繁种后收获T1代种子,本研究使用的是T3代纯合转基因水稻种子。
1.4 抗性植株分子生物学检测
PCR检测:水稻叶片基因组DNA的试剂盒提取方法参照AxyPrepTMGenomic DNA purification(Axygen,杭州)说明。使用与35S启动子匹配的上游引物F(5′-AT AAGGA-AGTTCATT TCATTTGGA-3′)和GsSAMS基因特异的下游引物R(5′-AGCACC-CCATCCTCCAT AAGT-3′)作为PCR检测引物。以基因组DNA为模板,进行PCR扩增(同时设置水对照、阳性对照和野生型对照),然后进行琼脂糖凝胶电泳观察扩增结果。
半定量PCR(reverse transcription polymerose chain reaction, RT-PCR)检测:PCR阳性植株总RNA采用Trizol (Thermo,北京)试剂法提取,经gDNA wiper (Vazyme,南京)清除基因组DNA。反转录合成cDNA利用唯赞公司(南京)试剂盒HiScript Ⅲ RT SuperMix完成。设计基因特异上游引物5′-CAATGGTGCC-AGGGTTCCT ATTC-3′和下游引物5′-AGCACC CCATCCTCCAT AAGT-3′,其中内参基因Osa-Elf1-α的引物为5′-GCACGCTCTTCTTGCTTTCAC-3′和5′-TC TTGT-CAGGGTTGT AGCCGAC-3′。PCR扩增后进行琼脂糖凝胶电泳观察结果。
1.5 水稻幼苗期耐盐碱性分析
将野生型和纯合转基因株系水稻种子浸泡发芽至破胸露白,将种子移植到营养土中,于人工气候室(25℃、相对湿度70%、光照14 h/黑暗10 h)培养至三叶期。选取长势一致的水稻幼苗,分别用含有0(对照组)和200 mmol·L-1NaHCO3(pH值8.4)(试验组)的溶液浇灌进行盐碱胁迫处理15 d,每个处理设置3个独立的生物学重复,每个生物学重复中每个株系不少于60株水稻苗。持续观察植株生长状态,并在第15天测定存活率和相对含水量,存活率=存活株数/总株数×100%,相对含水量=(鲜重-干重)/鲜重×100%。
1.6 盐碱胁迫下抗氧化酶活性测定
将野生型和纯合转基因株系水稻种子浸泡发芽,待地上部分约2 cm时移至含有Yoshida营养液(pH值5.5~5.8)的96孔水培盒里,于人工气候室培养,其间每2 d换1次营养液。挑选长势一致的三叶期幼苗每组各30株,转移至含有0(对照)和40 mmol·L-1NaHCO3的溶液中进行盐碱胁迫处理。分别在处理前和处理3 h后,取水稻幼苗相同部位的叶片,采用紫外分光光度法测定过氧化氢酶(catalase, CAT)[17]和过氧化物酶(peroxidase, POD)[18]活性。每个指标均测定全部样本。
1.7 盐碱胁迫相关基因表达水平检测
挑选长势一致的三叶期转基因和野生型水稻幼苗,用0(对照)、40 mmol·L-1NaHCO3溶液处理3和12 h,取相同部位相同长度水稻叶片,迅速置于液氮速冻,于-80℃保存备用。提取总RNA并反转录合成cDNA,采用试剂盒TransStart©Top Green qPCR SuperMix (TransGen Biotech,北京)于实时荧光定量PCR仪CFX96 Touch (BioRad,英国)上进行实时荧光定量PCR (quantitative real-time PCR,qRT-PCR)检测。所用基因特异引物序列如下:OsM6PR1-sense:5′-TTGG GATCGTGTGAAC TTGA-3′,anti-sense:5′-CAGAAGCGCAAAT ACACGAA-3′;OsNAC5-sense:5′-ACAACGCCCTCAGGTTGGATGA-3′,anti-sense:5′-TCGT ACCTC TCGATCAC TCCCTTC-3′;OsPOX1-sense:5′-CATCC CAGC TCC-CAACAA-3′,anti-sense:5′-AGACATGCCAATGGTGTGG-3′。
2 结果与分析
2.1 GsSAMS基因植物超量表达载体构建
采用pCAMBIA130035SU作为GsSAMS植物超量表达载体,该载体含有潮霉素(Hygromycin, Hyg)植物选择标记基因,以组成型启动子CaMV35s驱动GsSAMS基因表达(图1-A)。采用基因特异引物PCR扩增获得长度为1 178 bp 的目的条带(图1-B),PCR产物经USER酶切后,与经PacⅠ及Nt.Bbvc Ⅰ线性化处理的pCAMBIA130035SU连接,经菌落PCR鉴定获得阳性克隆pC35SU-GsSAMS(图1-C),用于水稻遗传转化。
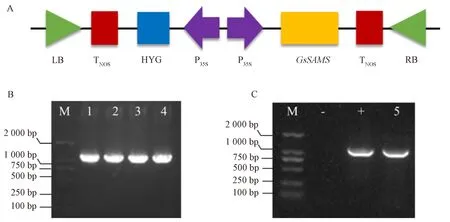
注:A:GsSAMS 植物超量表达载体示意图;B:GsSAMS基因的克隆;M:DNA Marker;1~4:GsSAMS PCR产物;C:pC35SU-GsSAMS植 物表达载体的菌落PCR鉴定;M:DNA Marker;-:阴性 H2O 对照;+:阳性质粒对照;5: pC35SU-GsSAMS。Note: A: Representation of the GsSAMS overexpression vector. B: Gene clone of GsSAMS. M: DNA Marker. 1-4: PCR product of GsSAMS. C: PCR identification of recombinant E.coli clones harborinGThe pC35SU-GsSAMS construct. M: DNA Marker. -: Negative H2O control. +: Positive plasmid control. 1: PCR products of the pC35SU-GsSAMS clone.图1 GsSAMS植物超量表达载体的构建Fig.1 Construction of the GsSAMS overexpression vector
2.2 水稻遗传转化及抗性植株分子生物学检测
采用分农杆菌介导法转化粳稻农丰1701,获得Hyg抗性苗21株,随机选择10株(#1~#10)进行PCR检测。结果显示,抗性植株均能扩增出1 178 bp的特异性条带,而在野生型对照(WT)中未检测到条带(图2)。对PCR阳性植株(#1~#4)进行半定量PCR检测,发现经过23个循环,内参基因均扩增出条带;经过30个循环,野生型未能扩增出条带,而GsSAMS转基因水稻中可检出目的条带(图3),表明GsSAMS基因已整合到水稻基因组中,并可以正常转录。
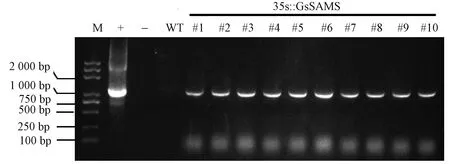
注:M:DNA标记;+:阳性质粒对照; -:阴性 H2O 对照; WT:野 生型对照;#1~#10:独立株系。下同。Note: M: DNA Marker. -: Negative H2O control. +: Positive plasmid control. WT: Wild type control. #1~#10: Hyg resistant seedlings. The same as following.图2 转GsSAMS基因抗性植株PCR检测Fig.2 PCR detection of resistant plants transformed with GsSAMS
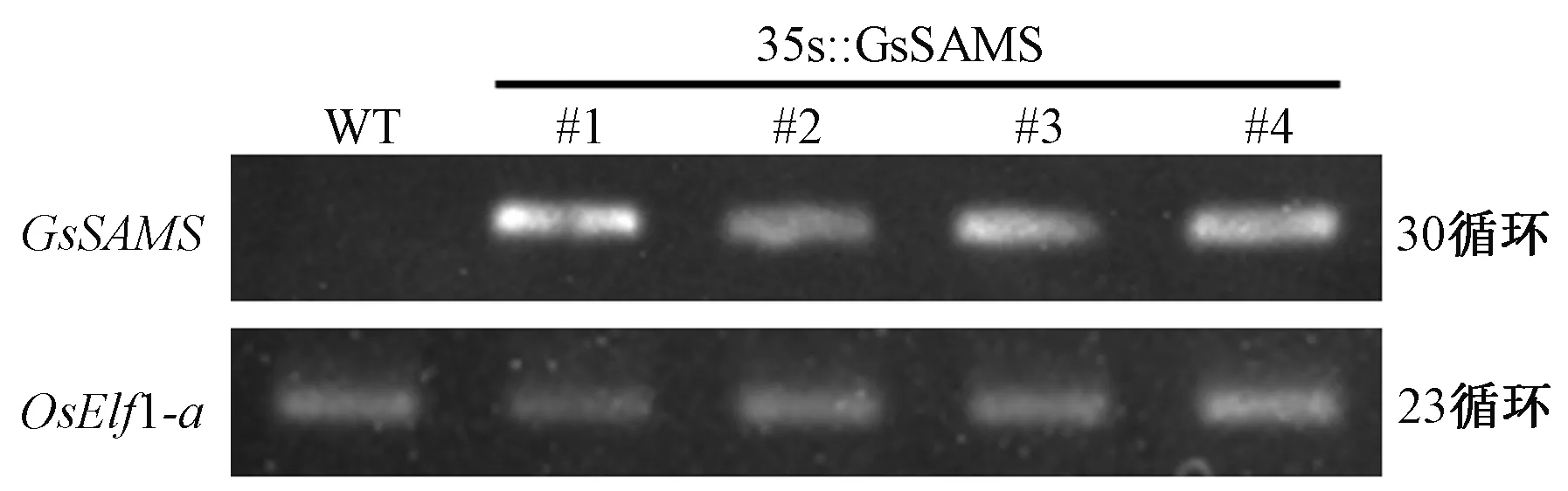
图3 转GsSAMS基因植株RT-PCR检测Fig.3 RT-PCR analysis of GsSAMS transgenic rice
2.3 GsSAMS转基因水稻耐盐碱性分析
为确定GsSAMS基因是否影响水稻耐盐碱性,将三叶期的野生型和GsSAMS表达水平相近的两个株系(#2和#4)进行200 mmol·L-1NaHCO3处理。对照组(0 mmol·L-1)中GsSAMS-OX转基因水稻长势与野生型无明显差异,说明GsSAMS基因的插入并未影响水稻正常生长。而经200 mmol·L-1NaHCO3处理后,GsSAMS-OX株系生长状况明显优于野生型(图4-A),具体表现为野生型植株叶片和茎部严重萎蔫、黄化,而GsSAMS-OX株系叶尖和茎部失水程度较低。存活率统计结果显示,经200 mmol·L-1NaHCO3处理后,两个GsSAMS-OX株系的存活率分别为90%和94%,显著高于野生型(18%)(图4-B),同时转基因水稻地上部分相对含水量(65%、67%)也显著高于野生型(50%)(图4-C)。说明GsSAMS基因过表达提高了转基因水稻的耐盐碱性。
2.4 GsSAMS转基因水稻抗氧化物酶活性分析
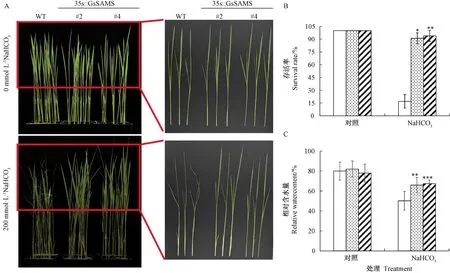
注:A:NaHCO3处理后各株系生长状态;B:NaHCO3处理后存活率;C:NaHCO3处理后相对含水量;*表示同处理条件下不同株系在 P<0.05水平上差异显著; **表示在P<0.01水平上差异显著;***表示在P<0.001水平上差异显著(n=20)。下同。Note: A: Phenotype of WT and transgenic rice seedlings treated with NaHCO3. B: Survival rates of WT and transgenic rice seedlings treated with NaHCO3. C: Relative water contents of WT and transgenic rice seedlings treated with NaHCO3. * significantly different among different lines under same treatment at 0.05 level. ** significantly different at 0.01 level. *** significantly different at 0.001 level (n=20). The same as following.图4 GsSAMS转基因水稻幼苗期耐盐碱性分析Fig.4 Analysis of salt-alkaline tolerance in the seedling stage of GsSAMS transgenic rice
对野生型和GsSAMS-OX转基因水稻进行NaHCO3处理,测定处理前后POD和CAT的活性。图5结果显示,对照组中GsSAMS-OX与野生型植株的POD、CAT活性无显著差异,胁迫处理后POD、CAT活性均有不同程度的提高,但转基因株系酶活性显著高于野生型。
2.5 GsSAMS转基因水稻盐碱胁迫相关基因表达分析
为进一步探究GsSAMS基因调控水稻耐盐碱性的作用方式,利用qRT-PCR分析了野生型和GsSAMS-OX转基因水稻处理前后相关基因的表达水平,如图6所示。对照组中,OsPOX1和OsNAC5在野生型和转基因株系中的表达量无明显差异。经40 mmol·L-1NaHCO3处理后,OsPOX1、和OsM6PR1在野生型和GsSAMS-OX转基因株系中表达均上调,但GsSAMS-OX株系中的表达量显著高于野生型;而OsNAC5的表达量虽然也发生上调,但只在#4转基因株系中显著高于野生型,#2较野生型不显著,可能由于#4株系的GsSAMS表达量高于#2株系。
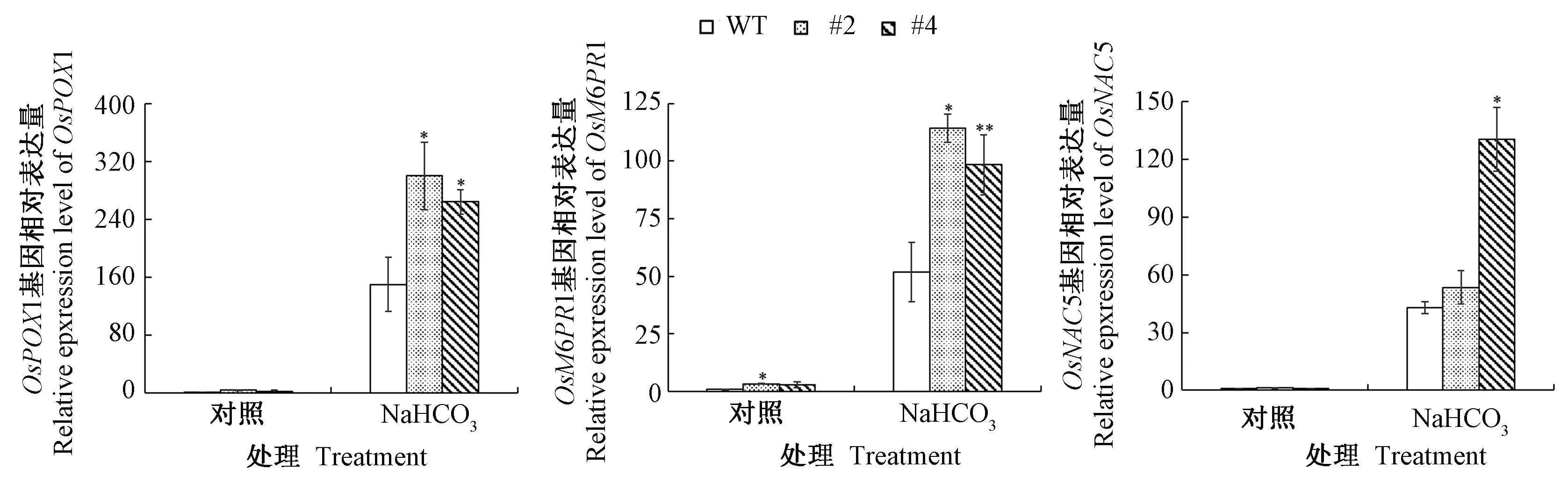
图6 盐碱处理相关基因在WT和GsSAMS-OX转基因株系中的相对表达量Fig.6 The relative expression of salt-alkaline responsive genes in WT and GsSAMS-OX transgenic lines
3 讨论
盐碱逆境严重影响了我国的农业生产,因此发掘耐盐碱作物对盐碱地资源开发有重要意义。目前有研究表明,植物可通过提高抗氧化酶活性、选择性吸收离子以及诱导抗盐碱相关基因的表达来应对胁迫伤害[19-21]。S-腺苷甲硫氨酸合成酶SAMS是合成生化反应中甲基供体的关键酶,在植物逆境响应过程中发挥重要作用。前期研究中发现,野生大豆GsSAMS基因表达受盐碱胁迫诱导,从中克隆出GsSAMS基因,并对苜蓿和大豆进行了遗传转化,发现该基因过表达提高了双子叶豆科植物的盐碱胁迫耐受性[14,22]。但对GsSAMS基因能否调控单子叶植物的盐碱胁迫耐受性却鲜见报道。Ma等[23]发现,甜菜BvM14-SAMS2超量表达的转基因拟南芥可通过提高抗氧化物酶的活性,帮助清除植物体内积累的活性氧(reactive oxygen species,ROS),从而应对盐胁迫。本研究结果表明,GsSAMS转基因水稻经NaHCO3处理后存活率明显优于野生型,POD和SOD酶活性也显著提高。研究发现,水稻抗氧化酶基因OsPOX1在干旱和盐胁迫下表达显著上调,可增强ROS清除能力[24]。本研究分析发现,GsSAMS超量表达同样可以提高盐碱胁迫下OsPOX1基因的表达,表明GsSAMS基因可能通过提高过氧化物酶(peroxidase stain,POX)活性,参与水稻ROS清除途径。OsM6PR1是参与甘露醇代谢的关键基因,其表达受干旱和盐胁迫的诱导[25]。本研究结果表明盐碱胁迫处理后GsSAMS-OX转基因水稻株系中OsM6PR1基因的表达显著高于野生型,说明GsSAMS基因还可能参与盐碱胁迫下植物体内渗透调节过程。SAMS基因被证明是脱落酸(abscisiCAcid, ABA)胁迫的正调控因子,其在拟南芥中的超量表达可增强ABA耐性,并提高ABA诱导的逆境相关基因的表达[26]。大量研究表明,OsNAC5转录因子是ABA依赖的逆境信号应答途径的关键调节因子[27-28],本研究发现盐碱胁迫处理后GsSAMS-OX转基因水稻株系中OsNAC5基因的表达显著上调(图6-C)。这些结果暗示GsSAMS可能影响水稻碱胁迫下ABA信号通路关键基因的表达。本研究通过分析GsSAMS基因提高水稻的耐盐碱性,为揭示该基因调控盐碱胁迫应答机制奠定了重要基础,同时也为通过种植耐盐碱水稻以及开发利用盐碱地提供了新材料。
4 结论
本研究获得的GsSAMS转基因水稻经盐碱胁迫处理后,存活率、相对含水量显著高于野生型,表明GsSAMS基因过表达提高了转基因水稻的耐盐碱性;转基因水稻POD和CAT酶活性显著高于野生型,表明可能通过抗氧化系统提高水稻耐盐碱性;OsPOX1、OsNAC5和OsM6PR1的表达量在转基因水稻中上调,表明GsSAMS可能影响碱胁迫下水稻ABA信号转导、氧化还原、离子渗透等通路中相关基因的表达。本研究后续将展开农艺性状和产量性状调查,以全面评估GsSAMS在提高水稻耐盐碱性中的应用潜力。
