基于蛋白质组解析大球盖菇多糖促进猕猴桃生长及抗高温的分子机制
2022-03-11肖文斐柴伟国裘劼人阮松林
肖文斐 柴伟国 裘劼人 忻 雅 阮松林
(杭州市农业科学研究院, 浙江 杭州 310024)
植物免疫诱导剂是一类能诱导植物产生系统获得性抗性的免疫活性化合物,活性糖类物质是其中重要的类型之一[1]。壳寡糖和海藻寡糖等低聚糖能增强多种作物的抗病能力,前人对其用途和功能也进行了大量研究[2-4]。研究表明,一些多糖类物质也具有调节植物免疫及生长的作用,如壳聚糖可促进植物生长、诱导病原菌抗性及非生物抗逆性[5-6];黄芪多糖能够提高小叶杨的叶绿素含量及氧化酶活性[7];灵芝[8]、云芝[9]、香菇[10-11]多糖等多种真菌多糖被证实具有诱导植物对病毒及真菌病害的抗性、促进植物生长的作用。杭州市农科院植物免疫诱抗课题组前期研究发现,大球盖菇等食用菌多糖能促进水稻幼苗发育,提高其叶绿素含量及抗氧化酶活性[12]。
红阳猕猴桃(ActinidiachinensisHongyang)属猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia),是我国选育的首个红肉型猕猴桃品种。鲜果营养丰富、食用品质优异,但由于其在抗病性、生长势、抗热性、耐贮性等方面存在缺陷,致使该品种的种植难度较大[13]。中国科学院大连化学物理研究所在陕西地区猕猴桃上应用的寡糖类植物疫苗与噻霉酮集成防治方案,对猕猴桃溃疡病的防效达90%左右,同时使猕猴桃产量增加19%,抗逆性显著增强[14]。但多糖类物质在猕猴桃上的应用效果及作用机制还鲜见报道。
蛋白质组学能从整体水平研究生物体内蛋白质组成成分及其变化规律。作为一种重要的功能基因筛选方法,蛋白质组学也被应用到植物诱导抗性的机制研究之中。Lematre-Guillier等[15]通过双向电泳法揭示硫酸化修饰的β-1,3葡聚糖(sulfated β-1,3 glucan, PS3)对葡萄抗霜霉病的诱导抗性与初级代谢激活有关。Possa等[16]利用蛋白质组学方法发现,绿色力量-铜钙盐(Greenforce CuCa)和苯并噻二唑两种激发子对咖啡叶锈病的诱导抗性均能引起代谢调节,诱导的蛋白质与光合作用、蛋白质代谢和胁迫反应有关,但两种激发子诱导的蛋白质不完全相同。张青等[17]通过定量蛋白质组学研究了免疫诱导剂保康灵1号诱导黑李叶片促生长作用的分子机制。
本研究以红阳猕猴桃为试验材料,通过检测大球盖菇喷施处理后猕猴桃叶片的大小、厚度、叶绿素、多酚氧化酶指标及蛋白质组的变化,从形态结构、生理生化和蛋白质组学技术等层次探讨多糖对猕猴桃生长及抗逆性的影响,挖掘相关的功能基因及关键途径,探索其促进猕猴桃生长及抗高温的分子机制,旨在为多糖类免疫诱导剂的开发利用奠定研究基础。
1 材料与方法
1.1 试验材料与试剂
本试验于2018年在临安市清凉峰镇颊口村猕猴桃基地进行。试验所用猕猴桃品种为红阳,从四川省苍溪县引进,采用山地露天栽培,株龄3年。各试验果树生长势相对一致,树势中庸,栽培管理水平较好。大球盖菇子实体干制品购于福建缙云食用菌家庭农场。
儿茶酚、愈创木酚、巯基乙醇、苯甲基磺酰氟、碘乙酰胺、二硫苏糖醇、尿素、碳酸氢铵、乙二胺四乙酸,美国Sigma公司;胰蛋白酶,美国Promega公司;Amicon Ultra-0.5(10kD)超滤管,德国默克密理博公司;C18固相萃取柱,德国Qiagen公司;乙腈、甲酸、甲醇,美国Thermo Fisher公司;Tris饱和酚,上海生工公司;Bradford法蛋白定量试剂盒,上海碧云天公司;蔗糖、乙醇、苯酚、浓硫酸、葡萄糖等试剂均为国产分析纯。
1.2 主要仪器与设备
UV-2550分光光度计,日本岛津公司;调制叶绿素荧光成像系统IMAGING-PAM,德国WALZ公司;YMJ-B叶面积仪、YH-1厚度仪,浙江托普云公司;BX53荧光正置显微镜,日本奥林巴斯公司;真空干燥仪5305,德国Eppendorf公司;EASY-nLC1000液相和Q-Exactive高分辨率质谱联用系统,美国Thermo Fisher公司。
1.3 试验方法
1.3.1 大球盖菇多糖提取及田间喷施处理 参照文献[12]方法,采用热水浸提法提取大球盖菇多糖并进行去蛋白处理,乙醇沉淀后真空冷冻干燥得到粗多糖。利用苯酚-硫酸法[18]测定多糖含量。
试验设大球盖菇多糖水剂和常规对照处理。每一处理选取两行进行喷施。常规处理中对猕猴桃病害防治的方案如下:2月在植株萌芽前15~20 d,对猕猴桃整个园区喷施3~5波美度的石硫合剂1次;3月展叶期喷施20%噻菌铜500倍液1次;4月开花前喷施50%氯溴异氰尿酸1 500倍液1次,开花后喷施3%中生菌素800倍液、20%氰戊菊酯3 000倍液2次,间隔期10 d左右;5月喷施70%吡虫啉15 000倍液1次,80%代森锰锌500倍液1次;6月喷施70%甲基硫菌灵1 500倍、20%噻唑锌600倍液、1.8%阿维菌素600倍液各1次;7月施用80%代森锰锌500倍液、32.5%苯甲嘧菌酯1 500倍液1次、20%氰戊菊酯3 000倍液各1次;8月施用50%氯溴异氰尿酸1 500倍液1次,70%吡虫啉15 000倍液1次。用药间隔期一般在10~15 d。大球盖菇多糖处理是在常规用药的基础上增设多糖水剂喷施。自2018年4月12日开始,每半个月左右,进行大球盖菇多糖水剂与农药混配喷施(多糖终浓度为0.15 mg·L-1),共喷施5次。
1.3.2 叶片参数测定及观察 随机选取10株猕猴桃果枝上完全成熟的叶片,每株3片,共分为3组,每组为1重复,测定面积和厚度。后续测定取样方式与此一致。
各处理选取相同部位叶片,石蜡包埋后制作切片,番红-固绿染色后封片,具体方法参照文献[17]。显微镜下观察拍照。用Image-Pro Plus软件测量叶片组织厚度。
1.3.3 叶绿素含量测定 称取猕猴桃相同部位叶片0.25 g并重复3次,置于研钵中,加入5 mL 95%乙醇与少许石英砂,充分研磨至组织变白,再加入5 mL 95%乙醇,将研钵壁上的组织及液体充分洗涤后一并转至离心管内,静置3~5 min,用95%乙醇定容至15 mL,3 000×g离心15 min,取离心后的上清液1 mL,加95%乙醇4 mL,用分光光度计测定665、649 nm波长下的吸光度值,以95%乙醇为空白对照,叶绿素浓度(mg·L-1)=18.16×A649+6.63×A665。
1.3.4 酶活性测定 参照邱德文[19]的方法测定多酚氧化酶(polyphenol oxidase, PPO)和过氧化物酶(peroxidase, POD)活性。称取0.1 g叶片,加1.5 mL磷酸缓冲液(50 mmol·L-1,pH值7.2)磨成匀浆,离心后取0.5 mL上清,加50 mmol·L-1儿茶酚溶液1.5 mL,2 mL磷酸缓冲液,40℃水浴1 h,于525 nm波长下测定吸光度值。以每克鲜重每小时的光密度(optical density, OD)大小表示PPO活性。
称取0.1 g叶片,加1.5 mL磷酸缓冲液(50 mmol·L-1, pH值6.0)磨成匀浆,离心后取0.1 mL上清,加4 mL反应液(含0.038%愈创木酚和0.017% H2O2的50 mmol·L-1磷酸缓冲液,pH值6.0),用动力学光度法测定470 nm波长下吸光度值变化。以每克鲜重每分钟的OD值变化量表示POD活性。
1.3.5 猕猴桃叶片叶绿素荧光测定 为了明确大球盖菇多糖处理对高温胁迫下猕猴桃叶片的影响,在连续高温(最高气温38℃~39℃)的第3日午后采集叶片,测定其Fv/Fm。参照王淑珍等[20]的方法。测定前叶片先暗适应30 min,然后置于叶绿素荧光成像系统照射区,在超强的饱和脉冲光作用下测定叶片最小荧光产量(minimal fluorescence, Fo)和最大荧光产量(maximal fluorescence, Fm)以及暗适应PSⅡ最大光合效率(Fv/Fm)。
1.3.6 猕猴桃叶片总蛋白的提取及定量 参照文献[21]并加以改进。称取新鲜猕猴桃叶片0.2 g,用液氮研磨成粉末,转入2 mL 离心管,迅速加入0.8 mL经4℃预冷的蛋白提取液(0.7 mol·L-1蔗糖,0.1 mol·L-1KCl,0.5 mol·L-1Tris-HCl,50 mmol·L-1乙二胺四乙酸,1 mmol·L-1苯甲基磺酰氟和2%巯基乙醇,pH值7.5)混匀,再加入0.8 mL预冷的Tris饱和酚(pH值7.5),置冰上放置30 min,期间取出振荡3~5次,于4℃条件下5 000×g离心30 min。取上层酚液加入等量蛋白提取液,重复提取1次。取上述提取酚液,加入至少5倍体积的0.1 mol·L-1醋酸铵甲醇溶液,-20℃静置过夜。再于4℃条件下5 000×g离心30 min,弃上清。用-20℃预冷的甲醇重复清洗2次,4℃条件下5 000×g离心30 min后取沉淀,经真空干燥后得粗蛋白粉。用裂解液(8 mol·L-1尿素、100 mmol·L-1Tris-HCl和1 mmol·L-1苯甲基磺酰氟,pH值8.5)复溶粗蛋白干粉,室温放置1 h,期间取出振荡3~5次,然后在20℃条件下5 000×g离心15 min,取上清液用Bradford法测定蛋白质浓度。
1.3.7 蛋白还原烷基化和酶解 参照方献平等[22]的方法并加以改进。取150 μg蛋白样品,用100 mmol·L-1NH4HCO3溶液定容至100 μL,按1∶10体积比加入100 mmol·L-1二硫代苏糖醇至终浓度为10 mmol·L-1,在37℃条件下还原反应1 h。冷却至室温后,按1∶10体积比加入500 mmol·L-1碘乙酰胺,室温避光反应30 min。将上述反应液转移至Amicon Ultra-0.5(10 kD)超滤管中纯化。先4℃条件下12 000×g离心15 min弃废液,再用100 mmol·L-1NH4HCO3清洗2次,离心弃废液。更换新的收集管,加入100 mmol·L-1NH4HCO3至总体积100 μL,按酶与蛋白质量比1:50加入胰蛋白酶,37℃反应12~16 h。4℃条件下12 000×g离心15 min,再向超滤管中加入100 μL的100 mmol·L-1NH4HCO3溶液,重复离心1次,合并2次离心得到的溶液即为酶解的肽段溶液。肽段经C18固相萃取柱脱盐处理并真空干燥。
1.3.8 质谱数据采集及分析 参照文献[17]。真空干燥后的肽段用含0.1%甲酸的去离子水溶液复溶至1 μg·μL-1,每组分上样2 μL。采用EASY-nLC1000液相系统对肽段进行分离。流动相A液为含0.1%甲酸的水溶液;B液为含0.1%甲酸的乙腈溶液。线性洗脱梯度(B液) 4%~7%,4 min;7%~14%,62 min;14%~19%,22 min;19%~34%,15 min;34%~84%,17 min;流速为200 nL·min-1。肽段经超高效液相色谱系统分离、NSI离子源电离后进入Q-Exactive质谱系统分析。
二级质谱数据使用 Maxquant搜索引擎(v1.6.0.1)进行分析,检索参数设置参照文献[17]。检索数据库为猕猴桃基因组推测蛋白质数据库,包含39 040条蛋白序列(Hongyang_pep_v1.0.fa.gz,ftp://cucurbitgenomics.org/pub/kiwifruit/)。
1.3.9 差异蛋白筛选、功能注释及分析 使用Perseus软件(版本1.6.0.2)对蛋白谱峰强度进行非标记相对定量,以蛋白表达差异倍数(fold change)≥1.5倍或≤0.67倍且P<0.05为差异蛋白标准,对鉴定的蛋白进行筛选。
利用百迈客云平台(http://www.biocloud.net)工具软件对差异蛋白进行功能注释及基因本体(gene ontology, GO)匹配及富集分析(P<0.05);利用京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes, KEGG)网络信号数据库(http://www.genome.jp/kegg/pathway.html)进行KEGG代谢信号通路匹配及富集分析(P<0.05)。
1.3.10 数据统计分析 采用DPSv7.0软件对数据进行方差分析,同时采用Duncan氏法进行显著性分析,采用WPS Office 2013制图。
2 结果与分析
2.1 大球盖菇多糖与对照处理的猕猴桃叶片表型比较分析及叶绿素含量测定
叶片面积和厚度等性状比较结果表明,施用大球盖菇多糖后,猕猴桃叶片面积变大(图1-A),叶片厚度相比对照增加了28.9%,达极显著差异(图1-B)。进一步对叶片横切面进行观测,结果显示处理后的叶片栅栏组织和海绵组织排列紧密,厚度增加(图1-C),表皮组织无明显变化。叶绿素含量测定结果表明,处理后叶片的叶绿素含量比对照增加了57.4%,达极显著差异(图1-D)。
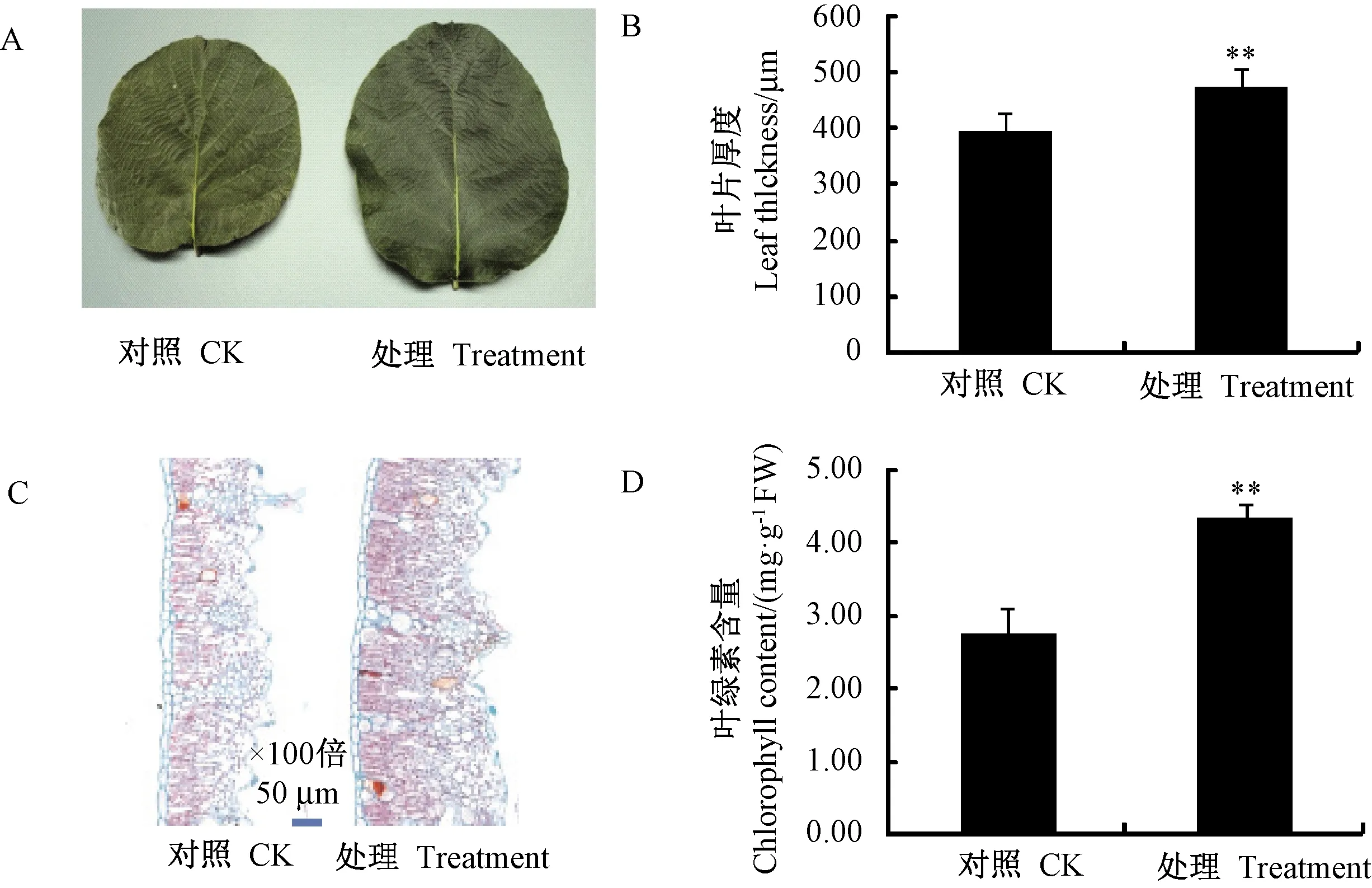
注:A:叶片表型;B:叶片厚度;C:叶片横切面;D:叶绿素含量;直方柱上**表示差异达到 极显著水平(P<0.01),*表示差异为显著水平(P<0.05)。下同。Note: A: Phenotype of leaf. B: Leaf thickness.C: Blade transverse section. D: Chlorophyll content. On the square column, ** indicates significant difference at P<0.01, while * indicates significant difference at P<0.05. The same as following.图1 大球盖菇多糖处理与对照的猕猴桃叶片表型及叶绿素含量比较Fig.1 Phenotype and chlorophyll content of kiwifruit leaves treated with SPS and control
2.2 大球盖菇多糖处理对高温胁迫下猕猴桃叶片光合特性的影响
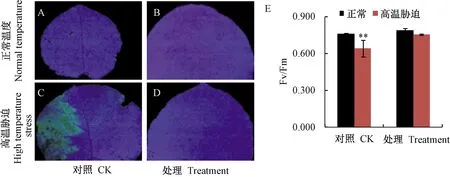
注:A:正常温度对照叶片;B:正常温度处理叶片; C:高温胁迫对照叶片; D:高温胁迫处理叶片; E:最大光化学效率Fv/Fm。Note: A: Control leaf at normal temperature. B: Treated leaf at normal temperature. C: Control leaf at high temperature stress. D: Treated leaf at high temperature stress. E: Maximal photochemical efficiency Fv/Fm.图2 大球盖菇多糖处理与对照的猕猴桃叶片叶绿素荧光成像图及最大光化学效率比较Fig.2 Comparison of chlorophyll fluorescence images and maximal photochemical efficiency of kiwifruit leaves treated with S. rugosoannulata polysaccharides and control
叶绿素荧光参数Fv/Fm反映了光系统Ⅱ(photosystem Ⅱ, PSII)反映了PSⅡ的最大光能转化效率以及环境因素对PSⅡ电子传递系统的影响效应,已被广泛用于植物的早期胁迫检测[23]。结果如图2所示,正常生长条件下对照和处理组叶片Fv/Fm平均值分别为0.76和0.79;高温胁迫后,对照叶片Fv/Fm平均值显著下降至0.64,而处理叶片Fv/Fm与正常生长条件下的比值差异不显著。说明处理组的光抑制程度较小,抗高温性强于对照。通过后期的植株表型观察发现(图3),对照植株在持续高温胁迫下,叶片日灼伤害及脱落严重,果实数量减少;而处理植株的叶片伤害及脱落程度轻,果实数量多。

注:A:叶片表型;B:对照植株;C:处理植株。Note: A: Phenotype of leaves. B: Control plants. C: Treated plants.图3 高温胁迫下的大球盖菇多糖处理与对照猕猴桃植株表型Fig.3 Phenotype of kiwifruit plants treated with S. rugosoannulata polysaccharides and control under high temperature stress
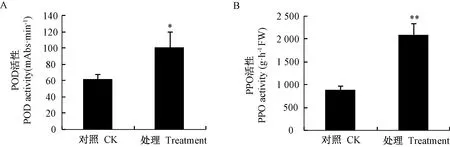
图4 大球盖菇多糖处理与对照的猕猴桃叶片POD和PPO活性比较Fig.4 Comparison of POD and PPO activities of leaves treated with S. rugosoannulata polysaccharide and control
2.3 大球盖菇多糖处理对高温胁迫下猕猴桃叶片抗氧化酶活性的影响
POD及PPO活性的高低是植物抗性的重要指标[24-26]。通过对高温胁迫猕猴桃叶片POD和PPO活性的测定发现,与对照相比,大球盖菇多糖处理后叶片POD(图4-A)和PPO活性(图4-B)均显著增加,推测大球盖菇多糖处理具有诱导抗逆性的潜在作用。
2.4 差异表达蛋白质数量分析
通过采集高温胁迫下的处理组及对照组猕猴桃叶片蛋白的质谱数据,并进行多库搜索分析,共鉴定到猕猴桃蛋白3 507个。利用Perseus软件,并结合Welch’s t-test筛选出326个差异蛋白,其中大球盖菇多糖处理相比对照上调表达蛋白166个(显著上调1.5倍),下调表达蛋白160个(显著下调1.5倍)。
2.5 差异蛋白质GO功能分类
对以上326个差异蛋白进行了GO功能注释,按照生物学过程(biological process)、细胞组分(cellular component)、分子功能(molecular function)进行了分类,结果如图5所示。在生物学进程中,差异蛋白主要参与代谢过程、细胞过程、单组织过程和刺激应答;在分子功能分类中,差异蛋白主要为催化和连接活性类功能,还有部分转运、抗氧化及电子载体活性类功能蛋白;而在细胞组分分类中,差异蛋白质较多位于各种形式细胞器和细胞膜中,且往往参与了大分子复合体的组成。
2.6 差异表达蛋白的功能与代谢通路富集分析
为了进一步揭示蛋白质组的变化规律,本研究对差异蛋白分别进行了GO富集和KEGG通路富集分析。GO富集分析结果表明,差异蛋白在叶绿体、叶绿体基质、细胞质、类囊体部分及光合膜等细胞组分子集的富集程度最高;在生物过程中,富集程度最高的5个子集的依次是光合作用、热应答、无机质应答、氧化还原过程及胁迫应答;而催化活性、氧化还原酶活性、四吡咯结合、异构酶活性及水解酶活性等子集的富集程度则位于分子功能的前列(图6-A)。利用KEGG数据库对差异蛋白进行代谢通路富集分析发现(P<0.05,图6-B),大球盖菇多糖参与了糖代谢、氨基酸代谢等初级代谢途径的调节,显著影响了α-亚麻酸代谢、维生素B6代谢、类胡萝卜素生物合成及类黄酮生物合成途径等次生代谢途径。表1中列出了部分富集途径重要差异表达蛋白的定量信息。
3 讨论
栅栏组织和海绵组织是叶绿体的主要分布部位,这些组织的增厚可能是大球盖菇多糖提高猕猴桃叶绿素含量及Fv/Fm比值的基础。与此对应的是,在本试验的差异蛋白质组学研究中,GO二级注释结果显示大球盖菇多糖诱导的差异应答蛋白质在叶绿体尤其在PSⅡ中显著富集,且11个差异蛋白均为上调表达。这些蛋白主要包括PSⅡ反应中心核心蛋白D2,核心天线蛋白CP26、CP43和CP47,叶绿素结合蛋白及产氧增强蛋白等。其中产氧增强蛋白1(Achn091501)是所有差异蛋白中表达量上调最多的,高达222.56倍,其他蛋白的表达量分别为对照的1.51~3.76倍。光系统Ⅰ(photosystem Ⅰ, PSⅠ)的膜内周蛋白PsaK也上调了1.85倍(表1)。PSⅠ和PSⅡ是生物光能转换的重要场所,涉及水裂解放氧反应和原初电荷分离等关键步骤,是决定光合作用效率的重要部位[27]。这些重要的光合作用相关蛋白的表达上调,为促进猕猴桃的生长发育及光合作用提供了分子基础。
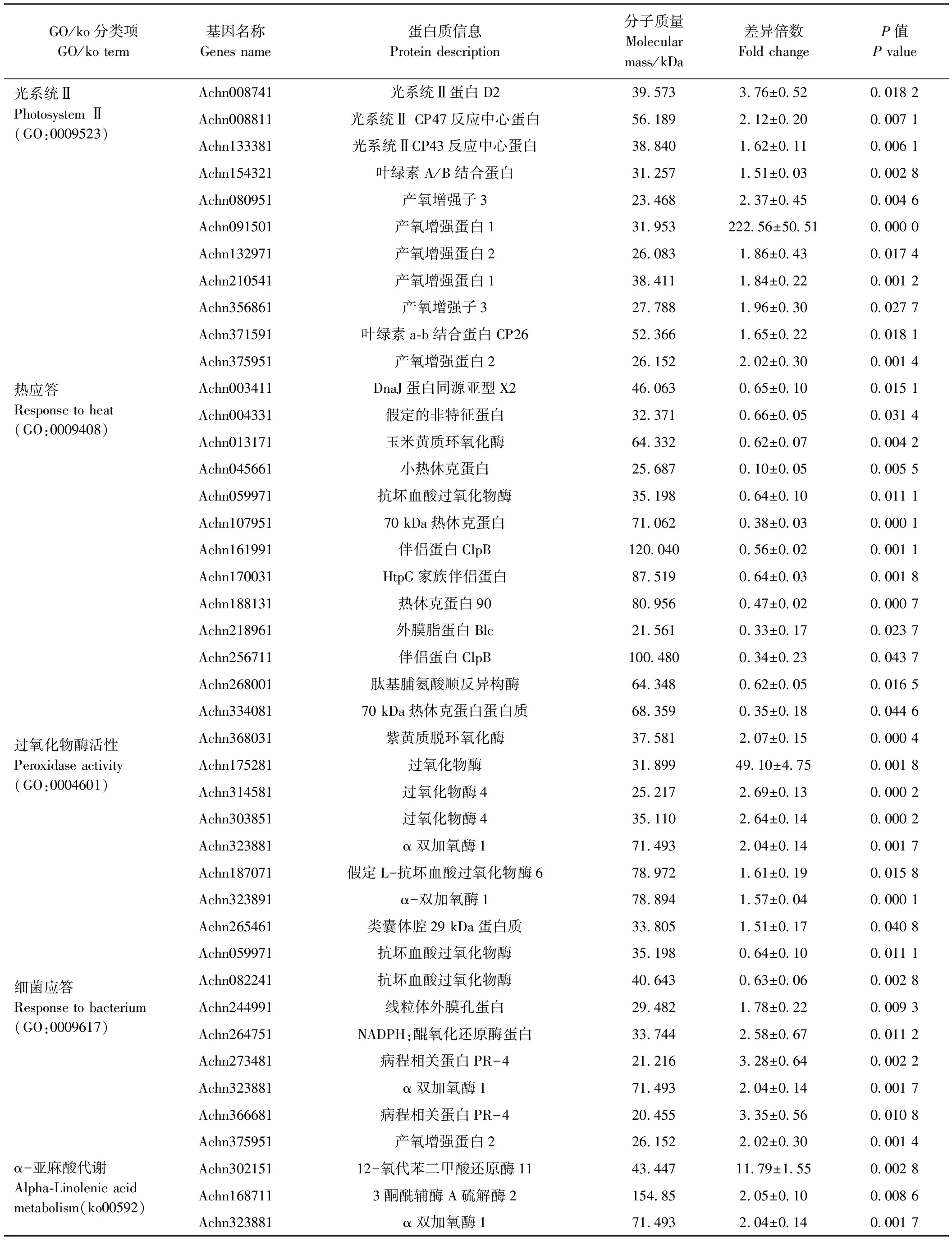
表1 部分富集途径差异表达蛋白定量信息Table 1 Quantitation information of differentially expressed proteins in partial enrichment pathways
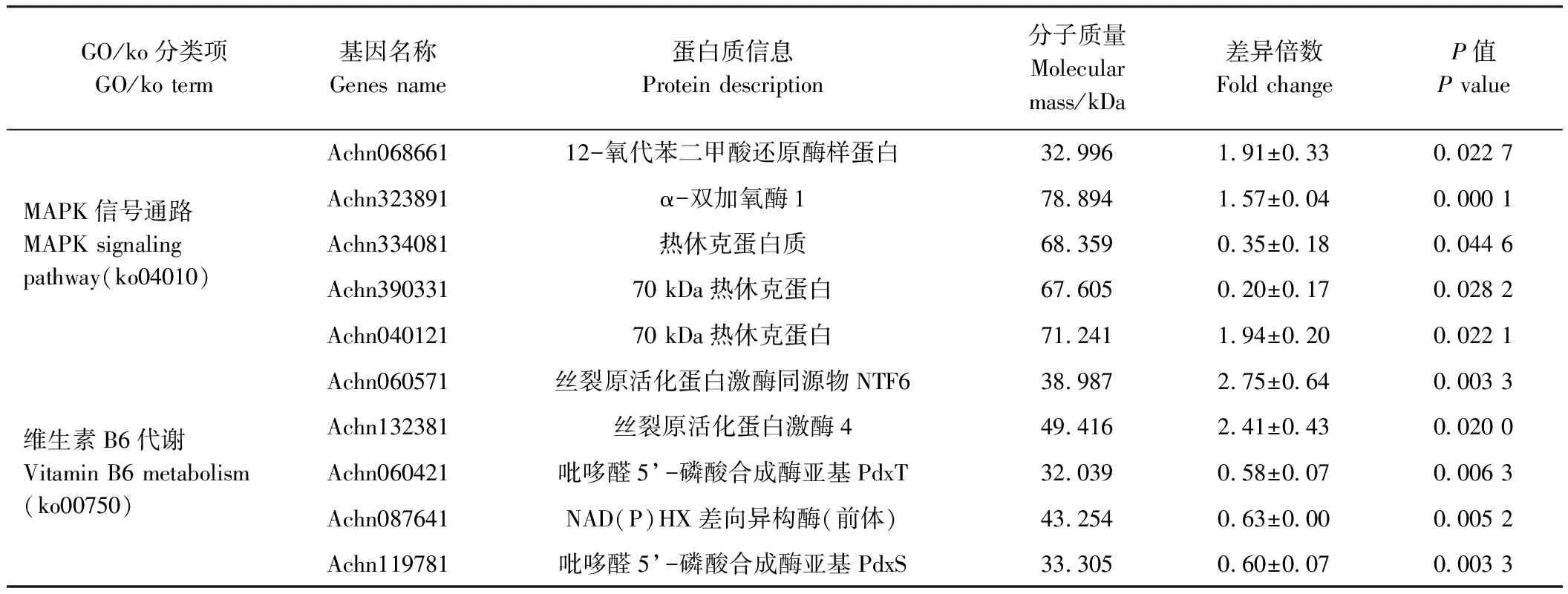
表1(续)
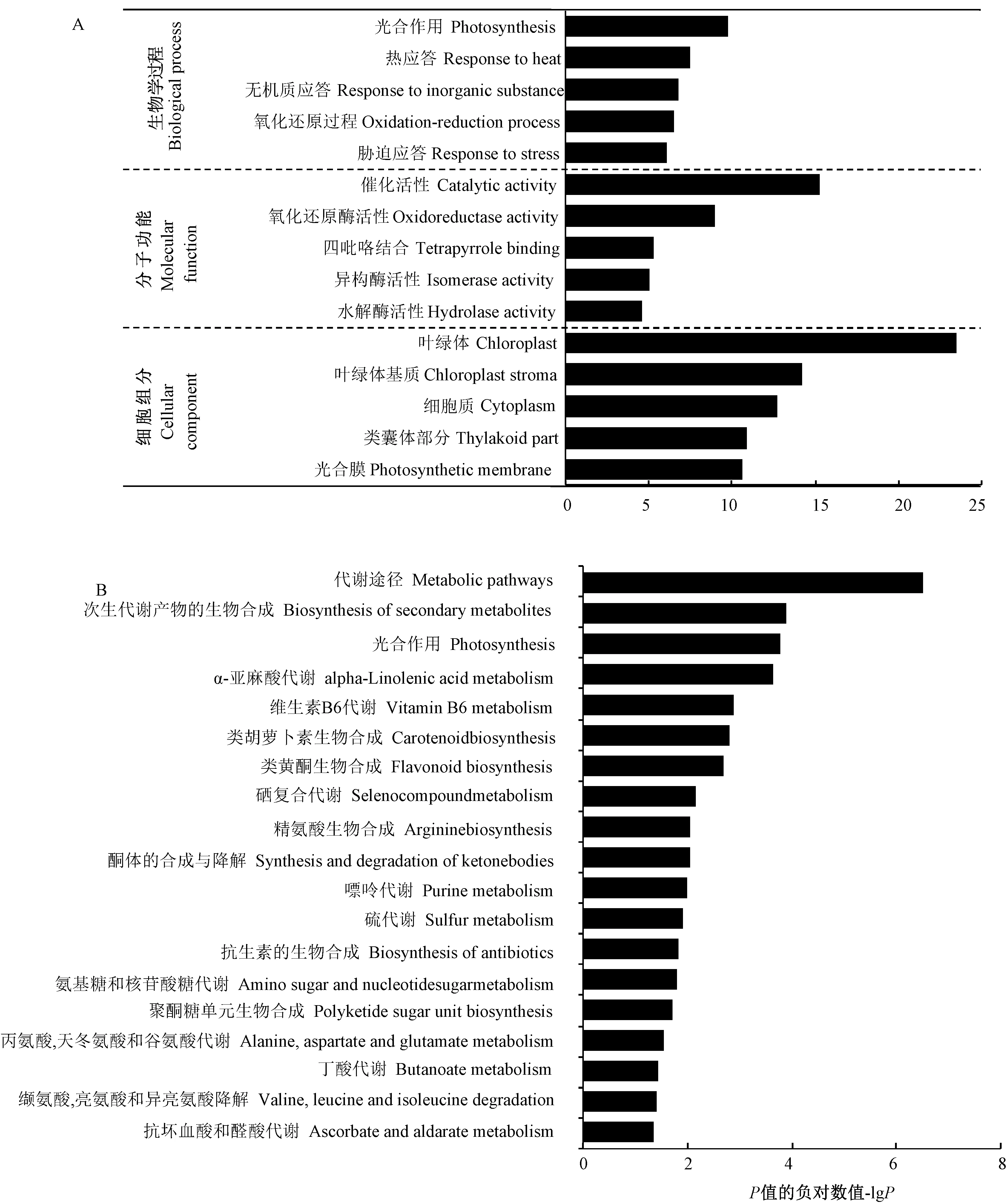
图6 差异表达蛋白质的GO功能(A)和KEGG代谢通路富集(B)分析Fig.6 GO function (A) and KEGG pathway enrichment (B) analysis of differentially expressed proteins
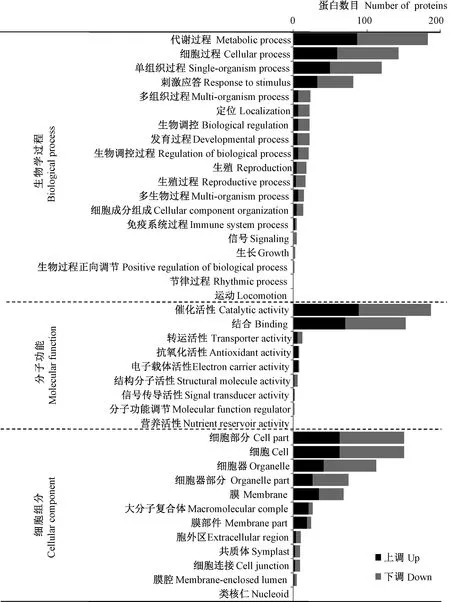
图5 差异表达蛋白质的GO功能归类分析Fig.5 GO functional category analysis of differentially expressed proteins
富集并指定参与热应答相关途径的14个差异蛋白中,有13个蛋白的表达相对下调,其中大部分是热休克蛋白类分子伴侣蛋白(表1)。热休克蛋白(heat shock proteins, HSPs)是植物在高温等逆境环境下或发育特殊时期产生的应激蛋白,并通过分子伴侣机制保护逆境中的细胞[28-29]。叶绿素荧光成像图显示,对照组叶片在高温胁迫下受到了光抑制,而大球盖菇处理叶片中Fv/Fm比值较为稳定。由此可以推测对照组细胞在高温胁迫下细胞受到伤害,启动了热胁迫应答机制;而处理组细胞中蛋白相对稳定,热胁迫应答还未被完全激活。此外,还有大量的差异蛋白富集在胁迫应答相关途径,只是基因及其表达程度不同,既有上升也有下降,说明大球盖菇多糖对这些途径的蛋白表达调节保持平衡。
POD可以催化许多重要酚类物质的氧化反应,参与木质素的聚合过程,亦能催化产生对病原菌有毒性的酚类物质,抑制病原菌的增殖和扩展,与植物抗病性有密切关系[24],同时也是植物耐热性鉴定的重要指标[26]。经大球盖菇多糖处理后,猕猴桃叶片中POD活性和PPO活性明显增加。蛋白组学分析结果也表明,有9个过氧化物酶类蛋白呈现出差异表达,其中7个表达上调,2个下调,而过氧化物酶Achn175281的表达量上调最多,达到对照的49.10倍。差异蛋白中,还有6个与细菌应答相关的蛋白被诱导上升表达(表1)。推测大球盖菇多糖具有诱导抗病的潜在作用,但对病害的具体防治效果还需后续试验进一步验证。
促分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)级联反应是一种重要的高度保守的细胞信号转导途径,参与植物生长发育、激素调节、生物胁迫以及非生物胁迫的应答响应。植物在受到外界刺激后,可通过激发MAPK级联反应将信号传导到细胞内,进而启动下游系列的防御反应[30]。Harpin、鞭毛蛋白质FLG22、壳寡糖等激发子都需通过MAPK应答进行信号传递[31]。大球盖菇多糖处理后诱导NTF6 和MAPK4 2个MAPK类蛋白上调表达,初步推测MAPK级联反应参与了其中的信号传递。
次生代谢产物是植物抵御病害和环境胁迫防御系统的重要组成部分,但较高的积累可能产生毒性并损害植物产品的质量。次生代谢产物在植物生长与防御之间取得平衡的最佳积累量更有利于植物在逆境中健康生长[32]。与对照相比,经大球盖菇多糖处理后猕猴桃的α-亚麻酸代谢、维生素B6代谢、类胡萝卜素生物合成及类黄酮生物合成途径都受到了不同程度的调节,其中富集在α-亚麻酸代谢途径中的差异蛋白均呈上调趋势,而富集在其他3条代谢途径的蛋白大多为下调表达(表1)。大球盖菇多糖可能通过对次生产物代谢途径的调节,来维持植物生长和抵抗逆境的平衡。
α-亚麻酸代谢是茉莉酸类化合物(jasmonates, JAs)生物合成的主要途径,而JAs作为一种重要植物内源激素广泛参与植物生长发育和防御反应等多种生物学过程[33]。JAs也被证实是调节植物诱导抗性的重要小分子信号物质。如前人研究发现,壳寡糖诱导油菜抗菌核病由茉莉酸/乙烯信号途径介导[34];免疫诱导蛋白阿泰灵能诱导柑橘CsLOX2.1等JA合成关键基因的上调表达[35];在β-1,3葡聚糖对葡萄抗霜霉病的诱导抗性中,12-氧-植物二烯酸还原酶(12-oxo-phytodienoiCAcid reductase, OPR)被建议作为诱导抗性的标记物[15]。从本研究JAs生物合成途径蛋白被诱导上调表达的结果推测,JAs介导的信号传导途径可能也参与了大球盖菇多糖对猕猴桃生长和抗逆的调节。
4 结论
本研究结果表明,施用大球盖菇多糖可以使猕猴桃叶面积增加、叶片组织增厚、叶绿素含量提高。高温胁迫条件下,经大球盖菇多糖处理的植株的Fv/Fm比值、过氧化物酶和多酚氧化酶活性均高于对照。蛋白质组学分析发现,光合作用、胁迫应答、氧化还原、次生代谢产物等相关蛋白呈现差异表达。综上所述,大球盖菇多糖具有促进猕猴桃生长发育和诱导抗性的功能,本结果为后续多糖类诱导剂研究提供了理论基础。
