油茶籽油不同形态酚类化合物对油脂氧化稳定性的影响
2022-03-10刘国艳李思童朱雯绮周婉丽
刘国艳,李思童,梁 丽,朱雯绮,周婉丽,徐 鑫
(扬州大学 食品科学与工程学院,江苏 扬州 225009)
油茶籽油被誉为“东方橄榄油”,具有较高的氧化稳定性,酚类化合物作为其中重要的抗氧化成分,具有清除自由基、延缓油脂自氧化及抑制氧化产物生成的作用[1-2]。根据与基质中其他物质结合与否,酚类化合物分为游离酚(free phenolics,FP)与结合酚(bound phenolics,BP),而根据结合对象或价键不同,BP分为酯化酚(esterified phenolics,EP)及不溶性结合酚(insoluble-bound phenolics,ISP),其中EP又称为可溶性结合酚[3-4]。酚类化合物的抗氧化活性与其形态相关,但目前的研究大多集中在非油脂体系的化学抗氧化性的考察,而对油脂体系中的研究较少。Thiyam等[5]研究表明,油菜籽中芥子酸及FP表现出较高的抗氧化性,BP与总酚则因芥子碱的存在表现出一定的促油脂氧化作用;裘芳成等[6]研究发现,山茶油中糖苷态酚类化合物具有较强的抗氧化能力,其次为ISP、EP及FP;Alu’Datt等[7]研究发现,不同油料中FP及ISP的抗氧化能力排序不同。因此,有必要研究油茶籽油不同形态酚类化合物对油脂氧化稳定性的影响。另外,油茶籽油中酚类化合物组成复杂,其成分间常存在互作关系,如相加、协同及拮抗作用等,从而影响油脂的氧化稳定性[8-9]。因此,对油茶籽油酚类化合物进行形态区分,基于不同形态研究其抗氧化性及其互作关系具有重要意义。
含水有机溶剂会破坏酚类化合物分子间的氢键,有利于酚类化合物的溶出[10],故本文采用60%甲醇对油茶籽油FP进行提取。BP以共轭或价键形式与基质中其他物质结合,需经碱解或酸解释放后提取,而碱解条件下酚类化合物损失较小[11],故本文采用碱解方式对油茶籽油ISP进行提取。在优化FP、EP及ISP提取工艺基础上,本文采用Schaal烘箱法,模拟油茶籽油自身所含FP、EP及ISP在加速氧化过程中对油茶籽油氧化稳定性的影响,同时对其互作关系进行探究,为阐明酚类化合物的抗氧化机理及利用其协同增效作用延缓脂质氧化提供参考。
1 材料与方法
1.1 实验材料
长林系列油茶籽,购于江西,经烘干、脱壳及粉碎后备用;油茶籽油,冷榨法提取(自制)。甲醇、无水碳酸钠、氢氧化钠、乙酸乙酯、福林酚、冰乙酸、氯仿,国药集团化学试剂有限公司;没食子酸,阿拉丁试剂有限公司。
PHG-9070电热恒温鼓风干燥箱,上海精宏试验设备有限公司;DF-15连续投料粉碎机,温岭市林大机械有限公司;QYZ-230型自动液压榨油机,山东省泰安市良君益友机械有限公司;SHJ-A6数显恒温搅拌水浴锅,上海比朗仪器有限公司;SHB-III真空泵,郑州长城科工贸有限公司;RV-10 Basic旋转蒸发仪,德国IKA公司;UV1000紫外分光光度计,上海天美科学仪器有限公司。
1.2 实验方法
1.2.1 油茶籽油不同形态酚类化合物的提取
参考Ayoub[12]、Kang[13]等的方法提取油茶籽油不同形态酚类化合物。
FP提取:称取5 g油茶籽油,按照料液比1∶10加入60%甲醇,常温(25℃)下提取1 h后离心(8 000 r/min,5 min),沉淀重复提取3次,合并上清液(甲醇层),于40℃下真空浓缩后按照体积比1∶1加入乙酸乙酯萃取3次,合并乙酸乙酯层,于40℃下真空蒸干,用甲醇溶解获得FP提取液。
ISP提取:向提取FP后的沉淀中按照体积比1∶1 加入0.2 mol/L NaOH溶液,于50℃下避光碱解6 h后调节pH至2,离心(8 000 r/min,5 min)分离,向水相(下层)中按照体积比1∶1加入乙酸乙酯重复萃取3次,合并乙酸乙酯层,于40℃下真空蒸干,用甲醇溶解获得ISP提取液。
EP提取:向FP提取过程中乙酸乙酯萃取后的残余水相中按照体积比1∶1加入0.2 mol/L NaOH溶液,于50℃下避光碱解6 h,调节碱解液pH至2后,按照体积比1∶1加入乙酸乙酯重复萃取3次,合并乙酸乙酯层,于40℃下真空蒸干,用甲醇溶解获得EP提取液。
1.2.2 酚类化合物含量测定
采用Folin-Ciocalteu法[14],以没食子酸为标准品绘制标准曲线,测定各酚类化合物提取液中酚类化合物含量,最终换算为油茶籽油中酚类化合物含量。
1.2.3 油茶籽油不同形态酚类化合物对油脂氧化稳定性的影响及其互作关系研究
1.2.3.1 油样制备及加速氧化
将FP、EP及ISP提取液单独、两两或三种复配,按照油茶籽油原本酚类化合物含量添加至提取总酚后的空白油茶籽油中,氮吹除去甲醇后涡旋混匀。将适量油样置于敞口烧杯中,采用Schaal烘箱法于(63±1)℃黑暗烘箱中加速氧化1个月,期间每3 d取样测定过氧化值、酸值和茴香胺值。其中过氧化值的测定参照GB 5009.227—2016,茴香胺值的测定参照GB/T 24304—2009,酸值的测定参照GB 5009.229—2016。
1.2.3.2 不同形态酚类化合物互作关系分析
参考Marinova等[9]的方法,根据一、二级氧化产物的生成情况,作图确定各油样的诱导期。根据各样品诱导期计算稳定系数和协同价(见式(1)和式(2)),以分析不同形态酚类化合物对油脂氧化稳定性的影响及其互作关系。
(1)
(2)
式中:F为稳定系数;Iinh为添加酚类化合物的油样的诱导期;I0为空白油样的诱导期;Imix为添加混合酚类化合物的油样的诱导期;Ii为添加第i种酚类化合物油样的诱导期;S为不同形态酚类化合物的协同价,S<0表示拮抗作用,数值越小,拮抗作用越强;S>0表示协同作用,数值越大,协同作用越强。
1.2.4 数据处理
实验中所有测试均重复进行3次,结果采用“平均值±标准偏差”表示。使用Origin软件绘图,SPSS 19.0软件进行方差及显著性差异分析,显著水平为0.05。
2 结果与分析
2.1 油茶籽油不同形态酚类化合物提取工艺优化
2.1.1 单因素实验
采用单因素实验对FP、EP和ISP提取条件进行优化时,选择一个变量,其他提取条件参照1.2.1。不同提取因素对FP、ISP和EP提取的影响分别见图1、图2和图3。
由图1可见,随着提取时间延长、料液比增加及提取温度的升高,FP含量呈先上升后下降趋势。随着料液比增加,杂质大量溶出,影响FP分离;而提取时间过长或提取温度过高会使FP发生降解,造成FP含量下降[15-16];随着提取次数的增加,FP含量逐渐升高并在3次后趋于平缓(p>0.05)。
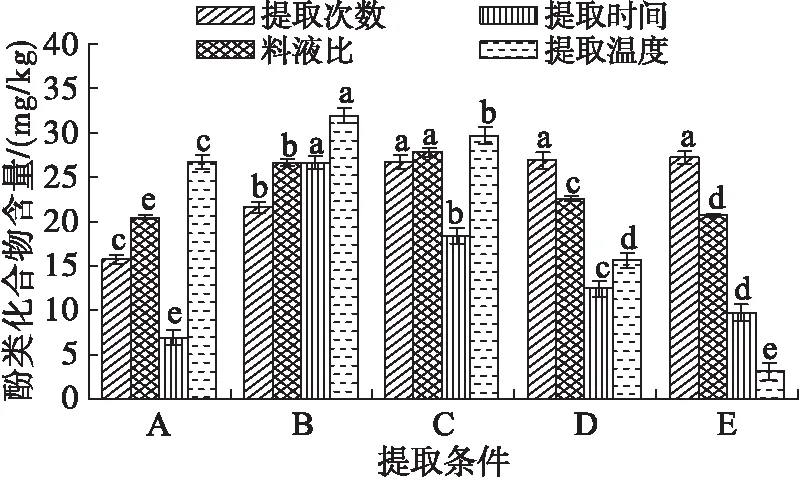
注:提取次数单因素实验时,提取条件A、B、C、D、E分别代表提取1、2、3、4、5次;料液比单因素实验时,提取条件A、B、C、D、E分别代表料液比为1∶25、1∶20、1∶15、1∶10、1∶5;提取时间单因素实验时,提取条件A、B、C、D、E分别代表提取时间为0.5、1.0、1.5、2.0、2.5 h;提取温度单因素实验时,提取条件A、B、C、D、E分别代表提取温度为25、35、45、55、65℃。柱状图上不同字母表示相同单因素条件下具有显著差异,下同。
由图2可见,随着碱解温度升高、碱解时间延长、料液比及NaOH浓度的增加,ISP含量呈先增加后降低的趋势。较短的碱解时间及较低的碱解温度会使ISP溶出不完全,但碱解时间过长、碱解温度过高及溶剂量过大会导致酚类化合物氧化分解或杂质溶出影响其分离[15-16];另外,碱解会破坏酯键释放出与酯类化合物结合的酚类化合物,但NaOH浓度过高会使酚羟基发生电离,造成ISP的损失[10]。

注:碱解温度单因素实验时,提取条件A、B、C、D、E分别代表碱解温度为25、35、45、55、65℃;料液比单因素实验时,提取条件A、B、C、D、E分别代表料液比为1∶5、1∶4、1∶3、1∶2、1∶1;NaOH浓度单因素实验时,提取条件A、B、C、D、E分别代表NaOH浓度为0.10、0.15、0.20、0.25、0.30 mol/L;碱解时间单因素实验时,提取条件A、B、C、D、E分别代表碱解时间为4、6、8、10、12 h。
由图3可见,随着碱解液与乙酸乙酯体积比及萃取次数的增加,EP含量先逐渐增加后趋于平缓(p>0.05)。综合考虑,选择碱解液与乙酸乙酯体积比为1∶1,萃取次数为3次。在此条件下,EP含量为(28.67±1.51)mg/kg。

注:萃取次数单因素实验时,提取条件A、B、C、D、E分别代表乙酸乙酯萃取1、2、3、4、5次;料液比单因素实验时,提取条件A、B、C、D、E分别代表料液比(碱解液与乙酸乙酯体积比)为1∶4、1∶3、1∶2、1∶1、2∶1。
2.1.2 正交实验
在单因素实验的基础上,采用正交实验对FP和ISP的提取条件进行优化。FP和ISP的正交实验因素水平分别见表1和表2,正交实验设计与结果见表3。

表1 FP正交实验因素水平
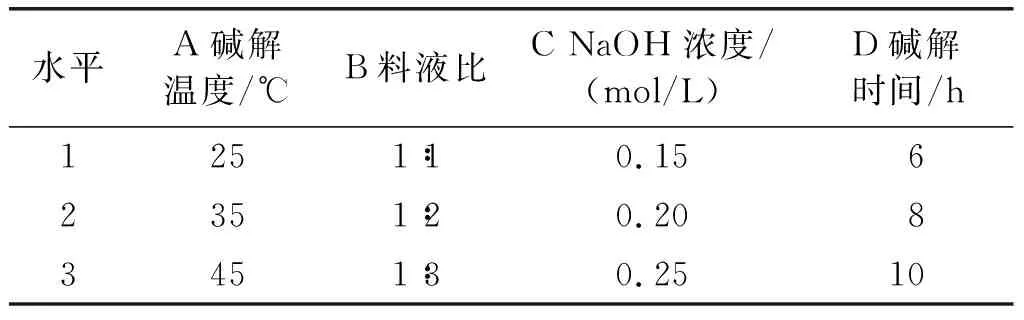
表2 ISP正交实验因素水平

表3 正交实验设计与结果

续表3
由表3可见:4个因素对FP含量影响的主次顺序为提取温度>提取时间>提取次数>料液比,FP最优提取工艺条件为A2B3C3D2,即料液比1∶15、提取时间1.5 h、提取温度45℃、提取次数3次;4个因素对ISP含量影响的主次顺序为NaOH浓度>碱解时间> 碱解温度>料液比,ISP最优提取工艺条件为A3B3C3D1,即碱解温度45℃、料液比1∶3、NaOH浓度0.25 mol/L、碱解时间6 h。在最优提取工艺条件下进行验证实验,油茶籽油中FP及ISP含量分别为(43.43±2.05)mg/kg及(65.87±1.34)mg/kg。
2.2 添加不同形态酚类化合物油茶籽油的储藏稳定性及其互作关系
2.2.1 添加不同形态酚类化合物油茶籽油的储藏稳定性
油脂氧化的主要底物为不饱和脂肪酸,在氧气或高温条件下氧化形成氢过氧化物(一级氧化产物),过氧化值是反映初级氧化产物生成量的重要指标[17-18]。氢过氧化物稳定性较差,氧化过程中分解产生大量二级氧化产物,而茴香胺值用于检测动植物油脂中的所有醛类,使用茴香胺值可以反映各油样二级氧化产物生成情况[19-21]。酸值反映了各油样中游离脂肪酸(free fatty acids,FFA)含量,是油脂氧化过程中的重要评价指标之一,且FFA含量越高的油脂越容易氧化[22]。测定了添加不同形态酚类化合物的油样在加速氧化过程中氧化指标的变化情况,结果见图4。
由图4(A)可见,前期氧化速率较低,氢过氧化物生成量较少,过氧化值变化平缓,随着时间的延长,氧化速率增加,氢过氧化物生成量显著增加,30 d 时各油样的过氧化值均低于空白,说明不同形态酚类化合物均具有增强油脂氧化稳定性的作用,其中EP+ISP表现出较高的抗氧化活性,其油样的过氧化值较空白油样下降了33.78%,而添加FP+EP+ISP及FP的油样过氧化值较空白油样分别下降了6.19%及2.55%,抗油脂氧化能力较差。另外,加速氧化结束后,各油样过氧化值均超出GB 2716—2018规定的植物原油过氧化值小于等于0.25 g/100 g(约9.85 mmol/kg)。
由图4(B)可见,加速氧化过程中茴香胺值与过氧化值呈现相似的变化趋势,氧化初期氢过氧化物分解量较低,茴香胺值维持较平稳状态,随着油脂氧化程度的加深,氢过氧化物大量分解产生二级氧化产物,茴香胺值表现出较高的增长速率。另外,由于二级氧化产物是油脂酸败过程中不良风味的主要来源,在氧化末期可以明显嗅到油脂酸败的气味。加速氧化结束后,各油样的茴香胺值均低于空白油样,其中添加EP+ISP油样的茴香胺值较空白油样降低了51.30%,油样的氧化稳定性较强;添加FP的油样茴香胺值较空白油样降低了23.01%,说明FP抗油脂氧化能力较差。
由图4(C)可见,各油样的酸值均随着储存时间的延长而增加,这是由于油脂的氧化酸败会导致FFA的增加,而FFA的产生又对油脂氧化酸败起促进作用。加速氧化结束后,各油样酸值均未超过GB 2716—2018规定的植物原油酸值(KOH)小于等于4 mg/g。其中,添加酚类化合物的油样中,添加EP+ISP 油样的酸值最低,较空白油样降低了12.70%,而添加FP油样的酸值最高,较空白仅降低了3.17%。
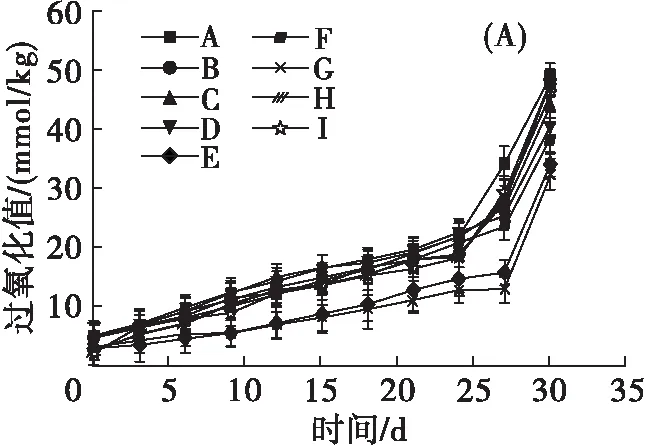


注:A.空白;B.FP;C.EP;D.ISP;E.FP+ISP;F.FP+EP;G.EP+ISP;H.FP+EP+ISP;I.对照(VE,添加量410 mg/kg)。
2.2.2 不同形态酚类化合物的互作关系
采用双切线法计算各油样的诱导期,并对各形态酚类化合物复配组的稳定系数和协同价进行计算,确定不同形态酚类化合物的互作关系,结果见表4。
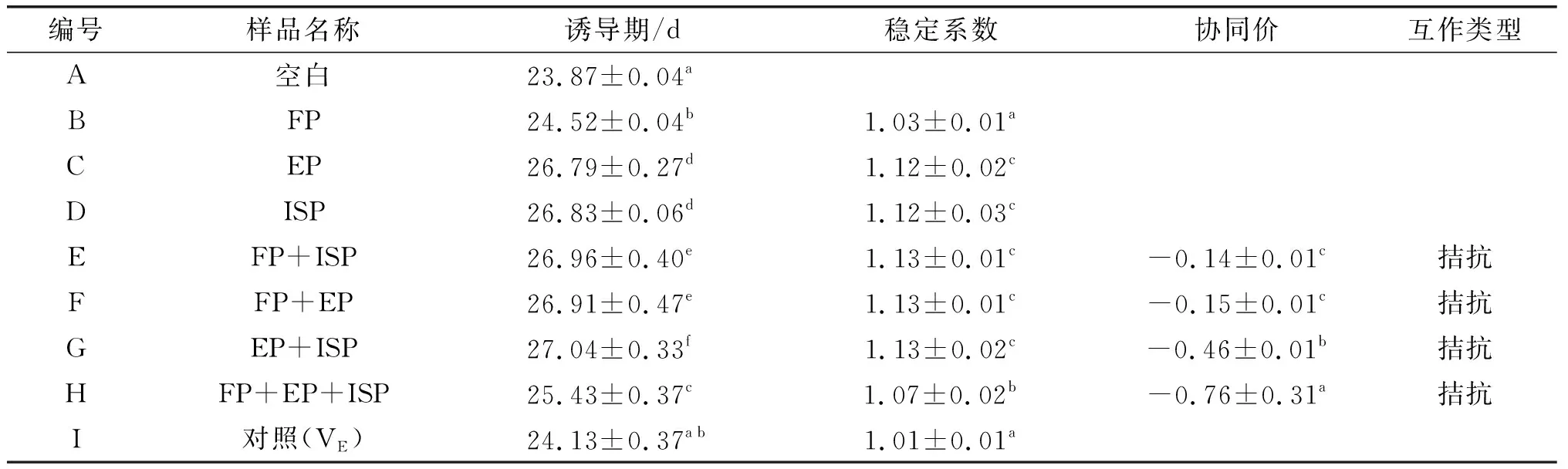
表4 各油样的氧化诱导期及不同形态酚类化合物的互作关系
由表4可见,结合酚(BP)的抗氧化性强于FP。这是因为一方面,油脂氧化过程中,氢过氧化物分解形成大量自由基,抗氧化剂(酚类化合物)提供氢原子与氧自由基结合形成非自由基产物或更稳定的抗氧化剂自由基,终止自由基链式反应以达到延缓油脂氧化的作用,而体系中结合态酚类化合物除自身发挥抗氧化作用外,还可能通过FP转移电子或氢原子与体系中抗氧化剂自由基结合实现再生,从而达到更长效且显著的抗油脂氧化能力[23],如Çelik等[24]研究发现麦麸中结合态阿魏酸可通过游离态酚类化合物实现再生,从而增强整体的抗氧化能力;另一方面,酚类化合物的活性基团(如羟基)位置及数目影响其抗氧化能力,不同形态酚类化合物组成存在差异,其活性基团的数量及排列也有所不同,进而影响其电离势或解离能,使其抗氧化活性存在差异[25]。
由表4还可看出,各酚类化合物复配后在油脂体系中均表现出不同程度的拮抗作用,其中FP+EP+ISP的拮抗作用最强。据报道,ISP主要与油脂中甘油酯结合存在,使其苯环邻位或间位羟基以及碳碳双键等活性基团形成分子间氢键,同时降低其解离能及电离势,发挥出更强的抗氧化能力,而本研究中ISP经碱解破坏其结合状态,使其抗氧化能力降低,可能是表现出拮抗作用的原因之一[26];另外,本研究基于油茶籽油不同形态酚类化合物实际含量向空白油样中反添加,与其他油样相比,复配组分中酚类化合物浓度较高,其中FP+EP+ISP中酚类化合物浓度最高,体系中抗氧化剂浓度越高形成的自由基越多,而抗氧化剂自由基同样可能参与自由基链式反应,加速其氧化进程,从而表现出一定的拮抗作用[27]。后续可深入探究不同形态酚类化合物具体物质结构对油脂氧化稳定性的影响,进一步揭示酚类化合物抗油脂氧化能力及其相互作用的差异及其原因。
稳定系数表示酚类化合物及其混合物作用的有效性,稳定系数越高表示其具有更稳定的抗氧化能力,其中酚类化合物两两复配时具有最高的稳定系数,而单一FP的稳定系数最低。根据诱导期,添加EP+ISP的油样氧化稳定性最强。
3 结 论
采用单因素实验及正交实验得到不同形态酚类化合物的最优提取工艺条件,其中:FP的最优提取工艺条件为提取温度45℃、提取时间1.5 h、提取次数3次、料液比1∶15;EP的最优提取工艺条件为碱解液与乙酸乙酯体积比1∶1,萃取次数3次;ISP的最优提取工艺条件为NaOH浓度0.25 mol/L、碱解时间6 h、碱解温度45℃、料液比1∶3。在最优提取工艺条件下,油茶籽油FP、EP及ISP含量分别为(43.43±2.05)mg/kg、(28.67±1.51)mg/kg及(65.87±1.34)mg/kg。利用Schaal烘箱法对不同形态酚类化合物单独及复配条件下对油茶籽油氧化稳定性的影响及其互作关系进行了研究。结果表明,不同形态酚类化合物单独及复配使用时均具有抑制氧化产物生成,增强油脂氧化稳定性的作用。另外,酚类化合物形态影响其复配条件下对油脂氧化稳定性的影响,各互作组分在油脂体系中均呈拮抗作用,其中FP+EP+ISP拮抗作用最强。本文研究结果揭示了油茶籽油不同形态酚类化合物对油脂氧化稳定性的影响,为发挥酚类化合物协同增效作用,增强油脂氧化稳定性提供了理论依据。
