米糠蛋白碳量子点的表征及应用
2022-03-10李小敏胡志雄张维农齐玉堂张燕鹏
李小敏,胡志雄,张维农,齐玉堂,张燕鹏,杜 言,左 陈
(武汉轻工大学 食品科学与工程学院,武汉 430023)
碳量子点是碳纳米材料家族中尺寸小于10 nm的新成员之一[1-2],由配体修饰的碳质核心表面组成,显示出内在的光致发光特性。碳量子点具有良好的生物相容性、光学和化学稳定性,丰富的表面官能团和极好的水溶性等特性,被广泛应用于生物传感[3]、细胞成像[4]、药物输送[2]及催化等领域。碳量子点主要有“自上而下”和“自下而上”两种合成路线。其中“自上而下”法通常是通过各种方法将最大的宏观结构分解成许多纳米结构,主要包括激光烧蚀、电弧放电、电化学氧化法[5]等,其碳源包括石墨、煤炭、活性炭和纳米金刚石[6]等;“自下而上”法的思路是由小分子构建更大的分子结构体系,主要包括热解[7]、水热[8]、微波合成[9]、化学氧化[10]和模板法[11]等,碳源包括柠檬酸盐、碳水化合物、有机酸等。
近几年,以天然和生态友好的材料作为碳前体,合成无毒、量子化产率高、水溶性好、绿色环保的荧光碳量子点备受关注[12],各种生物质材料如植物果实、果皮、中草药、奶制品等作为碳源制备荧光碳量子点的报道很多。Sahu等[13]通过水热合成法处理橙汁制备高绿色荧光碳量子点,可用于细胞成像;Huang等[14]以草莓汁为原料合成含氮碳量子点,并将其应用于Hg2+的检测。我国作为稻米生产大国,稻谷加工过程中的副产物米糠蛋白资源丰富,氨基酸组成接近FAO/WHO推荐的最佳模式,具有高生物价、生物效价、消化率及低致敏性等优点,常被用于婴幼儿食品配方中。米糠及其副产物米糠蛋白含有丰富的碳元素,为碳量子点的制备提供了所需的碳源。目前使用米糠及其副产物开发新型碳量子点的报道甚少,米糠蛋白为碳源制备高荧光性能的碳量子点尚未见报道。本文首次以米糠蛋白为原料制备碳量子点,并对米糠蛋白碳量子点进行了表征,探究其稳定性及应用效果,为米糠蛋白的高值循环再利用提供了一条创新的思路。
1 材料与方法
1.1 实验材料
米糠,潜江市洪湖浪米业有限责任公司;盐酸、氢氧化钠、氯化钠、甲醇、丙醇、二甲基亚砜(DMSO)、N,N-二甲基甲酰胺(DMF),均为分析纯;无水乙醇为色谱纯,国药集团;三氯化铁、三羟甲基氨基甲烷,阿拉丁试剂有限公司;正己烷、乙腈、二氯甲烷,均为分析纯,科密欧试剂有限公司。
Alpha 1-2 LD plus冷冻干燥机,德国Christ公司;Perkin Elmer Lambda 650紫外可见分光光度计;Enspire酶标仪,美国珀金埃尔默公司;水热反应釜,河南博硕仪器设备有限公司;傅里叶红外光谱仪,Perkin Elmer Frontier公司;F-4600荧光光谱仪,日本日立公司;ZF-7A手提紫外检测灯,上海宝光电光仪器厂;44 Talos F200X场发射透射电子显微镜(TEM),荷兰飞利浦公司;FV1200激光共聚焦显微扫描镜,日本Olympus公司。
1.2 实验方法
1.2.1 米糠蛋白(RBP)的制备
参考文献[15]的方法制备RBP。将米糠用正己烷脱脂,取一定量脱脂米糠粕,按质量体积比 1∶10加入双蒸水,混匀,用2 mol/L的NaOH调节pH 恒定为9.0,于55℃搅拌浸提2 h后,于12 000 r/min离心15 min,沉淀为脱脂脱蛋白米糠,置于45℃的烘箱烘干,上清液用2 mol/L的HCl调节pH为4.5,离心,沉淀水洗3次,直至水洗溶液的pH为7.0,冷冻干燥获得RBP,于4℃冰箱保存备用。凯氏定氮法测定RBP的蛋白质含量为85.1%。
1.2.2 米糠蛋白碳量子点的制备
采用水热合成法制备米糠蛋白碳量子点(RBP-CDs)。称取1.0 g米糠蛋白,置入50 mL水热反应釜中,加入30 mL蒸馏水,搅拌使其溶解或分散均匀,于180℃反应12 h,取出反应后的溶液搅拌均匀,于5 000 r/min离心10 min,过滤后滤液透析(分子质量1 000 Da)24 h,每隔4 h换1次水,透析后的溶液冷冻干燥即得RBP-CDs粉末。
1.2.3 RBP-CDs的荧光光谱、紫外-可见吸收光谱测定
采用F-4600荧光光谱仪,在310~600 nm范围内扫描荧光光谱,扫描速度1 200 nm/s,扫描电压700 V,EX/EM狭缝宽度5/5 nm。配制0.2 mg/mL的RBP-CDs溶液(以50 mmol/L pH 7.4的Tris-HCl缓冲溶液配制),采用紫外可见分光光度计在200~600 nm范围内扫描测定,记录其紫外-可见吸收光谱。
1.2.4 RBP-CDs的形貌及结构表征
透射电镜测定:配制1 mg/mL的RBP-CDs水溶液,超声分散均匀,滴加5~10 μL于碳膜上,自然晾干,于200 kV电压下观测样品的微观形态。
傅里叶红外光谱(FTIR)分析:按质量比1∶100将RBP-CDs与溴化钾混合,研磨均匀,压片后于傅里叶红外光谱仪测定,波数扫描范围4 000~400 cm-1,扫描次数32次,分辨率4 cm-1。
1.2.5 RBP-CDs的稳定性分析
pH的影响:配制一定浓度的RBP-CDs溶液,取2 mL pH 2~12的50 mmol/L Tris-HCl缓冲溶液加入200 μL RBP-CDs溶液,期间采用HCl和NaOH调节pH,使RBP-CDs最终质量浓度为0.2 mg/mL,于激发波长334 nm、发射波长415 nm处测定其荧光强度(F),以2 mL pH 7.4 Tris-HCl缓冲溶液加200 μL RBP-CDs为空白,测定荧光强度(F0),计算F/F0,考察pH对RBP-CDs稳定性的影响。
盐浓度的影响:向50 mmol/L pH 7.34的Tris-HCl缓冲溶液中添加NaCl,使其浓度范围为0~2.0 mol/L,加入RBP-CDs粉末使其质量浓度为0.2 mg/mL,于激发波长334 nm、发射波长415 nm处测定其荧光强度(F),以未添加NaCl的RBP-CDs溶液为空白,测定荧光强度(F0),计算F/F0,考察盐浓度对RBP-CDs稳定性的影响。
光学稳定性:紫外灯(波长为365 nm)距离0.2 mg/mL RBP-CDs溶液(以50 mmol/L pH 7.4的Tris-HCl缓冲溶液配制)5 cm处持续照射0~120 min,于激发波长334 nm、发射波长415 nm处测定其荧光强度(F),以未紫外灯照射(0 min)为空白,测定荧光强度(F0),计算F/F0,考察紫外光照射时间对RBP-CDs光学稳定性的影响。
化学稳定性:使用多种不同溶剂配制RBP-CDs溶液,使其质量浓度为0.2 mg/mL,于激发波长334 nm处测定其荧光发射光谱,考察溶剂对RBP-CDs稳定性的影响。
1.2.6 RBP-CDs的应用评价
1.2.6.1 阴、阳离子猝灭实验
取2.5 mL 50 mmol/L pH 7.4的Tris-HCl缓冲溶液,加入250 μL 0.2 mg/mL RBP-CDs溶液,然后分别添加10 μL不同阴、阳离子溶液(0.1 mol/L),混匀后在激发波长334 nm、发射波长415 nm处测定其荧光强度。以未加离子的RBP-CDs的Tris-HCl缓冲溶液为空白,计算加入相应离子时体系的荧光强度(F)与未加离子的荧光强度(F0)比值(F/F0)。
1.2.6.2 Fe3+的传感测定
按1.2.6.1的方法操作,调节Fe3+浓度范围为0.05~400 μmol/L,记录其荧光发射光谱(激发波长334 nm),并作相关统计分析,考察碳量子点对Fe3+的灵敏度、准确度。
1.2.6.3 细胞毒性实验
采用CCK-8试剂盒测定RBP-CDs对人肝癌细胞(HepG-2)的毒性。将HepG-2接种到96孔板(每孔1 000个细胞)中,每孔100 μL的HepG-2细胞悬浮液,将培养板于37℃培养箱(5% CO2)中孵育24 h。向培养板中加入10 μL不同质量浓度(0、50、100、200、400、800 μg/mL)的RBP-CDs溶液(以无菌去离子水配制),孵育一段时间后加入10 μL CCK-8溶液,孵育3 h,酶标仪测定吸光度(测定波长450 nm)。按下式计算细胞存活率(R)。
R=(As-Ab)/(Ac-Ab)×100%
(1)
式中:As为实验孔吸光度(含有细胞的培养基、CCK-8、待测物质);Ac为对照孔吸光度(含有细胞的培养基、CCK-8、无待测物质);Ab为空白孔吸光度(不含细胞和待测物质的培养基、CCK-8)。
1.2.6.4 细胞成像实验
取RBP-CDs,以无菌去离子水配制质量浓度1.0 mg/mL的溶液并缓慢加入到含HepG-2细胞的培养基中,使RBP-CDs最终质量浓度为0.2 mg/mL,孵育40 min后于1 200 r/min离心10 min,弃去上清液,用50 mmol/L pH 7.4 Tris-HCl缓冲溶液清洗3次,置于玻片上用于成像。
细胞成像通过FV1200激光共聚焦显微扫描镜测定,分别在405、488、543 nm处激发,收集蓝、绿、红色发射光谱带。
1.2.7 数据处理
所有数据均采用Origin 8.5绘图软件进行处理,碳量子点的粒径采用Nano Measure软件进行统计分析。
2 结果与分析
2.1 不同米糠原料水热合成法制备的碳量子点的荧光强度对比
分别以过0.25 mm(60目)筛的米糠、脱脂米糠、脱脂脱蛋白米糠、米糠蛋白为原料,按1.2.2方法制备碳量子点,按照1.2.3方法进行荧光光谱扫描,结果如图1所示。由图1可看出,相同条件下,RBP-CDs的荧光强度大大强于过0.25 mm(60目)筛的米糠、脱脂米糠、脱脂脱蛋白米糠碳量子点,因此本文采用米糠蛋白为原料制备高荧光碳量子点,同时测得其量子化产率为3.76%,元素组成中C、N、O原子质量比为70∶10∶18。
2.2 RBP-CDs的荧光光谱及紫外-可见吸收光谱
图2为不同激发波长下RBP-CDs的荧光发射光谱。
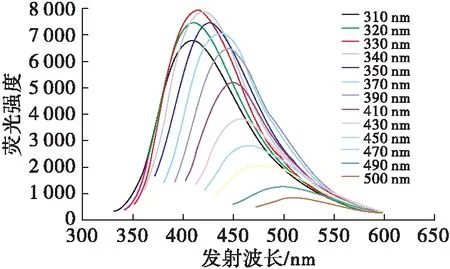
图2 不同激发波长下RBP-CDs的荧光发射光谱
由图2可看出:随着激发波长从310 nm增加至500 nm时,RBP-CDs荧光强度呈现先升后降的趋势,激发波长330 nm时荧光强度达到最大值;发射峰位置由400 nm逐渐红移至550 nm,显示RBP-CDs 具有明显荧光激发依赖性,这可能与碳量子点的尺寸效应与不同表面发射缺陷态的广泛分布有关[16]。


图3 RBP-CDs的紫外-可见吸收光谱
2.3 RBP-CDs的表征
2.3.1 透射电镜
图4为RBP-CDs的透射电镜图。

图4 RBP-CDs的透射电镜图
由图4可看出,RBP-CDs粒子数目较多且分散性较好,尺寸大小较均一,形状呈类球形。利用Nano Measure软件对RBP-CDs的粒径进行测定,发现RBP-CDs颗粒大部分集中在2~4 nm,计算得到RBP-CDs颗粒的平均粒径为(3.44±0.22)nm,粒径分布图大致呈正态分布(见图5)。
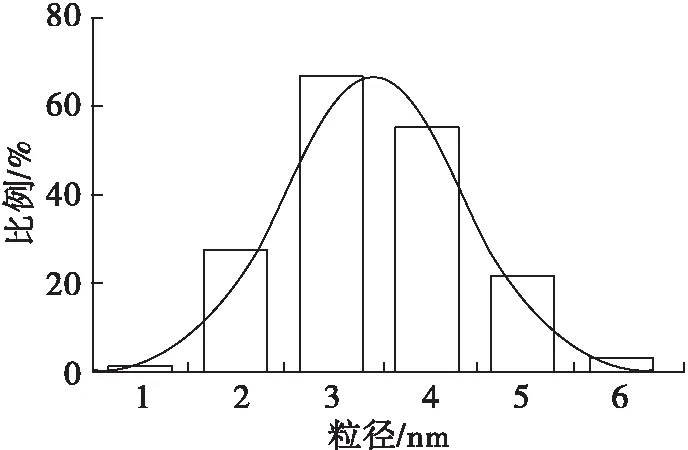
图5 RBP-CDs的粒径分布图
2.3.2 FTIR
通过FTIR对RBP-CDs的表面官能团进行表征,结果见图6。
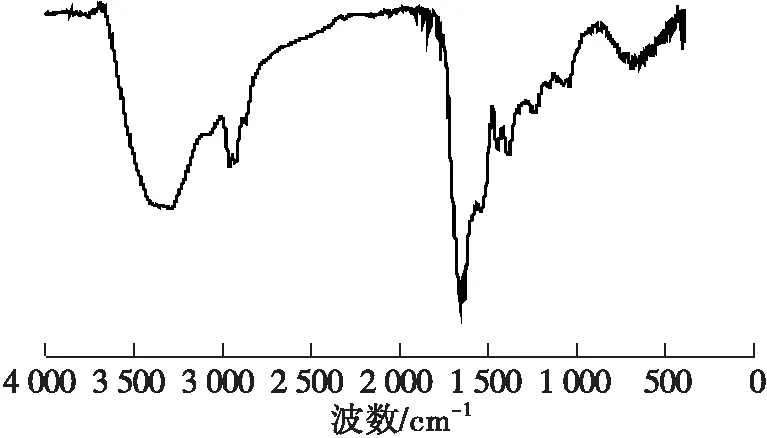
图6 RBP-CDs的FTIR谱图

2.4 RBP-CDs的稳定性
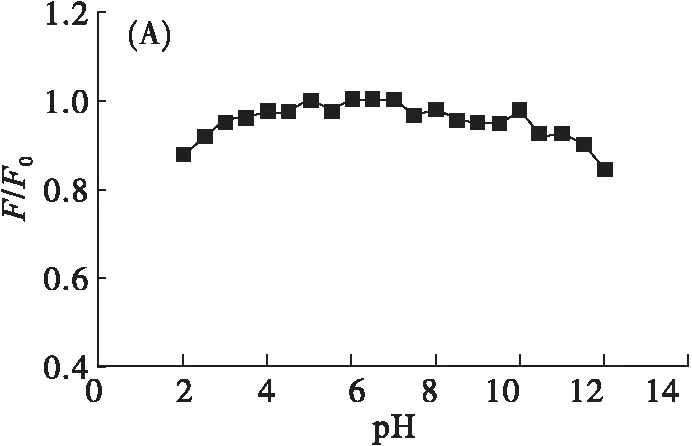
图7为pH、盐浓度、紫外光照射时间、溶剂对RBP-CDs荧光的影响。
由图7(A)可看出,在pH 4~10时,F/F0稳定,说明此pH范围内RBP-CDs的荧光强度相对稳定,而在强酸、强碱的条件下,RBP-CDs荧光强度明显下降。由图7(B)可看出,RBP-CDs在不同浓度的NaCl溶液中,F/F0变化不大,说明不同盐浓度下,RBP-CDs可保持较好的荧光稳定性。由图7(C)可看出,在波长为365 nm紫外灯连续照射120 min条件下,RBP-CDs的F/F0变化不大,说明RBP-CDs的光学稳定性较好。由图7(D)可看出:在DMF、DMSO、甲醇、无水乙醇的化学环境中,RBP-CDs的荧光强度有所增强;在异丙醇、乙醚、丙酮、正己烷、乙腈、二氯甲烷环境中,RBP-CDs的荧光强度下降幅度较大。表明有的化学环境能增加RBP-CDs的表面缺陷态,使RBP-CDs能够保持其优秀的荧光特性;有的则能破坏RBP-CDs表面缺陷态使其荧光强度降低。
2.5 RBP-CDs的应用
2.5.1 阴、阳离子对RBP-CDs的猝灭效果
按照1.2.6.1方法测定多种不同阴、阳离子对RBP-CDs的猝灭效应,结果如图8所示。
由图8可看出:阴离子对RBP-CDs的荧光强度基本均无影响;而部分阳离子对RBP-CDs有猝灭效果,如Cu2+、Ti2+、Fe3+等,其中Fe3+的猝灭效果尤其显著,猝灭率可达73.8%,呈现较强选择性,这种现象与大多数以生物质碳源碳量子点具有相似性,其原因可能是Fe3+与RBP-CDs表面的羟基、氨基、羧基发生相互作用,改变了RBP-CDs表面态的缺陷结构及电子转移进程,从而导致动态猝灭过程的出现。

2.5.2 对Fe3+的传感
基于Fe3+对RBP-CDs的显著猝灭效果与良好选择性,按1.2.6.2方法对RBP-CDs作为“Turn-Off”型荧光传感器测定Fe3+的效果进行了评价,结果分别见图9、图10。

图9 不同浓度Fe3+的RBP-CDs的荧光发射谱图

图10 F/F0和Fe3+浓度之间的关系
由图9、图10可看出,随着Fe3+浓度的增加,RBP-CDs在最大发射波长415 nm处的荧光强度逐渐降低,并且体系中Fe3+浓度在50~300 μmol/L范围内,F/F0(y)与Fe3+浓度(x)呈现良好的线性关系,线性回归方程为y=-0.001 4x+0.756 8,R2为0.990 6,检出限为15.2 nmol/L(S/N=3)。由此可见,RBP-CDs可以作为荧光探针对Fe3+进行高灵敏的传感检测分析。
2.5.3 细胞毒性及成像
2.5.3.1 细胞毒性
为了探索RBP-CDs在细胞成像和传感领域中的应用潜力,通常需要评估其是否具有光学优点及低细胞毒性[17]。按1.2.6.3方法测定了RBP-CDs对HepG-2的毒性,结果如图11所示。

图11 RBP-CDs对HepG-2细胞的毒性效应
由图11可看出:随着RBP-CDs质量浓度的升高,细胞存活率缓慢降低,在RBP-CDs质量浓度为200 μg/mL时,细胞存活率为93.6%;RBP-CDs质量浓度高达800 μg/mL时,细胞存活率仍可达到88.5%。可见,RBP-CDs的细胞毒性非常低,具有良好的生物亲和性,可以安全应用于细胞标记与细胞成像领域中。
2.5.3.2 细胞成像
按1.2.6.4方法,采用0.2 mg/mL(兼顾毒性、染色效果与成本)的RBP-CDs溶液对HepG-2细胞孵育进行细胞成像实验,使用激光共聚焦显微扫描镜对细胞进行观察,结果如图12所示。

注:(A)405 nm,蓝色荧光;(B)488 nm,绿色荧光;(C)543 nm,红色荧光;(D)明场。
由图12可看出,与未标记的HepG-2细胞(明场)比较,以RBP-CDs标记的HepG-2细胞通过不同波长的激光进行激发,呈现明亮的多色荧光,细胞状态良好,且荧光主要分布于细胞膜、细胞核区域,说明RBP-CDs具有良好的细胞通透性、生物相容性。
3 结 论
本文以米糠蛋白为碳源,采用水热合成法制备强荧光、水溶性良好的荧光碳量子点(RBP-CDs),原料资源丰富、低廉易得,操作过程简便、绿色环保。通过紫外、荧光、TEM、FTIR对RBP-CDs的光学特性及结构进行表征,制备的RBP-CDs分散性较好,粒径主要集中在2~4 nm,平均粒径为3.44 nm;其表面富含羟基、羧基等亲水基团,碳量子点水溶性良好。将RBP-CDs置于不同pH、NaCl浓度、紫外光照射时间以及不同化学环境中,发现RBP-CDs在pH 4~10、不同浓度的盐环境中,其荧光性能良好;而不同化学环境其荧光强度差别较大,主要是与其表面缺陷态有关;在365 nm紫外灯长时间照射下,RBP-CDs表现出良好的光学稳定性。通过阴、阳离子的猝灭实验发现Fe3+对RBP-CDs的荧光猝灭效果较好;Fe3+浓度在50~300 μmol/L时,RBP-CDs荧光强度与Fe3+浓度之间呈现良好的线性关系,表明RBP-CDs对Fe3+的荧光传感有较高灵敏度;细胞毒性实验发现RBP-CDs细胞毒性较低,将其用于HepG-2细胞染色,发现其对细胞的染色效果较好,细胞状态良好,表明其具备良好的生物相容性。基于RBP-CDs上述优良特点,其在荧光染料、细胞成像等领域的应用前景广阔。
