基于RIPK1/PGAM5通路探讨二甲双胍干预治疗对高眼压青光眼大鼠视网膜神经节细胞退行性变的影响
2022-03-10肖红霞杨海荣曾云叶汉元荆门市第二人民医院眼科湖北荆门448000
肖红霞 杨海荣 曾云 叶汉元 (荆门市第二人民医院眼科,湖北 荆门 448000)
青光眼是一组伴随特征性视野缺损、视盘凹陷病理性扩大的致盲性眼病,其发病率逐年增长〔1〕。罹患该病,伴随周边视力下降,不进行干预治疗会导致中心视力失明甚至永久性视力丧失〔2〕。青光眼危险因素包括眼压(IOP)升高、家族病史和高血压,IOP升高会进一步压迫视网膜神经节细胞,导致神经节细胞退行性变。已有研究证实,减缓视网膜神经节细胞退行性是治疗青光眼重要方向〔3〕。RIPK1抑制剂(RIC)腹腔给药对青光眼视网膜神经节细胞损害具有保护作用,且可防止视网膜色素上皮丢失〔4〕。RIPK1在程序性坏死中起着关键作用〔5〕。若能更好地了解眼内压介导的视网膜神经节细胞变性机制,可为青光眼患者挽救视网膜神经节细胞退行性变开辟道路〔6〕。因此,本项目基于前人经验和课题,提出新的分子假说,揭示参与减缓视网膜神经节细胞退行性变的信号分子机制,为临床提供参考。
1 资料与方法
1.1一般资料 实验动物:北京医疗器械检验所(动物实验中心)清洁级大鼠72只,构建高IOP青光眼手术模型;动物使用和处理符合中华人民共和国国家卫生研究院实验动物保护法和使用指导要求,且通过医学动物伦理委员会批准。大鼠体重0.32~0.42 kg,平均(0.34±0.03)kg;3~5月龄,平均(4.32±0.21)月龄;单笼饲养7 d;常规全面眼部检查排除眼部其他疾患。
1.2造模及分组方法 建模:检查眼膜上皮、眼底情况,采用美国TONO-PEN AVIA接触式IOP笔(上海涵飞医疗器械有限公司)每天测量1次IOP,共测量3 d,取平均值作为大鼠基础IOP。通过腹腔注射10 mg/kg二甲苯嗪(北京御生堂集团,国药准字Z13022371)和 25 mg/kg氯胺酮盐酸盐麻醉大鼠,眼睛使用0.5%盐酸丙环卡因进行局部麻醉;制备大鼠右眼慢性高IOP:前房内注入预先混合物,即原位交联水凝胶(硫醇改性羧甲基透明质酸:硫醇反应性聚乙二醇二丙烯酸酯=4∶1),从角膜向中央进行前房穿刺,31号针通过切口将体积为7 μl的新鲜液体混合物立即注入前房,左眼不作为对照眼以减少动物的痛苦;术后滴加0.5%盐酸左氧氟沙星预防感染。假手术组诱导高IOP与建模组相似,但使用等量生理盐水替代混合物。过程中死亡大鼠用无差异的存活大鼠补充。
建模成功30 min后将大鼠随机分为9组,每组8只。A组(假手术组),B组(模型组),C组〔建模+腹腔注射含1 μg正常免疫球蛋白(IgG)的磷酸盐缓冲液(PBS)2 μl〕,D组(建模+眼局部喷洒含1 μg二甲双胍的PBS 2 μl),E组(建模+腹腔注射含1 μg二甲双胍的PBS 2 μl),AMPK拮抗组(腹腔注射AMPK拮抗剂),siRNA组(腹腔注射siRNA),RIC组(腹腔注射RIC),RIPK1激动组(腹腔注射RIPK1激动剂)。
药物处理后采用术前所用IOP笔测量IOP 3次且取平均值,并于1 w后以80 mg/kg剂量的戊巴比妥钠深度麻醉大鼠,断头处死并取挫伤灶行常规苏木素-伊红(HE)染色和组织化学染色。
1.3视网膜神经节细胞的标记和计量 在处死大鼠前7 d,注射细胞膜红色荧光探针(Dil)进入双侧上丘,将40 mg Dil混合到1 ml的二甲基亚砜(DMSO)中,立体定位坐标是(6.4 mm,1.5 mm,4.0 mm);注射1.5 μl Dil;7 d后,经心灌注生理盐水和4%多聚甲醛,分离视网膜神经上皮层并完全固定于载玻片上,显微镜观察拍照,采用Image J分析。
1.4视网膜神经节细胞离体原代培养 分离视网膜,在37℃的杜氏磷酸盐缓冲液(D-PBS)(无Ca2+,含20 U/ml木瓜蛋白酶、1 ml半胱氨酸、0.005% Mg2+)中孵育30 min;用无菌眼科剪在D-PBS缓冲液中轻轻剪碎视网膜,用牛血清白蛋白(BSA)溶液(含0.15%胰蛋白酶抑制剂、0.15%牛血清)和0.005%DNA酶使细胞再悬浮于含0.1%BSA的D-PBS缓冲液中;使用Thy1细胞表面抗原单克隆抗体(Thy-1mAb)免疫细胞化学法鉴定视网膜神经节细胞(RGCs);接种于多聚赖氨酸包被的预先置入盖玻片的24孔培养板中培养。
1.5判定标准 染色标准:①切片完整,厚度4~6 μm,厚薄均匀,无皱褶无刀痕;②染色核浆分明,红蓝适度,透明洁净,封裱美观。由两位5年以上从事苏木素-伊红(HE)染色实验的临床专业医师在对临床病理资料不知情情况下进行判断细胞阳性表达情况。染色判定标准:依据阳性细胞染色程度和所占比例进行评分:无色:0分,浅色:1分,正常:2分,深色:3分;阴性(-):细胞结构清晰无显色;弱阳性(+):染色1分;阳性():染色2分;强阳性():3分。
1.6观察指标视网膜 ①IOP检测:在全身浅麻醉下,吸入2%~4%异氟烷维持麻醉来测量IOP,以尽量减少由大鼠运动和应激引起的误差;用TonoLabReboundTonometer(芬兰,万塔伊卡尔)测量IOP。为避免昼夜节律的影响,在上午 10点至下午 2点连续6次测量后取平均值。②视网膜形态学检测:进行视网膜神经节细胞标记和计量后,采用HE染色观察视网膜切片神经节细胞层(GCL)、内丛状层(IPL)、外核层(ONL)和外丛状层(OPL)细胞密度变化及IPL厚度变化。③视网膜神经节细胞凋亡情况:使用TUNEL法检测。④线粒体功能检测:肌肉注射麻醉大鼠后,在眼球后方3 mm处暴露视神经并放入浸泡四甲基玫瑰胺氯化物染料的凝胶泡沫(美国Invitrogen公司);缝合切口,局部应用氧氟沙星眼药膏;切片后使用荧光显微镜观察视网膜3个部位,捕获的横切面上视神经层的染料标记线粒体,采用CCK-8比色法检测并取平均值进行统计,根据荧光强度来判断线粒体受损程度,荧光越弱受损越严重;记录线粒体Cytc/a值、磷氧比(P/O)、H2O2变化。⑤在药物处理结束后,获取培养的视网膜神经节细胞新鲜细胞,使用Western印迹法检测AMPK激活水平,RIPK1、Caspase-3、PGAM5、Keap1表达水平。取各组大鼠眼部组织,充分裂解,13 000 r/min离心15 min,取上清液,采用BCA蛋白质定量试剂盒(深圳子科生物科技有限公司)对蛋白定量;提取其中总蛋白上样,电泳,转膜,封闭,加入上样缓冲液后沸水浴10 min使蛋白充分变性,此后依次经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、转膜、封闭、兔抗人单克隆抗体(包括AMPK、RIPK1、Caspase-3、PGAM5、Keap1单克隆抗体)孵育、二抗辣根过氧化物酶标记羊抗兔IgG孵育,采用超敏电化学发光(ECL)试剂盒进行蛋白检测,用凝胶成像仪观察结果。⑥药物处理结束后,获取培养的视网膜神经节细胞新鲜细胞,采用RT-PCR技术检测RIPK1、PGAM5的mRNA水平变化。采用Trizol试剂盒提取总RNA,并分析RNA完整性及纯度;逆转录试剂盒逆转录RIPK1、PGAM5得cDNA,将其冻存于-20℃冰箱备用;实时荧光定量PCR仪与荧光定量PCR试剂盒依次对cDNA进行预变性、变性、退火复性、延伸,并重复PCR操作次数增加扩增产物;采用阈值比较法对结果进行判定。引物序列:RIPK1正义链:5′-TTAGTTGCGTTACACCCTTTC-3′,反义链:5′-ACCTTCACCGTTCCAGTT-3′;PGAM5正义链:5′-TGTGTGGAGAGCGTCAACC-3′,反义链:5′-TGGATCCAGGTGTGCAGGT-3。⑦使用免疫共沉淀技术检测RIPK1和FDAA结合情况,Keap1和PGAM5结合情况。
1.7统计学方法 采用SPSS21.0软件进行单因素方差分析、SNK-q检验、非参数检验Mann-Whitney法。
2 结 果
2.1各组IOP比较 治疗前,B、C、D、E、AMPK拮抗、siRNA、RIC、RIPK1激动组IOP均显著高于A组(P<0.05);治疗后,D、E、siRNA、RIC组IOP显著低于治疗前(P<0.05),且显著低于B、C、AMPK拮抗、RIPK1激动组(P<0.05);治疗后siRNA、RIC组IOP显著低于D、E组(P<0.05)。见表1。
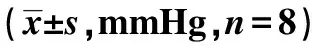
表1 各组IOP比较
2.2各组GCL、IPL、ONL、OPL细胞密度变化及IPL厚度变化 B组GCL、IPL、ONL、OPL细胞密度、IPL细胞厚度显著低于A组;D、E、siRNA、RIC组GCL、IPL、ONL、OPL细胞密度、IPL细胞厚度显著高于B、C、AMPK拮抗、RIPK1激动组(P<0.05)。见表2。
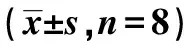
表2 各组GCL、IPL、ONL、OPL细胞密度变化及IPL厚度变化比较
2.3各组线粒体受损情况比较 B组线粒体Cytc/a、P/O、H2O2水平显著低于A组(P<0.05);D、E、siRNA、RIC组Cytc/a、P/O、H2O2水平均显著高于B组(P<0.05),AMPK拮抗、RIPK1激动组Cytc/a、P/O、H2O2水平均显著低于B组(P<0.05);siRNA、RIC组Cytc/a、P/O、H2O2水平显著高于C、D、E组(P<0.05);见表3、图1。
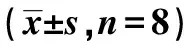
表3 各组线粒体受损情况及RIPK1、PGAM5 mRNA水平比较
2.4各组RIPK1、PGAM5 mRNA水平变化 B组RIPK1、PGAM5 mRNA表达水平均显著高于A组;D、E、siRNA、RIC组RIPK1、PGAM5的mRNA表达水平低于B、C、AMPK拮抗、RIPK1激动组(P<0.05);见表3、图2。
2.5各组AMPK、RIPK1、Caspase-3、PGAM5、Keap1表达水平 B组神经组织中AMPK、PGAM5、Keap1表达水平显著低于A组(P<0.05),RIPK1、Caspase-3表达水平显著高于A组(P<0.05);siRNA、RIC组AMPK、PGAM5、Keap1表达水平显著高于D、E组,D、E组高于B、C、AMPK拮抗、RIPK1激动组(P<0.05),siRNA、RIC组RIPK1、Caspase-3表达水平低于D、E组,D、E组低于B、C、AMPK拮抗、RIPK1激动组(P<0.05);见表4、图3。
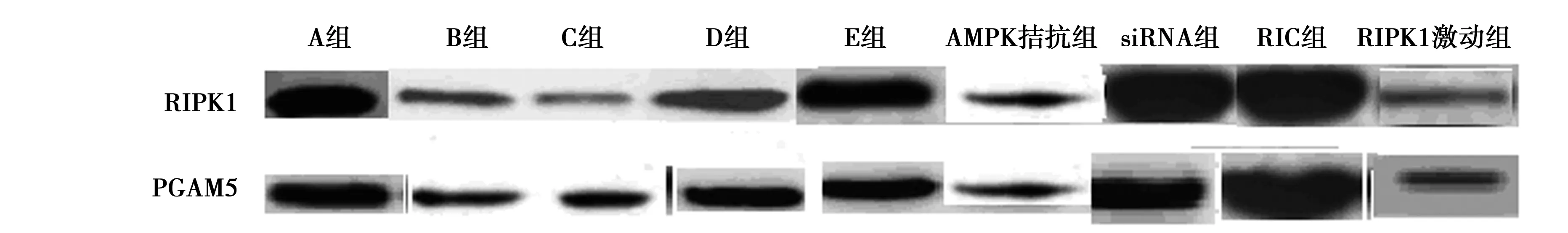
图2 各组RIPK1、PGAM5 mRNA水平
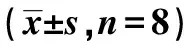
表4 对比各组AMPK、RIPK1、Caspase-3、PGAM5、Keap1表达水平

图3 各组AMPK、RIPK1、Caspase-3、PGAM5、Keap1表达水平
3 讨 论
青光眼的病理学基础及确定高IOP危险因素均可为青光眼治疗提供有价值的信息〔7〕。近年来随着分子假说的广泛应用,有学者认为对神经节细胞的分子机制全面细致研究能为青光眼治疗提供更优方案〔8〕。有研究认为RIPK1作为受体相互作用蛋白(RIP)丝氨酸苏氨酸激酶家族一员,可对TNFR1多种下游信号通路进行控制,保证其稳态〔9〕。另有文献认为,常规降糖药二甲双胍在AMPK通路中可促进Keap1转移到线粒体与PGAM5形成复合物,促进PGAM5泛素化而降解,从而缓解心脏缺血再灌注导致的心肌细胞损伤〔10〕。
目前认为参与视网膜神经节细胞的退行性变主要包括:一是在TNF-RSC中,RIPK1通过招募TAB1/2来促进转化生长因子-β-活化激酶(TAK)1的激活,参与调节NF-κB激活;二是RIPK1通路中较多的Caspase-3可参与许多类型神经退行性变,早有研究发现敲除 Caspase-3后可减慢乙醇诱导的神经元凋亡变性〔11〕;三是AMPK的激活可抑制RIP3介导的星形胶质细胞的氧化应激、炎症反应和凋亡,可延缓神经节细胞的退行性变〔12〕。但目前RIPK1是否介导下游Caspase-3参与视网膜神经节细胞退行性变及RIPK1上游是否具有新的有效靶点来抑制RIPK1介导的视网膜神经节细胞损伤仍需进一步研究。本课题组根据前期研究和前沿科学研究成果,将二甲双胍应用于高眼压青光眼实验研究,因其为糖尿病治疗中常用药物,且目前未见相关报道,具有一定创新性。本研究结果显示,二甲双胍治疗后大鼠IOP、视网膜神经节细胞丢失情况及线粒体损伤情况较治疗前有显著改善,提示二甲双胍临床治疗有效。线粒体为细胞能量工厂,在细胞内将糖等化合物转化为细胞能够使用的能量,当低氧时线粒体会产生活性氧,导致线粒体功能障碍。在王霞等〔13〕研究指出,线粒体功能的正常维持可保证细胞的正常功能。本研究另检测RIPK1、PGAM5表达水平发现,治疗组RIPK1呈低表达,PGAM5呈高表达,提示AMPK激活为二甲双胍治疗高IOP型青光眼有效靶点。另外,脂肪通过线粒体Ca2+超载诱导线粒体快速出现功能障碍,随后通过 RIPK1 和 ERK1/2 激活产生过氧化物介导胰腺癌细胞的死亡,但AMPK激活可逆转RIPK1介导的细胞凋亡。Dang等〔14〕研究表明,主要生物活性成分木脂素在体外保护视网膜神经节细胞免受氧化应激诱导损伤,还可对大鼠青光眼相关视神经病变发挥神经保护作用,且这一保护作用是通过激活AMPK信号发挥抗氧化应激作用实现的。钱道卫等〔15〕的离体研究实验比较了RIPK1三种不同抑制剂对视网膜神经节细胞的保护作用,RIC可保护神经节细胞免受缺氧缺糖损伤,而Nec-1、Cpd27可挽救TNF-α所致视网膜神经节细胞死亡。有研究认为AMPK是RIPK1/PGAM5信号转导通路中关键环节,AMPK磷酸化后可调节的底物蛋白进而调控细胞一系列生理过程〔16〕。王超〔17〕研究发现敲减AMPK后神经细胞中PGAM5、Keap1 蛋白减少,这与本研究结果相符,提示AMPK可通过抑制RIPK1活性减缓细胞退行性变。为了验证RIPK1与PGAM5是否具有相关性,本研究进行了mRNA定量分析,结果提示PGAM5对神经节细胞增殖、转移有负调控作用。
综上,二甲双胍激活AMPK通过抑制RIPK1介导青光眼神经节细胞的退行性变;被RIPK1激活的PGAM5介导线粒体功能障碍促青光眼神经节细胞的程序性坏死,二甲双胍激活AMPK促进Keap-1与线粒PGAM5形成复合物进而促使PGAM5降解,改善线粒体功能,从而发挥抑制神经节细胞程序性坏死的作用。
