生物气溶胶监测仪的校准方法比较
2022-03-09张国城刘佳琪李晶晶霍胜伟沈上圯潘一廷
田 莹, 张国城, 吴 丹, 刘佳琪, 李晶晶, 霍胜伟, 沈上圯, 潘一廷
(1.北京市计量检测科学研究院 国家生态环境监测治理产品质量监督检验中心,北京 100029;2.北京大学 环境科学与工程学院,北京 100871)
1 引 言
生物气溶胶指的是源自生物体的固体气载颗粒,包括微生物以及植物碎片和动物皮屑等生物材料碎片[1]。病原性生物气溶胶通过传播感染人类,导致过敏、呼吸道疾病等,也会危害农作物和牲畜,大大降低产量和经济效益[2]。目前最常见的实时生物气溶胶监测技术是激光诱导荧光。该技术使用单色光对通过仪器的单个颗粒的荧光特性进行表征,根据特定波长范围中颗粒物的荧光信号强度对待检粒子进行判定。某些生物分子,特别是含有芳香环(即核黄素和几种氨基酸)的分子荧光较强,而大多数非生物气溶胶的荧光强度相当低[3]。
作为前端预警触发器,生物气溶胶监测仪在生物防恐以及疾病防控方面都具有重大的意义。随着新型冠状病毒疫情的爆发,生物气溶胶监测仪的市场需求量激增,但质量参差不齐,无法保证仪器的准确性。目前中国颗粒学会标准“T/CSP 7-2020 颗粒技术 紫外荧光生物气溶胶监测技术要求”规定了紫外荧光生物气溶胶监测仪的性能要求,但是尚未建立相应的检测方法和校准规范[4,5]。
本文开展了生物气溶胶监测仪校准方法的研究,一方面探索了细菌存活状态对监测仪荧光粒子读数的影响;另一方面比对实时定量PCR和菌落计数法对生物气溶胶的检测结果,并通过扫描电镜,荧光染色等方法观察采集瓶中细菌的状态,从而为生物气溶胶监测仪的量值溯源提供可靠的技术手段。
2 实验方法
2.1 菌液的准备
本实验采用的细菌是革兰氏阴性菌大肠杆菌(ATCC 15597)和革兰氏阳性菌金黄色葡萄球菌(CGMCC 1.2465)。挑取单克隆菌落到30 mL的LB液体培养基中;在37 ℃恒温振荡器中培养过夜,速度设为220 r/min;之后再将0.5 mL的菌液加入到25 mL新鲜LB培养基中,以220 r/min的转速进行活化。得到的细菌悬液7 000 r/min离心5 min,去除培养基,用高压灭菌的超纯水清洗之后再次离心,重悬在50 mL的超纯水中,用于雾化。最后利用BioSampler(SKC Inc.,ΜSA)采样器采集生物气溶胶,采样的流量为12.5 L/min,采样时间为30 min,采样瓶中的介质为20 mL的灭菌超纯水。
2.2 菌落计数法
生物气溶胶采样器将细菌采集到液体介质中,连续稀释后取100 μL涂布到LB固体培养基上,在37 ℃培养箱中培养24 h,形成肉眼可见的菌落,通过肉眼计数得到菌落个数,并根据采样体积计算测量舱中可培养菌的浓度。具体可通过下式进行计算:
式中:Cculturable为测量舱中可培养微生物气溶胶的浓度;N代表平板上长出的菌落总数;DF为稀释的倍数;Qsampler是采样的流量;Tsampler是采样的时间。
2.3 荧光光谱法
本文使用的是日立F-7000荧光分光光度计,选择激发波长分比为280 nm和405 nm,光电倍增管电压分别为400 V和700 V,扫描速度为1 200 nm/min。将高压蒸汽灭菌前后的菌液用超纯水清洗之后检测荧光强度。
2.4 实时荧光定量PCR
探针法实时荧光定量PCR对样本检测时,灵敏度和特异性极高,能够检测出环境样本中的大多数微生物[6]。qPCR实验可以对总的生物气溶胶浓度进行定量检测。BioSampler采集到的液体通过细菌基因组DNA提取试剂盒(DP302,天根生化科技有限公司)提取总的基因组DNA,最终溶解到50 μL的超纯水中。qPCR的反应体系为50 μL,包括:5 μL上述DNA模版,1 μL 10 mmol/L的正向引物,1 μL 10 mmol/L的反向引物,1 μL 10 mmol/L的探针,25 μL的2× Taq PCR预混合液(KT201,天根生化科技有限公司)以及17 μL的超纯水。整个qPCR实验在罗氏LightCycler 480仪器上进行[7]。循环参数为:50 ℃ 2 min,95 ℃ 10 min,40个循环(95 ℃ 15 s,60 ℃ 1 min)。所有的引物和探针都是由上海生工生物工程有限公司合成,具体的序列如表1所示。超纯水作为qPCR实验中的阴性对照。通过直接显微镜计数得到大肠杆菌和金黄色葡萄球菌的浓度,连续10倍梯度稀释后进行DNA的提取,最终得到两种细菌的DNA标准曲线。将采集到的液体4 000 r/min离心10 min中后提取DNA,总的生物气溶胶浓度通过下式进行计算:
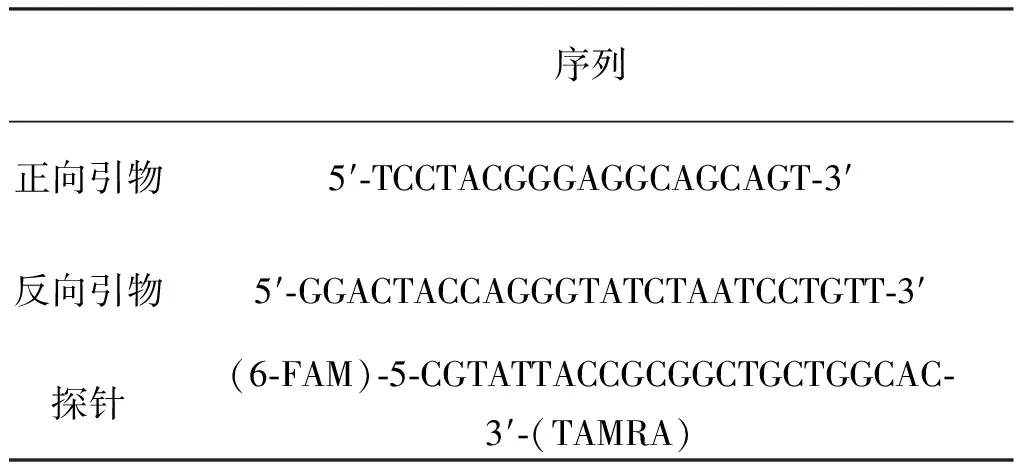
表1 引物序列
Ctotal=Nqpcr/Vsampler
式中:Ctotal是测量舱内总的生物气溶胶浓度;Nqpcr是根据细菌标准曲线得到的总细菌数量;Vsampler是采集到的空气体积。
2.5 SEM电镜
本研究使用电子扫描显微镜(Zeiss)对BioSampler采集前后大肠杆菌和金黄色葡萄球菌的微观形态进行观察。将采集前后的菌液10 000 r/min下离心5 min去除上清,加入戊二醛(2.5%)覆盖住样品,放入4 ℃冰箱中固定6 h以上。去除戊二醛,依次加入30%,50%,70%,80%,90%,100%的酒精进行梯度脱水,每个梯度静置10 min。脱水后将样品放在恒温培养箱中干燥,50 ℃干燥过夜,使水分充分蒸发。最后,取少量样品置于硅片上送入电镜室进行观察。
2.6 荧光显微镜
为了能够更加直观清晰地观察BioSampler采样前后细菌的状态,使用荧光电子显微镜(Olympμs,IX83)进行观测。细菌细胞活性测定试剂盒(Invitrogen,L7012)中含有SYTO 9绿色荧光核酸染料和PI红色核酸染料[8]。细胞膜完好的正常细菌会染成绿色,而对于死亡或将死的细菌,细胞将被染成红色。将采集前后的菌液10 000 r/min下离心5 min去除上清。用100 μL的PBS重悬,避光加入1 μL的绿色染料和1 μL的红色染料。在37 ℃下避光孵育30 min。然后以5 000 r/min的转速离心5 min,PBS清洗一遍。最后取微量细胞悬液滴在盖玻片上作为样品,在荧光显微镜下进行观测。
3 实验结果
3.1 细菌存活状态对监测仪的影响
生物粒子包含氨基酸,辅酶(NAD(P)H)以及核黄素化合物等,这些物质在紫外光诱导下可以产生荧光,这也是生物气溶胶监测仪区分生物粒子和非生物粒子的关键依据。色氨酸、酪氨酸、苯基丙氨酸分别在280 nm、275 nm和260 nm左右的紫外光激发下荧光激发效率较高,产生的荧光发射光谱主要集中在280~650 nm波长范围[9]。本实验中采用的某国产品牌生物气溶胶监测仪的激发波长为405 nm,荧光发射波长为420~650 nm。
利用荧光分光光度计检测高压蒸汽灭活前后大肠杆菌菌液的荧光信号强度。280 nm激发光得到的大肠杆菌荧光光谱图如图1(a)所示,很明显看到在330 nm处有一个单一的荧光峰。经文献查阅可知,苯丙氨酸的发射峰在280 nm附近,酪氨酸和色氨酸的发射峰分别在300 nm和350 nm附近。可以看出,大肠杆菌在336 nm附近出现的荧光峰是由酪氨酸和色氨酸叠加而形成的[10],而且灭活前后菌液的荧光信号强度并没有明显的变化。图1(b)是在405 nm激发下菌液的荧光光谱图,大肠杆菌在470 nm处出现发射峰,整体荧光强度比较低,灭活后菌液的荧光信号低于灭活前,但并没有完全消失。
同时,将灭活前后的大肠杆菌菌液分别经过雾化后形成大肠杆菌气溶胶,图1(c)为大肠杆菌菌液雾化后,颗粒物传感器和生物气溶胶监测仪的检测结果。可以看出颗粒物传感器检测两者的浓度之间没有明显的差别;使用生物气溶胶监测仪,灭活之后检测到的荧光个数稍低于灭活前的个数,这与荧光分光光度计的结果相一致。
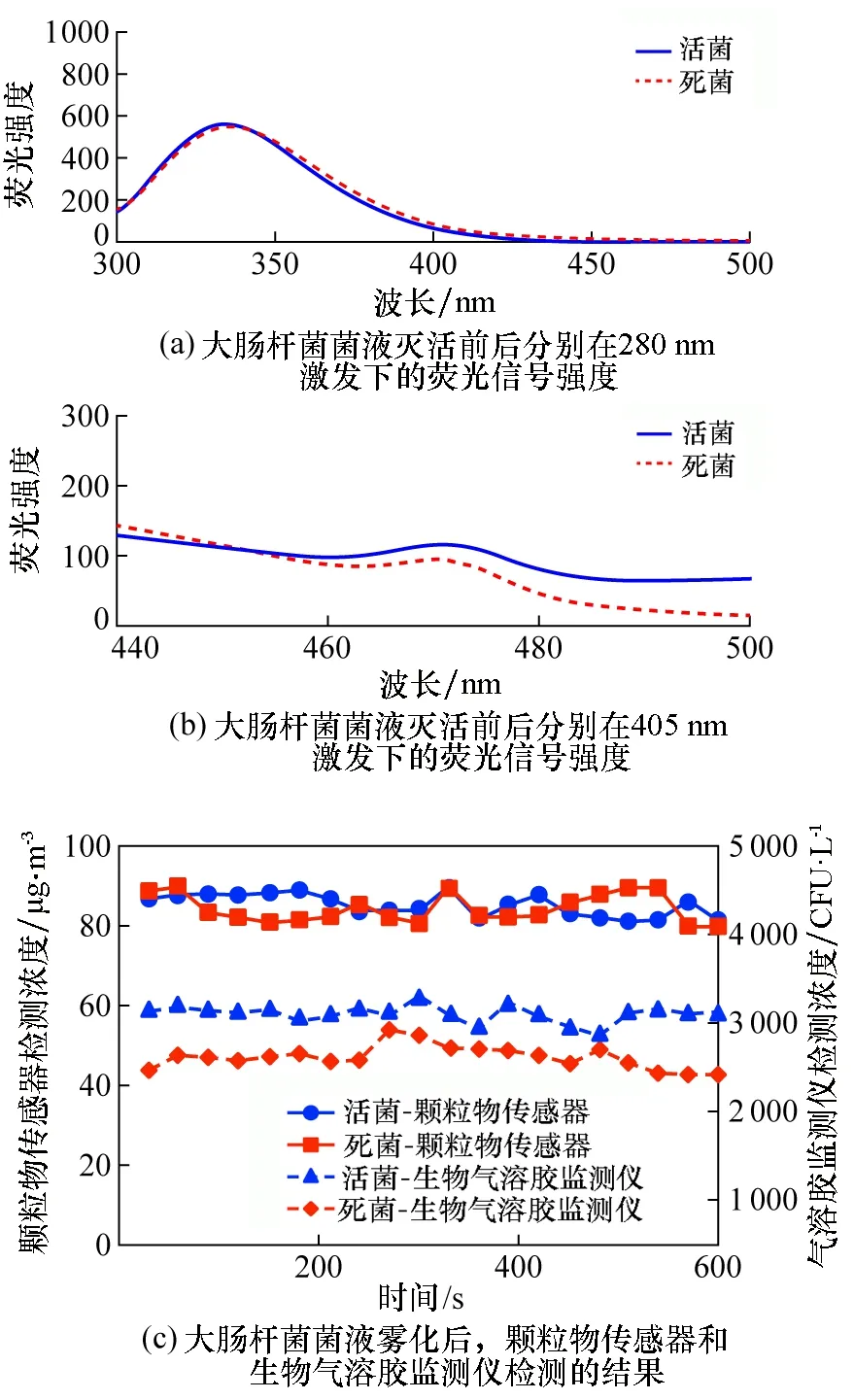
图1 不同状态的细菌对监测仪读数的影响
这表明生物气溶胶监测仪对死细菌和活细菌有相似的响应,并不能识别死细菌和活细菌,所以监测仪测量的是气溶胶的总细菌浓度(包括具有类似荧光性质而无生命特征的颗粒物)。
目前菌落计数法作为重要的指示微生物的培养方法,广泛用于生物防护和灭菌效果评价[11~13],“GB/T 38517-2020颗粒 生物气溶胶采样和分析 通则”采用菌落计数法进行观察计数,“JJF 1826-2020空气微生物采样器校准规范”利用菌落计数的方法评价空气中细菌的浓度,即菌落计数法作为一种传统方法[14,15],广泛用于空气气溶胶中细菌浓度的检测;但是它得到的是活细菌的浓度,当活细菌浓度和总细菌浓度差别较大时,该方法将不适用于气溶胶监测仪的校准。
3.2 细菌存活比例的研究
为了准确定量测量气溶胶中细菌总个数,采用准确度更高的荧光定量PCR技术,该技术基于扩增反应中荧光能量的传递,检测每一次循环产物的荧光信号,从而对DNA模板的起始浓度进行定量,灵敏性和特异性高,广泛用于临床病原菌诊断和基因差异表达分析等生命科学领域[16]。qPCR基于样品中DNA的浓度,因此检测到的是总的细菌浓度,菌落计数法检测的是可培养的细菌浓度。利用BioSampler采集雾化舱中的微生物气溶胶,并对通过qPCR、菌落计数法得到的气溶胶浓度与生物监测仪的检测结果进行数值比对。
图2(a)为qPCR、菌落计数法和生物气溶胶监测仪检测结果的比对。可以看出,对于金黄色葡萄球菌和大肠杆菌这两种细菌,qPCR检测的生物气溶胶浓度远远高于菌落计数法和监测仪的检测结果,达到8.8×105CFU/L和5.5×105CFU/L;菌落计数法检测的浓度只有6.3×104CFU/L和1.2×104CFU/L。图2(b)给出了可培养细菌和总细菌的比值,可以看出可培养的细菌浓度与总细菌浓度的比值只有7.1%和2.8%,这可能是因为BioSampler在采样过程中,由于冲击式分离的作用,产生的冲击力会对压力敏感的金黄色葡萄球菌和大肠杆菌产生影响,破坏菌体结构,从而影响其可培养性,导致生物效率相对较低。之前也有文献报道,冲击式采样器由于颗粒弹跳和再气溶胶化或采样器内部表面的颗粒损失可能会超过50%[17]。由于生物气溶胶监测仪没有办法判定细菌的状态,而厂家出厂时一般以菌落计数法作为校准方法,导致监测仪检测结果更接近于菌落计数法得到的浓度,远远低于qPCR的结果。
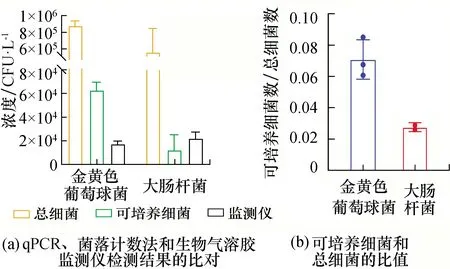
图2 不同生物检测方法的比较
3.3 采样前后SEM图研究
细菌形态的变化是生存状态的一个重要指标,本实验采用扫描电子显微镜表征采样器采集前后细菌形态的变化[18]。如图3所示,大肠杆菌和金黄色葡萄球菌在采集前,细菌表面光滑完整;而采集后,一部分细胞表面开始发生变形,出现褶皱,外层破损。上述结果进一步解释了采集后可培养的细菌数远远低于总细菌数的原因。
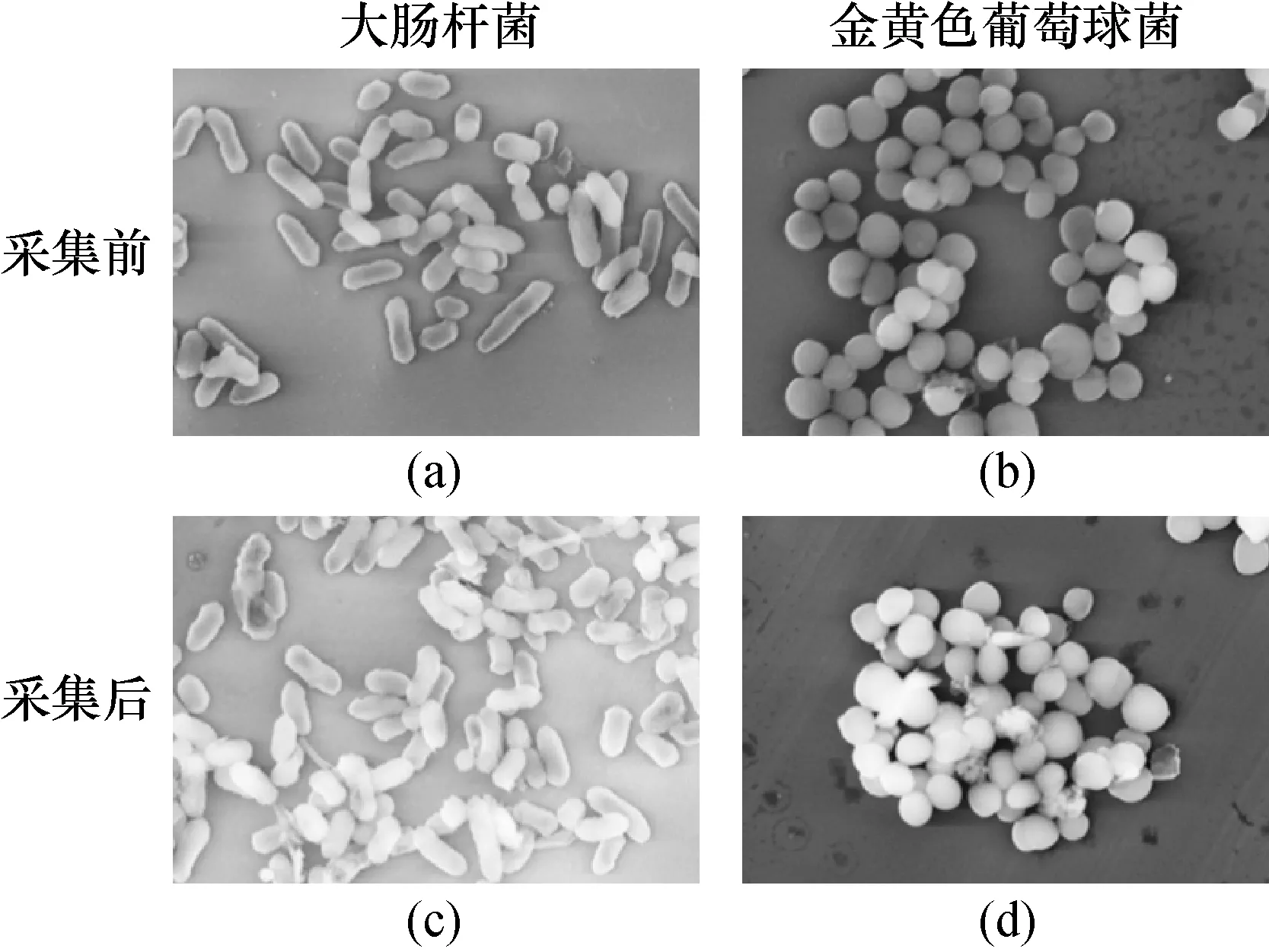
图3 大肠杆菌和金黄色葡萄球菌采集前(a和b)和采样后(c和d)对比的扫描电镜图
3.4 采样前后荧光显微镜研究
为了进一步验证采集前后大肠杆菌和金黄色葡萄球菌状态的变化,通过荧光实验来评价细胞的存活情况。其中绿色荧光SYTO9可以进入完整的细胞,而PI只能进入受损的细胞中。因此,成活的细胞发绿色荧光,而破损死亡的细菌发红色荧光,根据绿色和红色荧光比例的变化,可以评价采样前后细菌的存活情况。如图4所示,采集前细菌主要呈现的是绿色荧光,说明以成活细菌为主。而采集后,大肠杆菌的状态更多的是介于存活和死亡之间,颜色呈黄色;金黄色葡萄球菌以死亡为主,主要呈现红色。实验的结果与SEM图保持一致,进一步表明采集后细菌存活状态发生改变,导致很大一部分由于破损死亡而无法进行培养。

图4 大肠杆菌和金黄色葡萄球菌采集前(a和b)和采样后(c和d)对比的荧光显微图
4 结 论
研究发现,生物气溶胶采样过程中由于力的冲击可能会破坏细菌结构,从而影响其可培养性,导致生物效率相对较低,体现为菌落计数法得到结果远小于qPCR的测量结果。通过比对大肠杆菌和金黄色葡萄球菌采样前后扫描电镜外观图和荧光显微图的变化,发现采样后有细胞壁破裂,表明细菌受损的红色荧光比例增加,采样后有细菌发生受损死亡。生物气溶胶监测仪采用405 nm激光激发生物颗粒物产生荧光进行检测,但不能区分细菌的存活状态,测量的是气溶胶的总细菌数,而非活的细菌数。因此实时定量PCR相较于菌落计数法更适用于生物气溶胶监测仪的校准。
