维格列汀对绝经后女性2型糖尿病患者骨骼的影响
2022-03-09刘俊英徐福建李春华朱慧静
刘俊英 徐福建 李春华 朱慧静
随着我国人口老龄化趋势的加剧与生活方式的改变,2型糖尿病(type 2 diabetes mellitus, T2DM)和骨质疏松症(osteoporosis, OP)的患病率迅猛增加,且相互并存,已成为危害人类健康的重大公共卫生问题。T2DM合并OP的比例高达40%,尤其是绝经后女性,该比例甚至超过60%[1],故有效控制血糖的同时,预防OP、降低骨折风险具有重要意义。近年来,降糖药物除了关注其降糖效果外,有关其对骨代谢的影响逐渐引起研究者的重视。
二肽基肽酶-4(dipeptidyl peptidase-4, DPP-4)抑制剂主要通过抑制DPP-4活性,减少胰高血糖素样肽1(glucagon-like peptide 1, GLP-1)和抑胃肽(gastric inhibitory polypeptide, GIP)在体内的失活,使内源性GLP-1水平升高,从而促进葡萄糖依赖性的胰岛素分泌,抑制胰高血糖素的分泌,参与对机体血糖稳态的调节[2]。维格列汀属于高效选择性DPP-4抑制剂,在T2DM治疗中的应用越来越广,但其对糖尿病患者骨代谢的影响尚不明确,且存在争议。本研究就维格列汀对绝经后女性T2DM合并OP患者骨密度(BMD)和骨代谢指标的影响进行分析。现报道如下。
1 资料与方法
1.1 一般资料
选取2018年3月至2019年6月于菏泽市立医院内分泌科住院的绝经后女性T2DM合并OP患者60例作为研究对象,按照随机数字表法分为对照组与观察组,每组30例。对照组患者年龄(51.0±3.6)岁,平均T2DM病程(21.1±2.8)年;观察组患者年龄(51.1±3.2)岁,平均T2DM病程(20.5±2.6)年。两组患者年龄、T2DM病程比较,差异无统计学意义(P>0.05)。具有可比性。
纳入标准:糖尿病的诊断采用1999年世界卫生组织(WHO)的糖尿病诊断标准,骨质疏松的诊断采用1998年WHO的骨质疏松诊断标准;签署了知情同意书。排除标准:1)入组前半年服用双胍类、噻唑烷二酮类、α-糖苷酶抑制剂、DPP-4抑制剂;2)服用维生素D、抗骨质疏松药物、糖皮质激素、免疫抑制剂或利尿剂等影响骨代谢的药物;3)近半年内有脆性骨折史或持续卧床3个月以上;4)糖尿病合并急性并发症或严重心脑血管、肝、肾、肺部疾病及血液系统疾病、恶性肿瘤等;5)影响骨代谢疾病如甲状腺疾病、甲状旁腺疾病、皮质醇增多症以及自身免疫性疾病等;6)过度饮酒或吸烟;7)对研究药物过敏。
退出标准:1)治疗3个月后,二甲双胍加至最大剂量2 g/d,空腹血糖(FBG)>7.0 mmol/L,餐后2 h血糖(2hPBG)>10 mmol/L,糖化血红蛋白(HbA1c)>7.0%;2)二甲双胍、维格列汀减至最小维持剂量(二甲双胍0.5 g/d、维格列汀50 mg/d)仍出现低血糖;3)出现药物不良反应,患者不能耐受。
1.2 治疗方法
两组患者给予糖尿病饮食控制及运动指导。对照组仅给予二甲双胍(中美上海施贵宝制药有限公司,AAU9964)治疗;观察组给予二甲双胍联合维格列汀(山德士(中国)制药有限公司,BX384)治疗。二甲双胍初始剂量为1 g/d;维格列汀初始剂量为100 mg/d。根据患者的血糖及对药物的耐受情况,每2周调整药物剂量,直至达到《中国2型糖尿病防治指南(2017年版)》[3]推荐的血糖控制目标:3个月内FBG<7.0 mmol/L、2hPBG<10.0 mmol/L,6个月内HbA1c<7.0%,即可进行维持治疗。两组治疗随访48周。
1.3 观察指标
记录患者的年龄、T2DM病程,测量身高、体重并计算体重指数(BMI)。研究对象分别于治疗前及治疗随访48周后,测定相关生化指标。血糖指标:抽取静脉血,采用葡萄糖氧化酶法测定FBG、2hPBG,由日立7600全自动生化分析仪完成;采用高效液相色谱法检测HbA1c,由美国Bio-Rad VariantⅡ糖化血红蛋白检测仪完成;骨代谢指标:用罗氏电化学发光法检测血清骨钙素(OC)、Ⅰ型前胶原N端前肽(P1NP)、Ⅰ型胶原交联羧基端肽(CTX)、25-羟基维生素D(25(OH)VD)、甲状旁腺激素(PTH),由罗氏e411化学发光仪完成;BMD:采用美国GE-LUNAR公司的双能X线骨密度仪测定腰椎(L1-4)、股骨颈和全髋部的BMD,单位以g/cm2表示。
1.4 统计学分析
采用SPSS 22.0统计软件进行数据分析,计量资料以±s表示,两组间比较采用LSD-t检验,组内治疗前后比较采用配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组BMI、FBG、2hPBG、HbA1c比较
两组患者治疗前BMI、FBG、2hPBG、HbA1c比较差异无统计学意义(P>0.05);治疗后,两组患者BMI、FBG、2hPBG、HbA1c降低,且观察组2 h PBG低于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组患者BMI、FBG、2hPBG、HbA1c比较(±s)
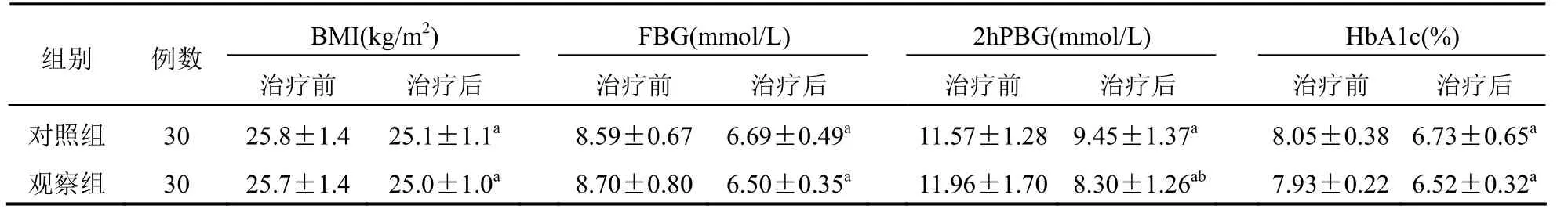
表1 两组患者BMI、FBG、2hPBG、HbA1c比较(±s)
注:与本组治疗前比较,aP<0.05;与对照组治疗后比较,bP<0.05
BMI(kg/m2) FBG(mmol/L) 2hPBG(mmol/L) HbA1c(%)组别 例数治疗前 治疗后治疗前 治疗后 治疗前 治疗后治疗前 治疗后对照组 30 25.8±1.4 25.1±1.1a 8.59±0.67 6.69±0.49a 11.57±1.28 9.45±1.37a 8.05±0.38 6.73±0.65a观察组 30 25.7±1.4 25.0±1.0a 8.70±0.80 6.50±0.35a 11.96±1.70 8.30±1.26ab 7.93±0.22 6.52±0.32a
2.2 两组腰椎(L1-4)、股骨颈、全髋部BMD比较
两组患者治疗前腰椎(L1-4)、股骨颈、全髋部BMD比较差异无统计学意义(P>0.05);观察组治疗后腰椎(L1-4)BMD高于治疗前,差异有统计学意义(P<0.05);两组患者治疗后全髋部BMD升高,差异有统计学意义(P<0.05);但两组患者治疗前后股骨颈BMD比较差异无统计学意义(P>0.05)。见表2。
表2 两组患者腰椎(L1-4)、股骨颈、全髋部BMD比较(g/cm2,±s)
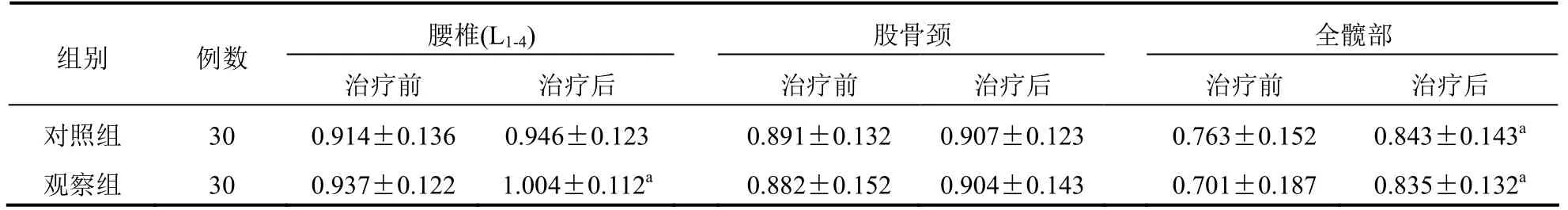
表2 两组患者腰椎(L1-4)、股骨颈、全髋部BMD比较(g/cm2,±s)
注:与本组治疗前比较,aP<0.05
腰椎(L1-4) 股骨颈 全髋部组别 例数治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 30 0.914±0.136 0.946±0.123 0.891±0.132 0.907±0.123 0.763±0.152 0.843±0.143a观察组 30 0.937±0.122 1.004±0.112a 0.882±0.152 0.904±0.143 0.701±0.187 0.835±0.132a
2.3 两组OC、P1NP、CTX、PTH、25(OH)VD比较
两组患者治疗前OC、P1NP、CTX、PTH、25(OH)VD比较,差异无统计学意义(P>0.05);与治疗前比较,两组患者治疗后OC、25(OH)VD水平升高,且观察组高于对照组,差异有统计学意义(P<0.05);治疗后,观察组CTX、PTH低于治疗前,且低于对照组,差异有统计学意义(P<0.05),但对照组治疗前后比较差异无统计学意义(P>0.05);两组治疗前后P1NP比较差异无统计学意义(P>0.05)。见表3。
表3 两组患者OC、P1NP、CTX、PTH、25(OH)VD比较(±s)
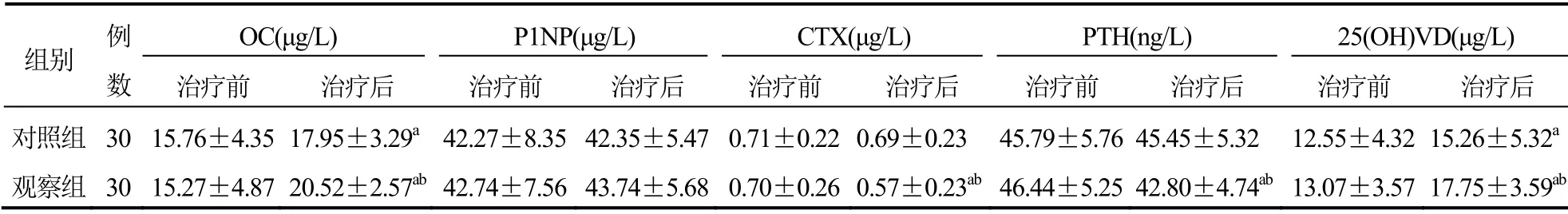
表3 两组患者OC、P1NP、CTX、PTH、25(OH)VD比较(±s)
注:与本组治疗前比较,aP<0.05;与对照组治疗后比较,bP<0.05
OC(μg/L) P1NP(μg/L) CTX(μg/L) PTH(ng/L) 25(OH)VD(μg/L)组别 例数 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 30 15.76±4.35 17.95±3.29a 42.27±8.35 42.35±5.47 0.71±0.220.69±0.23 45.79±5.7645.45±5.32 12.55±4.3215.26±5.32a观察组 30 15.27±4.87 20.52±2.57ab 42.74±7.56 43.74±5.68 0.70±0.260.57±0.23ab46.44±5.2542.80±4.74ab 13.07±3.5717.75±3.59ab
2.4 两组用药安全性比较
两组患者治疗期间出现恶心、腹胀6例,但随时间延长逐渐减轻并能耐受。
3 讨论
T2DM是以胰岛素抵抗为主伴胰岛素分泌不足,到以胰岛素分泌不足为主伴胰岛素抵抗所致血糖升高为特征的临床综合征,占糖尿病总体人群的95%以上。OP是由于多种原因导致的骨强度下降和骨折风险增加为特征的全身性骨病,好发于围绝经期女性,是一种较为常见的代谢相关性疾病,也是T2DM的常见并发症之一[4]。糖尿病性OP的发病机制可能与高血糖、胰岛素缺乏、激素水平异常等因素有关。1)T2DM基于其自身的高血糖状态引发的渗透性利尿作用,被认为是影响患者骨代谢的因素之一。它可进一步通过影响钙磷代谢引起继发性甲状旁腺功能亢进,引起患者体内甲状腺激素水平增加造成骨质脱钙,BMD降低,参与OP、骨折的发生。2)机体长期慢性高血糖刺激还可引起微循环障碍,骨微结构和骨组织材料特性的继发缺陷,骨折风险明显增加[5-7]。3)T2DM患者随着病程的延长,胰岛功能逐渐恶化,胰岛素分泌缺乏,成骨细胞骨基质成熟和转换减少,而破骨细胞分解增加[8]。4)绝经后女性雌激素水平明显降低,是OP发生的高危因素[9]。
维格列汀为新型选择性DPP-4抑制剂,已广泛应用于T2DM的临床治疗,可通过促进胰岛β细胞分泌胰岛素,抑制胰岛α细胞分泌胰升血糖素降低血糖,这种作用具有葡萄糖依赖性,不易诱发低血糖;同时研究发现,其还能降低食欲,减少食物摄入,延迟胃排空利于餐后血糖的控制[10],在本研究中也发现,与单纯应用二甲双胍比较,联合应用维格列汀对餐后血糖的控制更佳。
在关注降糖效果的同时,也应关注DPP-4抑制剂对患者骨骼的影响[11-12]。Zheng等[13]对我国744例绝经后女性进行的一项横断面研究显示,DPP-4活性最高的一组患者腰椎和股骨颈的BMD最低,差异有统计学意义;Kim等[14]在肥胖女性中进行的另一项研究也表明,DPP-4活性与脊柱BMD负相关(r=-0.288,P=0.038),提示使用DPP-4抑制剂可能会改善BMD。另有研究显示,与二甲双胍单一疗法比较,DPP-4抑制剂与二甲双胍联合使用可显著降低T2DM患者发生骨折的风险[15]。在本研究中,联合应用二甲双胍和维格列汀可以显著改善患者全髋部和腰椎的BMD,维格列汀有潜在的骨骼保护效应。
但目前有关维格列汀对糖尿病患者骨代谢的影响尚无定论。研究显示,在绝经后女性中,血清DPP-4活性与PTH水平正相关[14];本研究在使用维格列汀也观察到了PTH的下降,推测DPP-4抑制剂可以降低PTH水平,抑制钙从骨骼释放到血液中并减少骨骼破坏。另外,在使用维格列汀组还观察到了25(OH)VD的升高,众所周知,维生素D及其代谢产物可以调节血清钙和磷酸盐水平,促进骨骼的生长和重塑[16]。本研究显示,联合应用二甲双胍和维格列汀可使骨形成标志物OC明显升高,骨吸收标志物CTX明显下降,具有促进骨形成、抑制骨吸收的作用。
分析其潜在机制可能为:1)在糖尿病患者中,胰岛素缺乏和高血糖在骨形成的减少中起一定作用[17],DPP-4抑制剂可以促进胰腺β细胞分泌胰岛素,改善糖耐量,从而降低高血糖对骨骼的负面影响[18]。2)DPP-4抑制剂可直接通过抑制DPP-4底物GIP和GLP-1的降解,增加骨形成,减少骨吸收,引起骨折发生的减少[11]。3)研究发现,DPP-4抑制剂还可通过影响能量代谢,减少脂联素受体的表达,抑制Ghrelin的分泌,促进骨形成和减少骨吸收[19]。但也有研究发现使用维格列汀对骨形成和骨吸收标志物无影响[20],分析原因可能与研究人群及样本量有关,在今后的研究中仍有待扩大样本量以进一步验证。
综上所述,针对T2DM合并OP患者在使用二甲双胍的基础上联合应用维格列汀,可有效维持血糖稳定,并且对骨骼有潜在的保护作用,能促进骨形成,抑制骨吸收,改善维生素D的平衡,进而提高患者的BMD,降低骨折风险。
