基于代谢组学探讨参麦注射液干预高血压心衰大鼠的生物学机制❋
2022-03-08钟森杰胡思远黄淑敏胡志希
钟森杰, 李 静, 胡思远, 黄淑敏, 杨 梦, 李 琳, 胡志希
(湖南中医药大学中医诊断研究所, 长沙 410208)
Dahl盐敏感大鼠是研究高血压心衰的理想材料,在生长过程中只需给予高盐饮食,即可很好地模拟高血压病演变为心衰的病理过程。本课题组前期多次成功制备高血压心衰模型,比对分析不同中药注射液的治疗效果,结果发现参麦注射液能有效优化该模型的多项心功能指标,改善心肌结构损伤,展现出多靶点、多效应的干预机制[1]。在此基础上以系统生物学为切入点,观察参麦注射液对高血压心衰大鼠内源性代谢产物的影响,证实药物干预机制涉及调节氨基酸代谢、糖代谢、能量代谢、氧化应激等多个层面,从而促使代谢功能趋于正常化[2,3]。鉴于单一的检测分析技术及样本类型并不能反映整体生物学信息,因此本研究进一步运用高通量的液相色谱-质谱联用(liquid chromatography mass spectrometry, LC-MS)技术,观察参麦注射液对高血压心衰大鼠血清代谢产物及相关代谢路径的调节趋势,从生物学角度阐明疾病的治疗靶点,以期为临床治疗提供实验依据。该研究已通过湖南中医药大学实验动物伦理委员会审查,伦理号LL20190902402。
1 材料
1.1 动物
24只雄性Dahl盐敏感大鼠,6周龄,体质量(220±10)g,购自维通利华(北京)实验动物技术有限公司,实验动物许可证号SCXK(京)2016-0011。饲养于湖南中医药大学动物实验中心SPF级实验室,温度20~25 ℃,湿度:40%~60%,光照/黑暗12 h周期循环。大鼠饲料购自北京科澳协力饲料有限公司,质量合格证号1112621900016339。
1.2 药物与试剂
甲醇(纯度≥99.0%)、乙腈(纯度≥99.9%),货号分别为A456-4、A955-4,美国Thermo科技公司;2-氯苯丙氨酸(纯度98.5%),货号C105993,阿拉丁试剂(上海)有限公司;甲酸(纯度:LC-MS级),货号F0654,梯希爱(上海)化成工业有限公司;参麦注射液,规格:50 mL/瓶,国药准字:Z33020019,批号1909288,正大青春宝药业有限公司。
1.3 仪器
Vanquish型液相色谱仪、Q Exactive Focus型质谱仪,美国Thermo科技公司;SonoScape-S2N型彩超仪,深圳开立科技公司;QL-866型混匀仪,美国Vortex Mixer公司;5305型真空浓缩仪,德国Eppendorf公司;CODA型无创血压仪,美国Kent Scientific公司。
2 方法
2.1 模型制备
模型制备方法依据课题组前期文献[1-3]。24只大鼠按随机数字表法分为正常组8只与造模组16只。正常组给予常规鼠料(含0.3% Nacl)喂养,造模组给予高盐鼠料(含8% Nacl)喂养,每只每天的饮食量控制为20 g,不限量饮水共20周。模型制备期间,每4周测量1次鼠尾血压。模型制备结束后,对所有大鼠行心脏彩超,计算左室射血分数(left ventricular ejection fraction, LVEF)与左室短轴缩短率(fraction shortening, FS),并眼眶取血以测定血清中氨基末端脑钠肽前体(N terminal pro B type natriuretic peptide, NT-proBNP)浓度。以收缩压>140 mmHg、LVEF与FS显著下降、NT-proBNP显著上升作为高血压心衰的评价依据。
2.2 药物干预
模型制备成功大鼠16只随机分为模型组和参麦注射液组各8只。参麦注射液的干预方式依据课题组前期文献[1,2],单次剂量为6.0 mL/kg,每天1次腹腔注射,共干预15 d。模型组注射相同剂量的灭菌用水。给药结束后再次行心脏彩超并测定血清NT-proBNP浓度。
2.3 样本采集与预处理
药物干预后麻醉大鼠,打开腹腔腹主动脉取血。取血清200 μL用于测定NT-proBNP浓度,剩余血清于-80 ℃冰箱中保存。上机分析前将血清置于4 ℃环境中融化,每样本提取100 μL,加入400 μL甲醇振荡混匀,取上清液真空浓缩干燥,150 μL 2-氯苯丙氨酸(4ppm)经80%甲醇溶液复溶,上清液经0.22 μm膜过滤,得到待测样本进行上机分析。
2.4 LC-MS分析条件
色谱条件:色谱柱为 ACQUITY UPLC HSS T3 1.8 μm(2.1×150 mm),柱温设置为40 ℃,以0.25 mL/min流速进样,进样2 μL进行梯度洗脱。流动相:正离子0.1%甲酸水(B2)- 0.1%甲酸乙腈(A2);负离子甲酸铵水(B1)-乙腈(A1)。质谱条件:采用电喷雾离子源(ESI),正负离子电离模式,正离子电压3.50 kv,负离子电压2.50 kv;以分辨率70000进行全扫描并进行二级裂解。
2.5 数据预处理
运用Proteowizard软件(v3.0.8789)将上机分析所得的原始数据转换成mzXML格式,通过R(v3.3.2)的XCMS程序包进行峰处理。获得数据矩阵,包括峰面积、质核比、保留时间等内容,以excel表形式导出进行后续的统计学分析。为比较不同量级的数据,进行峰面积的归一化处理。
2.6 统计学方法
代谢轮廓分析与差异代谢产物鉴定采用SIMCA-P(v13.0)软件包和R语言ropls包,对数据矩阵进行主成分分析(principal component analysis, PCA)和正交-偏最小二乘判别分析(orthogonal partial least squares discriminant analysis, OPLS-DA),绘制正、负离子模式下的得分图。差异代谢产物鉴定基于OPLS-DA的变量重要性值投影(variable important in projection, VIP),纳入VIP>1.2的代谢产物,并进行统计分析以验证差异是否有统计学意义。比对策略:模型组vs正常组、模型组vs参麦注射液组,以模型组紊乱的代谢产物为潜在靶标,观察参麦注射液组的回调情况,最终纳入2组比对策略的共有差异代谢产物。代谢路径拓扑分析采用MetaboAnalyst 4.0在线分析平台,以RawP<0.05且Impact>0为筛选条件,纳入显著代谢路径。
3 结果
3.1 心功能指标检测结果
药物干预后检测各项心功能指标以评价疗效。与正常组比较,模型组的LVEF与FS值降低,NT-proBNP值上升,差异有统计学意义(P<0.01),确定已成射血分数保留的高血压心衰模型;与模型组比较,参麦注射液组的LVEF与FS值上升,NT-proBNP值降低,差异有统计学意义(P<0.01)。
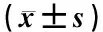
表1 3组大鼠LVEF、FS和NT-proBNP比较
3.2 PCA分析
PCA模型反映代谢组数据的原始状态,可直观观察样本的离散与聚集程度。图1示,各组间的正、负离子PCA得分图,大部分样本的代谢成分积分点均处于置信区间内,各组在空间分布上明显分开,呈左右或上下对称趋势,组间分离趋势较好。
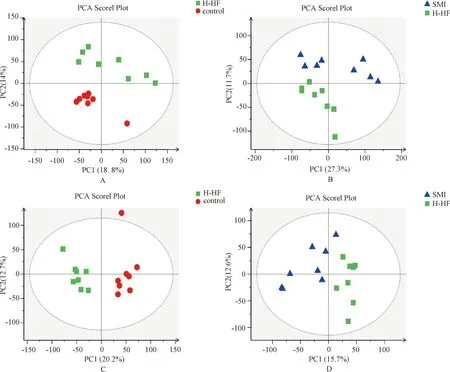
3.3 OPLS-DA分析
OPLS-DA为有监督的分析方法,能有效降低模型复杂性与提升模型解释强度,从而直观地观察各组间的代谢轮廓差异。图2示, 各组间的正、负离子OPLS-DA得分图,所有样本的代谢成分积分点均处于置信区间内,各组样本点在空间分布上呈左右对称分离趋势,组间无交互重叠,分离程度良好,提示组间存在显著的代谢轮廓差异。
注:A.模型组与正常组的正离子PCA得分图;B.模型组与参麦注射液组的正离子PCA得分图;C.模型组与正常组的负离子PCA得分图;D.模型组与参麦注射液组的负离子PCA得分图。“Control”为正常组,“H-HF”为模型组,“SMI”为参麦注射液组图1 正负离子模式的PCA得分图
注:A.模型组与正常组的正离子OPLS-DA得分图;B.模型组与参麦注射液组的正离子OPLS-DA得分图;C.模型组与正常组的负离子OPLS-DA得分图;D.模型组与参麦注射液组的负离子OPLS-DA得分图。“Control”为正常组,“H-HF”为模型组,“SMI”为参麦注射液组图2 正负离子模式的OPLS-DA得分图
3.4 差异代谢产物
表2示,以VIP>1.2且P<0.05为条件,筛选正常组与模型组间的差异代谢产物,并作为可能的药物靶标,观察药物治疗后的变化趋势。经参麦注射液干预后,四氢嘧啶、谷氨酸、腺嘌呤、异柠檬酸、乙酰乙酸、尸胺、12,13-二氢乳清酸的表达水平向正常方向回调,差异有统计学意义(P<0.05);牛磺酸、磷酸羟基丙酮酸、尿酸、缬氨酸、脯氨酸、甘氨鹅脱氧胆酸、脱氧胞苷、瓜氨酸、硬脂酸、棕榈酸的表达水平呈回调趋势。
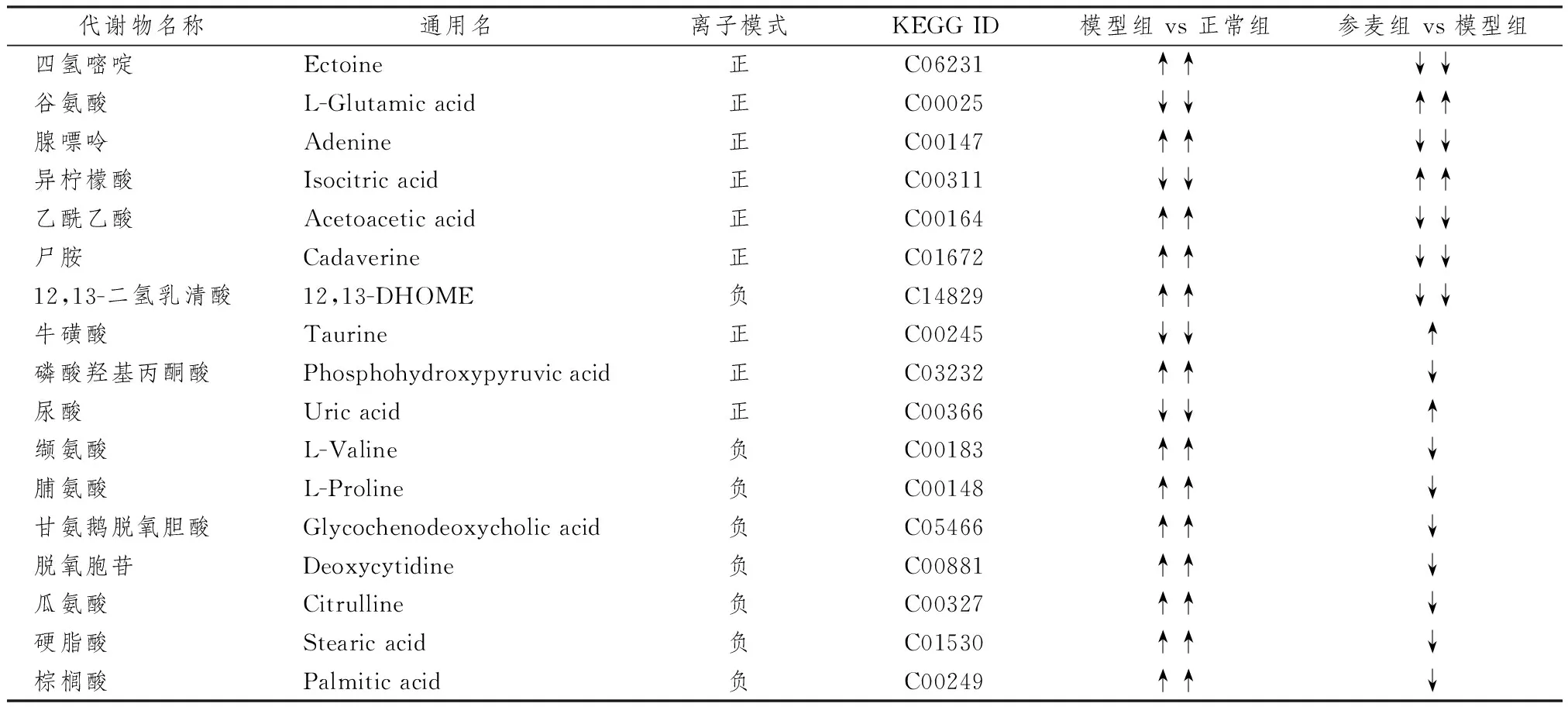
表2 差异代谢产物信息比较
3.5 代谢通路分析
表2图3示,代谢通路分析结果显示,参麦注射液干预后显著回调的7种代谢产物共涉及16条代谢路径。以RawP<0.05且Impact>0为条件,纳入4条代谢路径,视为参麦注射液干预后的显著代谢路径。显著代谢路径为:丁酸代谢(Butanoate metabolism),酮体的合成与降解(Synthesis and degradation of ketone bodies),D-谷氨酰胺和D-谷氨酸代谢(D-Glutamine and D-glutamate metabolism),谷胱甘肽代谢(Glutathione metabolism)。
4 讨论
心脏是高耗能器官,心肌细胞必须不断产生能量方可维持泵血与舒缩功能。正常生理条件下,心脏可利用多种底物产能以供给能量,其中脂肪酸是主要的能量来源底物。在心衰的病理过程中,心脏产能底物由脂肪酸向葡萄糖、氨基酸等物质转移,氨基酸代谢增强以维持能量供给,因此可见模型大鼠的谷氨酸、脯氨酸、瓜氨酸等多种氨基酸物质水平紊乱[4,5]。另有研究证据显示,酮体、支链氨基酸是心衰中晚阶段的替代产能底物,故缬氨酸、酮体代谢路径亦呈异常表达[6]。产能底物转移是衰竭心脏的典型代谢表征,但底物变化并不能满足心衰时的能量需求,并将致使心脏能量代谢障碍,逐步恶化心功能和促进心肌重构进展,故底物利用的正常化是心衰治疗的重要目标[7]。
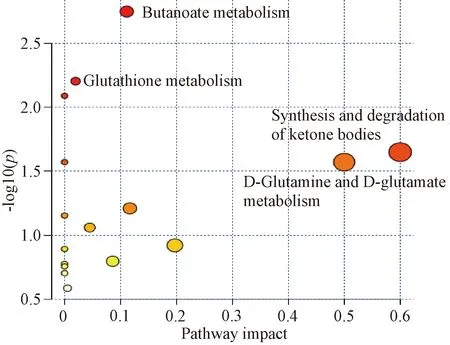
图3 代谢通路概要图

表3 显著代谢通路比较
谷氨酸、尸胺参与谷胱甘肽代谢通路,其中谷氨酸为谷胱甘肽的合成底物,谷氨酸的低水平表达将影响谷胱甘肽合成,而谷胱甘肽含量降低则是细胞凋亡的早期激活信号[8]。谷胱甘肽为细胞内关键的调节性代谢物质和抗氧化剂,一方面通过激活多种酶活性以调控糖类、蛋白质代谢,并参与三羧酸(tricarboxylic acid,TCA)循环,维持能量代谢;另一方面,谷胱甘肽可清除心肌中的氧自由基,缓解自由基对心脏等靶器官的损伤[9]。谷氨酸参与D-谷氨酰胺和D-谷氨酸代谢通路,谷氨酰胺是促进蛋白质合成利用的重要物质,同时参与谷胱甘肽合成,通过补充机体的谷胱甘肽储备以提高抗氧化能力。本次研究结果显示,参麦注射液可显著改善氨基酸类产物的水平紊乱,从而改善能量代谢,增强心肌抗氧化损伤能力,其干预机制主要体现为对谷氨酸及其关联网络路径的调控。
酮体的合成与降解、丁酸代谢通路中均有乙酰乙酸参与。酮体是肝脏脂肪酸氧化分解生成的中间产物,亦是氧化不完全的丁酸产物,包含乙酰乙酸、β-羟丁酸、丙酮等3种物质。肝脏中含有多种合成酮体的酶系,即酮体合成主要源自肝脏功能,但肝脏并不能利用酮体[10]。乙酰乙酸可被转运出肝细胞质膜,经血液循环进入心脏等肝外组织,氧化后经TCA循环生成能量并被组织所利用[11]。心衰时心脏的脂肪酸、葡萄糖供能不足,此时乙酰乙酸成为重要的能量来源,故可见模型大鼠的酮体相关路径紊乱,以及乙酰乙酸呈高水平表达。在参麦注射液的干预作用下,心脏能量供应逐步恢复,乙酰乙酸水平回调。
异柠檬酸是柠檬酸通过乌头酸酶催化的可逆反应所生成的异构体,参与TCA循环,可经异柠檬酸脱氢酶产生a-酮戊二酸。TCA循环是生物体产能的主要途径,参与循环的中间物质显著下降,此路径的正常功能必然受抑制[12]。腺嘌呤为核酸和辅酶的重要组分,其与核糖、3个磷酸基团相连接而形成三磷酸腺苷(adenosine triphosphate,ATP),ATP则是生物体的直接能量来源[13]。上述2种物质紊乱是能量代谢障碍的标志,提示心肌组织的能量供应不足,而参麦注射液能有效优化能量代谢。
本次研究还纳入具有回调趋势的10种代谢产物,其中牛磺酸、缬氨酸、脯氨酸、瓜氨酸均属氨基酸类物质,硬脂酸、棕榈酸属脂肪酸类物质,均为油脂中的重要组分,2种物质的高表达水平提示模型大鼠体内出现脂质堆积[14];尿酸作为嘌呤代谢的终产物,是多种心血管疾病进展为心衰的独立预报因子,亦是心衰预后评价的标志物[15];磷酸羟基丙酮酸、甘氨鹅脱氧胆酸、脱氧胞苷3种物质的相关研究较少,其生物学功能尚未完全明确。经参麦注射液干预后,上述代谢产物表达水平均呈现不同程度的回调趋势,但差异无统计学意义,考虑可能与药物干预时间相关。这部分物质可被视为参麦注射液治疗高血压心衰的潜在靶点,值得更为深入的研究。
综上所述,在高血压诱导的慢性心衰病理过程中,心功能持续恶化,并伴随一系列生物学功能的改变,提示衰竭心脏的能量需求增加,能量合成利用能力受损伤,与前期研究结果存在共性[16-18]。本次研究在前期基础上进一步揭示参麦注射液治疗高血压心衰的作用机制,即改善氨基酸、酮体等产能底物紊乱,调控能量代谢相关路径,从而为衰竭心脏供给更多的能量,恢复心脏功能并延缓心衰进展,这也为心衰治疗提供了新靶点与新思路。
