荷斯坦牛血浆抗缪勒氏管激素浓度的影响因素分析及遗传参数估计
2022-03-08张海亮胡丽蓉赵善江张翰霖王雅春
万 涛,王 澳,张海亮,胡丽蓉,赵善江,张翰霖,王 炎,郭 刚,俞 英,王雅春*
(1. 中国农业大学动物科学技术学院,北京 100193; 2. 中国农业科学院北京畜牧兽医研究所,北京 100193; 3. 北京首农畜牧发展有限公司, 北京 100029)
抗缪勒氏管激素(anti-Müllerian hormone, AMH)是转化生长因子β(transforming growth factor-β, TGF-β)超家族中的一种糖蛋白,分子量为140 ku[1],半衰期为1.5 d[2]。奶牛的AMH特异性表达于健康卵泡的腔前卵泡和小的有腔卵泡的颗粒细胞中[3],在奶牛的自然发情周期内,AMH的表达在原始卵泡、初级卵泡和次级卵泡中达到高峰,当优势卵泡被选择后,AMH的表达开始降低,另外,闭锁卵泡中不存在AMH的表达[4]。在卵泡发育过程中,AMH可以通过降低卵泡对促卵泡素(follicle-stimulating hormone, FSH)的敏感性而抑制FSH对卵泡生长的刺激作用[5],调节卵泡的募集,避免过早耗尽卵泡储备[6]。Ireland等[7]研究表明,牛血浆AMH浓度与有腔卵泡数目(antral follicle count, AFC)高度正相关。因此,血浆AMH浓度通常可作为评估卵巢储备能力的一种可靠标志物[8]。
奶牛个体血浆AMH浓度在整个发情周期变化相对稳定,独立于卵泡发生波而存在,测定值有效期至少1年[4]。因此,使用奶牛发情周期内任意一个时期的血浆AMH浓度测定值进行表型分析均有一定参考价值[9]。部分研究表明,奶牛品种和胎次对血浆AMH浓度影响显著,而泌乳天数、奶牛分群情况、体况评分、产后周数及采样季节对血浆AMH浓度无显著影响[10-11]。加拿大和美国荷斯坦牛群体血浆AMH浓度估计遗传力分别为(0.46±0.31)[10]和(0.43±0.07)[12],属高遗传力。有研究指出,高浓度AMH的牛妊娠率较高,低浓度AMH的牛在妊娠后30~65 d的妊娠损失发生率较高,这表明泌乳奶牛血浆AMH浓度与繁殖指标呈正相关关系[11]。所以通过对奶牛群体中高浓度AMH个体的选择,可能能够提高奶牛群体的繁殖性能。
国内尚未见对奶牛群体血浆AMH浓度遗传规律的相关研究。因此,本研究利用奶牛血浆AMH浓度的测定数据,探究中国荷斯坦牛群体中血浆AMH浓度的影响因素,并估计该牛群血浆AMH浓度的遗传参数,为后续奶牛群体血浆AMH浓度遗传规律研究奠定基础。
1 材料与方法
1.1 数据来源
试验群体来自北京地区某规模化牛场,共398头中国荷斯坦泌乳牛。所有试验牛按照奶牛饲养标准[13]进行散栏饲喂,根据自然发情周期进行人工授精。奶牛生产性能测定(dairy herd improvement, DHI)数据来自北京奶牛生产性能测定中心,包括试验牛胎次、产犊日期、父号、母号,妊娠天数记录来自牛场管理软件。本研究中,试验牛的系谱来自中国奶业协会,用于遗传分析的最终系谱共包含915头牛,其中母牛787头,公牛128头。
1.2 血浆AMH浓度测定方法
使用一次性采血针和抗凝真空采血管分别于2019年7月24日(夏季)、2019年11月9日(秋季)和2020年1月5日(冬季)采集试验牛尾静脉血样10 mL共625份,其中夏季血样219份,秋季血样184份,冬季血样222份。每头牛平均采集1.5次血样,最多采集3次血样,最少采集1次血样。
血液采集完后,经离心(3 000 r·min-115 min)获得上层血浆。将获得的血浆送至北京莱博泰瑞科技发展有限公司(北京),采用ELISA酶免法测定血浆AMH浓度。
1.3 数据整理
在建立模型进行数据分析时,将泌乳天数划分为3个泌乳阶段,分别为泌乳早期(≤ 100 d)、泌乳中期(101~200 d)和泌乳后期(≥ 201 d)[14]。
将妊娠天数划分为3个妊娠阶段,分别为妊娠前期(≤ 120 d)、妊娠中期(121~210 d)和妊娠后期(≥ 211 d)[15]。由于妊娠后期观察数过少,将其与妊娠中期进行合并。并将奶牛未妊娠阶段(记为0 d) 归为一组。
由于血浆AMH浓度数据正态性检验的概率值小于0.05,不服从正态分布,因此对数据进行对数转换以近似满足正态分布,转换公式如下:
Y=lnX
式中,Y为转化后奶牛血浆AMH浓度的观测值,X为原始奶牛血浆AMH浓度的观测值。
1.4 统计分析
1.4.1 血浆AMH浓度影响因素分析 使用SAS 9.2软件MIXED过程对血浆AMH浓度的影响因素进行分析,多重比较采用Bonferronit检验,P<0.05表示差异显著,P<0.01表示差异极显著。
Yijklmn=μ+Seasoni+Parityj+PDk+DIMl+Cowm+eijklmn(模型1)

1.4.2 血浆AMH浓度遗传分析 基于DMU软件的DMUAI,采用单性状动物模型对AMH浓度进行遗传分析,估计AMH浓度的遗传参数,遗传分析模型如模型2所示。
Y=Season+PE+A+E(模型2)


1.4.3 血浆AMH浓度与繁殖性状的近似遗传相关 基于模型2估计获得奶牛血浆AMH浓度性状估计育种值,并匹配相同群体中繁殖性状的估计育种值及其可靠性,根据以下公式计算奶牛血浆AMH浓度与繁殖性状之间的近似遗传相关及其标准误。本研究涉及的繁殖性状包括初产日龄(age at the first calving, AFC)、初配日龄(age at the first service, AFS)、经产牛产犊难易性(calving ease in cow, CE_C)、青年牛产犊难易性(calving ease in heifer, CE_H)、产犊后首次配种间隔(interval from calving to the first service, ICF)、经产牛首末配种间隔(interval from the first to the last inseminations in cow, IFL_C)、青年牛首末配种间隔(interval from the first to the last inseminations in heifer, IFL_H)、经产牛死产率(stillbirth in cow, SB_C)和青年牛死产率(stillbirth in heifer, SB_H)等,上述性状的遗传评估模型和性状定义细节参照陈紫薇等[18]和Liu等[19]的研究。
其中,PEV为估计育种值的标准误,rgi,j表示性状i和性状j之间的近似遗传相关,RLi和RLj分别为性状i和性状j的估计育种值可靠性,ri,j为性状i和性状j估计育种值之间的皮尔逊相关系数,n为用于计算近似遗传相关的个体数。
2 结 果
2.1 血浆AMH浓度描述性统计
本研究中,625头荷斯坦牛的血浆AMH浓度呈右偏态分布,如图1所示,AMH浓度平均值为(96.30±14.25) ng·L-1,最大值为178.39 ng·L-1,最小值为57.06 ng·L-1,中位数为94.16 ng·L-1。
2.2 血浆AMH浓度影响因素分析
利用模型1分析各因素对奶牛血浆AMH浓度的影响,结果如图2所示。采样季节对血浆AMH浓度有极显著影响(P<0.01),其中夏季血浆AMH浓度显著高于秋季和冬季,秋季血浆AMH浓度显著高于冬季。胎次(P=0.45)、妊娠天数分组(P=0.52)以及泌乳天数分组(P=0.56)对血浆AMH浓度均无显著影响。
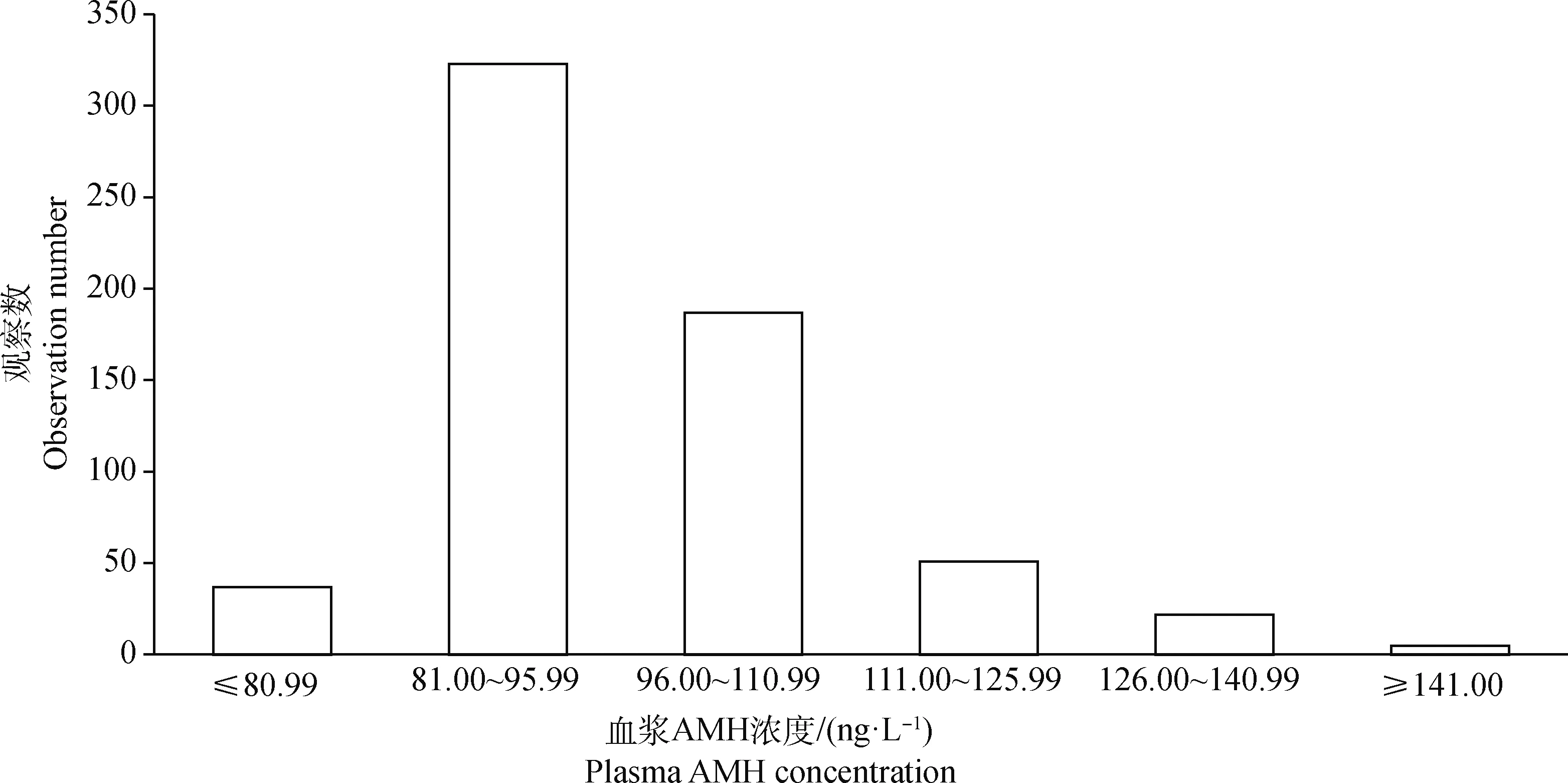
图1 荷斯坦牛血浆AMH浓度分布Fig.1 The distribution of plasma AMH concentration in Holstein cows
2.3 血浆AMH浓度的遗传参数估计
利用模型2估计荷斯坦牛血浆AMH浓度的方差组分,由表1可知,本研究荷斯坦牛群体血浆AMH浓度的遗传力估计值为(0.10±0.08),属于中等遗传力[16](0.1 本研究中,荷斯坦牛血浆AMH浓度与部分繁殖性状的近似遗传相关如图3所示。由图3可知,奶牛血浆AMH浓度与产犊后首次配种间隔、经产牛首末配种间隔、青年牛首末配种间隔、经产牛死产率和青年牛死产率呈中高遗传相关;奶牛血浆AMH浓度与青年牛首末配种间隔近似遗传相关最高,为(0.61±0.04);奶牛血浆AMH浓度与青年牛产犊难易性近似遗传相关最低,为(-0.05±0.05)。 本研究结果显示,荷斯坦牛血浆AMH浓度为96.30 ng·L-1,与其他同类研究的结果((320.3±251.1)ng·L-1[11],(438.50±604.33) ng·L-1[12])相比差异较大。值得注意的是,上述报道的奶牛血浆AMH浓度的标准差与变异系数较大[11-12],本研究所测定的血浆AMH浓度平均值处于上述研究的变异范围内。Ribeiro等[11]研究表明,荷斯坦牛群体(264 ng·L-1)与荷斯坦牛和娟珊牛的杂交品种群体(298 ng·L-1)的血浆AMH浓度差异显著,Batista等[23]的研究中,瘤牛(内洛尔牛,930 ng·L-1)与普通牛(荷斯坦牛,300 ng·L-1)间血浆AMH浓度差异更大,推测有可能是由于不同群体的遗传基础及养殖环境不同,造成中国荷斯坦牛群体与国外荷斯坦牛群体的血浆AMH浓度存在差异,可进一步扩大数据量进行试验,以研究奶牛血浆AMH浓度与群体遗传基础的关系。 本研究结果显示,奶牛群体血浆AMH夏季采样浓度最高,而在冬季浓度最低,这与Gobikrush-anth等[10]报道的采样季节对血浆AMH浓度无显著影响的结果不同,可能是由于Gobikrushanth等[10]研究中的牛场处于加拿大西部地区,夏季和冬季气温均低于北京地区,北京地区奶牛受热应激影响较大,并且两牛场牛舍管理不同,从而导致血浆AMH浓度差异较大。由于试验条件限制,本研究中荷斯坦牛胎次仅有1胎和2胎,两者的血浆AMH浓度无明显差异。部分研究[10-11]表明,奶牛胎次的二次方对血浆AMH浓度影响显著,其中奶牛2胎时血浆AMH浓度达到最高,1胎时血浆AMH浓度最低。因此,为了进一步分析胎次对中国荷斯坦牛血浆AMH浓度的影响,还需扩大数据量与试验群体的覆盖范围。 柱状图上方字母相异表示差异显著(P<0.05),含相同字母或无字母表示差异不显著(P>0.05)The different letters above the bar chart indicate significant differences(P<0.05), and same letter or no letter indicate no significant difference(P>0.05)图2 荷斯坦牛血浆AMH浓度的影响因素Fig.2 The influencing factors of plasma AMH concentration in Holstein cows 表1 荷斯坦牛血浆AMH浓度遗传参数估计 本研究通过遗传分析发现,中国荷斯坦牛血浆AMH浓度遗传力为(0.10±0.08),低于国外的一些研究报道(0.46±0.31[10],0.43±0.07[12]),这可能是由于不同群体的遗传基础不同和本研究的试验群体规模较小导致。此外,Gobikrushanth等[10]研究中所采集的样本是来自产后7 d左右的泌乳奶牛,Nawaz等[12]研究中所采集的样本是来自青年牛,而本研究的奶牛群体全部为泌乳期的奶牛,各研究中不同的测定时期也导致AMH浓度的遗传基础存在差异。值得注意的是,本研究发现血浆AMH浓度与部分繁殖性状(产犊后首次配种间隔、经产牛首末配种间隔、青年牛首末配种间隔、经产牛死产率和青年牛死产率等)的近似遗传相关系数在0.3~0.7之间,AMH浓度与繁殖性状存在较强的遗传相关。有研究指出血浆AMH浓度可以作为一种标志物评估奶牛卵巢储备能力[8];薛建华等[24]研究发现,奶牛血浆AMH浓度与超排获得胚胎总数呈高度相关,上述研究均表明血浆AMH浓度具有预测奶牛繁殖性能的潜力。此外,有研究指出,高浓度血浆AMH的奶牛群体妊娠率相对于低浓度血浆AMH的奶牛群体更高[10-11]。综上,血浆AMH浓度与奶牛的繁殖性能之间存在密切的关联,两者之间的详细关系还有待进一步深入研究。 AFC. 首次产犊日龄;AFS. 首次配种日龄;CE_C. 经产牛产犊难易性;CE_H. 青年牛产犊难易性;ICF, 产犊后首次配种间隔;IFL_C. 经产牛首末配种间隔;IFL_H. 青年牛首末配种间隔;SB_C. 经产牛死产率;SB_H,青年牛死产率AFC. Age at the first calving; AFS. Age at the first service; CE_C. Calving ease in cow; CE_H. Calving ease in heifer; ICF. Interval from calving to the first service; IFL_C. Interval from the first to the last inseminations in cow; IFL_H. Interval from the first to the last inseminations in heifer; SB_C. Stillbirth in cow; SB_H. Stillbirth in heifer图3 荷斯坦牛血浆AMH浓度与繁殖性状的近似遗传相关Fig.3 The approximate genetic correlations between plasma AMH concentration and reproductive traits in Holstein cows 本研究对北京地区荷斯坦泌乳牛血浆抗缪勒氏管激素(anti-Müllerian hormone, AMH)浓度进行了测定和影响因素分析,并初步估计了AMH浓度的遗传参数。发现采样季节对血浆AMH浓度存在极显著影响,血浆AMH浓度属于中等遗传力性状,遗传力为(0.10±0.08),血浆AMH浓度与部分繁殖性状(产犊后首次配种间隔、经产牛首末配种间隔、青年牛首末配种间隔、经产牛死产率和青年牛死产率)存在中高遗传相关,遗传相关系数介于0.3~0.7。本研究为深入探究血浆AMH的遗传基础及其与繁殖性状的关系提供了有价值的信息,为奶牛繁殖性能的选育提供了新的思路。 致谢感谢中国农业大学动物科学技术学院学生杨明路、竹磊、安涛和陈少侃等在数据采集环节对本试验提供的帮助!3 讨 论
3.1 奶牛血浆AMH浓度
3.2 奶牛血浆AMH浓度的影响因素
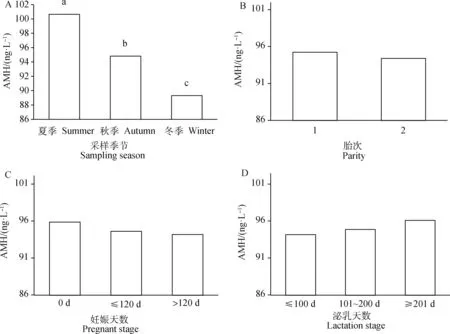

3.3 血浆AMH浓度遗传分析

4 结 论
