STAT6介导的巨噬细胞极化对布鲁氏菌胞内存活的影响
2022-03-08王月丽邓肖玉李培东张江伟孙天浩朱良全易继海陈创夫
席 静,王月丽,邓肖玉,杨 琴,李培东,张江伟,孙天浩,朱良全,易继海*,陈创夫*
(1.石河子大学动物科技学院,石河子 832000; 2.人兽共患传染性疾病防治协同创新中心,石河子 832000; 3.中国兽医药品监察所,北京 100081)
布鲁氏菌(Brucella)是引起布鲁氏菌病的革兰阴性兼性胞内寄生菌,分为光滑型和粗糙型[1-2]。布鲁氏菌感染的靶细胞主要有巨噬细胞、树突状细胞与胎盘滋养层细胞等。虽然吞噬细胞能够杀灭大部分病原菌,但仍有少量布鲁氏菌具备逃避宿主免疫系统杀伤的长效机制,能够在宿主免疫细胞内长期生存,造成持续性感染[3-4]。在其感染机体过程中,诱导产生一些细胞因子,如TNF-α、IL-4、IL-10、IL-12等,调节布鲁氏菌在巨噬细胞内的增殖[5]。巨噬细胞在各种因素诱导下出现表型、功能及形态的不同分化,即巨噬细胞的“极化”现象[6]。有研究表明未极化状态的M0型巨噬细胞在IFN-γ的刺激下极化为具有促炎杀菌功能的M1型巨噬细胞(M1型),促进TNF-α、IL-1β、IL-12等炎症因子的产生,抑制细胞增殖同时伴随抗原递呈能力,细胞表面标志因子有NOS2、CD86等;而M2型巨噬细胞(M2型)主要由细胞因子IL-4、IL-13诱导极化,介导Th2型免疫反应、变态反应等,细胞表面标志因子有Arg1、CD206等[7-8]。M2型与胞内病原体引起的持续感染密切相关[9-10],通过释放IL-10等抑炎因子,防止过度炎症反应损伤,有利于胞内病原体的持续性感染[11]。
近年来,研究发现巨噬细胞极化与临床上很多相关疾病密切相关。研究表明在布鲁氏菌急性和炎症感染期间,INF-γ水平升高,布鲁氏菌诱导巨噬细胞向M1型极化[12],相反,在慢性感染期间,布鲁氏菌则诱导巨噬细胞向M2型极化,从而延长布鲁氏菌在宿主细胞内的存活。M2型的激活途径主要由STAT6信号通路介导与控制[13-14],STAT6是JAK-STAT信号通路的成员,位于细胞质中的信号蛋白,参与调控多种因子诱导的细胞活化[15]。当STAT6发生磷酸化,形成二聚体并转移到细胞核,诱导其下游靶基因的Arg1、CD206表达[16-17],从而调控巨噬细胞活化和代谢。然而布鲁氏菌在胞内长期存活机制和巨噬细胞对布鲁氏菌的吞噬杀伤机制是否与巨噬细胞的极化有关现在仍不清楚,本研究采用布鲁氏菌S2308和RB51株侵染小鼠巨噬细胞诱导其极化,检测相关因子的表达和胞内荷菌量,探讨布鲁氏菌感染巨噬细胞后对其极化的影响,揭示STAT6信号通路对布鲁氏菌在巨噬细胞内生存的关系。
1 材料与方法
1.1 材料
1.1.1 菌株和细胞 布鲁氏菌光滑株S2308由中国兽医药品监察所保存,布鲁氏菌粗糙型疫苗株RB51由石河子大学人畜共患病重点实验室保存;小鼠巨噬细胞RAW264.7购自中国科学院典型培养物保藏委员会细胞库。
1.1.2 主要试剂 PE-CD206抗体(Biolegend),PE-CD86抗体(Biolegend);破膜剂(BD公司),STAT6(EL900280-50)和p-STAT6(No.EL903063-100)抗体购自EterLife公司;STAT6抑制剂AS1517499(MCE公司)。IL-10、IL-12、IL-4、TNF-α ELISA 试剂盒(美国RD公司)。
1.2 方法
1.2.1 引物设计与合成 根据GenBank 提供的基因序列号:Omp22(AY484565.1)、STAT6 (U66575.1)、P65(NM_00904)、ARG1(NM_000045.2)、NOS2(MP201463)、IL-10(NM _010548)、IL-1β(NM_008361.4)、GAPDH(NM_001289726.1)。用Primer 5 软件设计引物并送上海生工公司合成,引物序列如表1。
1.2.2 小鼠巨噬细胞RAW264.7细胞的培养 将小鼠巨噬细胞RAW264.7复苏,置于5% CO2、37 ℃培养箱。隔天传代继续培养24 h,传代至六孔板内,次日侵染。
1.2.3 布鲁氏菌侵染RAW264.7细胞 将活化的菌株根据细胞量和感染复数(MOI 100∶1)计算每孔所需菌量,进行比浊。将菌量稀释至1×108铺入六孔板内,对照组加入PBS,孵育1 h。加入硫酸庆大霉素培养45 min。PBS洗绦后加入培养液,分别在4、8、12、24、48、72 h收取不同时间点上清液用于ELISA,每孔细胞使用Trizol裂解用于qRT-PCR。

表1 引物序列
1.2.4 qRT-PCR检测M1/M2型巨噬细胞标志因子mRNA的表达水平 布鲁氏菌侵染细胞后4、8、12、24、48、72 h分别收集样品,提取细胞总RNA及反转录,做实时荧光定量PCR,再采用相对定量2-ΔΔCt进行统计分析,检测M1型因子p65、NOS2、IL-1β和M2型因子STAT6、ARG1、IL-10相对于GAPDH基因mRNA表达量。
1.2.5 流式细胞术检测布鲁氏菌感染下M1/M2细胞标记分子 菌株侵染细胞分别在12和72 h 收集细胞,进行流式细胞术检测M1型标记分子CD86和M2型标记分子CD206的表达变化。设置S2308-CD86、S2308-CD206、RB51-CD86、RB51-CD206、IgG2a不同的管,在每管加入相应抗体,上机检测。
1.2.6 MTT法检测STAT6抑制剂AS1517499(AS)对巨噬细胞毒性的影响 使用对数生长期细胞并计数调整浓度,加入不同浓度STAT6抑制剂AS(1、2、4、8 μmol·L-1)与RAW164.7细胞共同孵育24 h,0.1% DMSO处理的细胞作为对照,经MTT方法检测细胞活性。
1.2.7 Western blot检测STAT6的激活状态 用布鲁氏菌S2308、RB51分别侵染正常细胞和用AS预处理细胞,PBS作对照,提取细胞总蛋白,用BCA法检测定浓度。将蛋白按4∶1加入蛋白上样液,100 ℃ 10 min。然后进行SDS-PAGE电泳,再进行Western blot试验,用凝胶成像仪拍照保存,检测p-STAT6信号蛋白表达水平。
1.2.8 ELISA检测布鲁氏菌介导的M1/M2型细胞因子 将布鲁氏菌S2308、RB51分别侵染正常细胞和AS预处理过的细胞,PBS处理作为对照组,分别在侵染8、24、48、72 h时吸取上清液,用TNF-α、IL-12、IL-4和IL-10的ELISA试剂盒检测相应细胞因子表达量变化。
1.2.9 CFU计数检测STAT6对布鲁氏菌胞内生存的影响 M0细胞、IL-4诱导的M2型细胞和AS预处理后细胞,用布鲁氏菌S2308、RB51按照感染复数(MOI 100:1)进行侵染,PBS作对照。分别在4、8、24、48、72 h时,裂解菌体,进行梯度稀释。每管吸取100 μL,加入TSA内,倒置孵育3 d,菌落计数并进行统计分析。
1.2.10 数据统计分析 利用统计学软件SPASS.20分析数据显著性差异,多组样本间均数用方差分析,并用Graphpad Prism 5作图。
2 结 果
2.1 布鲁氏菌感染对M1/M2型巨噬细胞标志因子mRNA表达的影响
RT-PCR结果(图1)显示,相对于对照组,S2308在感染巨噬细胞8、12 h处显著诱导p65、NOS2和IL-1β mRNA转录表达(P<0.05),72 h时表达下调;而STAT6、ARG1、IL-10在感染4、8、12 h处表达下调,72 h处显著上调(P<0.05)。RB51在感染8、48 h处显著诱导p65、NOS2和IL-1β mRNA转录表达(P<0.05),到72 h处表达下调;而STAT6、ARG1在感染4、8、12 h时与对照组差异较小,72 h时上调。
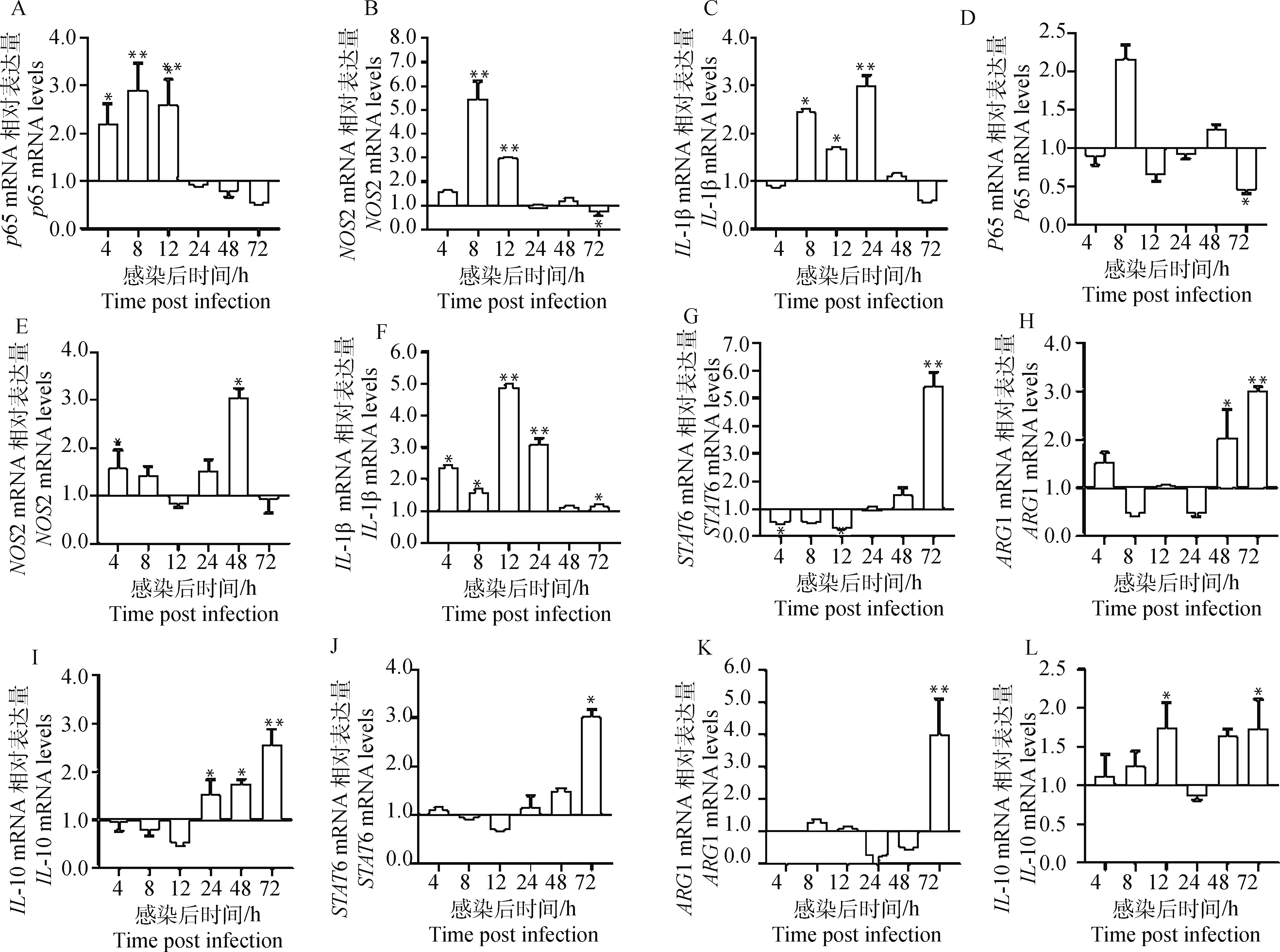
A~F. M1型因子mRNA相对表达量; G~L. M2型因子mRNA相对表达量。A~C、G~I.S2308;D~F,J~L.RB51。与对照组相比,*.P<0.05; **.P<0.01。下同A-F. mRNA relative expression level of M1 type factor; G-F. mRNA relative expression level of M2 type factor.A-C,G-I.S2308;D-F,J-L.RB51. Compared with control group, *.P<0.05; **.P<0.01.The same as below图1 M1型巨噬细胞因子和M2型巨噬细胞因子mRNA相对表达量Fig.1 Relative mRNA expression levels of M1 type and M2 type macrophage cytokines
综上所述,用S2308和RB51侵染细胞可不同程度诱导巨噬细胞M1型因子(P65、NOS2和IL-1β)与M2型因子(STAT6、ARG1、IL-10)的mRNA转录表达,且具有时间依赖性(图1)。
2.2 流式检测布鲁氏菌介导的CD86和CD206分子表达
CD86:在感染12 h时显著高于对照组,差异极显著(P<0.01),且S2308组荧光率最高,达到了83%。72 h时与对照组无显著差异,但低于12 h时,差异极显著(P<0.01)。
CD206:在感染12 h时,与对照无显著差异,72 h 时,其荧光强度上升,S2308组荧光率最高,达到了47.7%(图2、3)。

图2 流式检测布鲁氏菌感染后CD86(A)和CD206(B)的表达Fig.2 The expression of CD86(A) and CD206(B) after Brucella infection

试验组与对照组相比,**.P<0.01;12与72 h相比,##.P<0.01Compared with the control group, ** .P<0.01. Between 12 and 72 h, ##.P<0.01图3 布鲁氏菌感染细胞后CD86(A)和CD206(B)表达的柱状图Fig.3 Columnar images of CD86(A)and CD206(B)expression after Brucella infection
2.3 AS对巨噬细胞活性的影响
为了验证STAT6抑制剂AS是否具有细胞毒性作用。加入不同浓度AS,使用MTT法检测细胞存活率。当AS浓度达到4 μmol·L-1时,细胞存活率下降到75%,而AS浓度达到8 μmol·L-1时,细胞存活率仅达52%,说明AS对细胞活性的抑制作用具有浓度依赖性,后续试验加入抑制剂浓度采用1和2 μmol·L-1(图4)。
2.4 AS对布鲁氏菌介导的STAT6信号通路的阻断
为了验证布鲁氏菌感染过程中AS对STAT6信号的阻断效果,Western blot检测P-STAT6的蛋白表达。结果显示,相对于对照组,S2308菌株可激活STAT6,与对照组相比差异极显著(P<0.01);RB51菌株几乎不能激活STAT6。加入AS后,可显著抑制p-STAT6的表达,且在浓度为2 μmol·L-1时,极显著抑制(P<0.01,图5)。
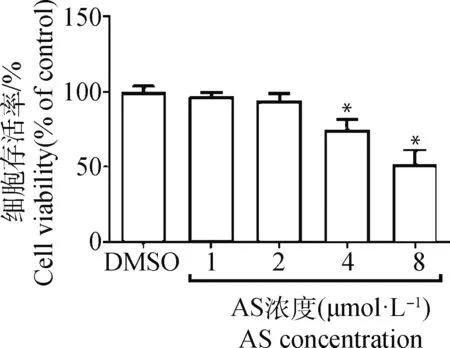
试验组与对照组相比,*. P<0.05Experimental group compared with control group,*.P<0.05图4 抑制剂AS对细胞活性的抑制作用具有浓度依赖性Fig.4 The cell viability was inhibited by AS in a concentration-dependent manner in cells

A、B.Western blot检测p-STAT6的表达情况;C、D.根据Western blot各条带的灰度值制作的柱形图;A、C.S2308;B、D.RB51。试验组与对照组相比,**.P<0.01The expression of p-STAT6 was detected by Western blot; C,D.Histogram made based on the grayscale value of the strip in A,B.Western blot figure;A,C.S2308;B,D.RB51.Experimental group compared with control group,**.P<0.01图5 AS对布鲁氏菌介导的STAT6信号通路的影响Fig.5 Effect of AS on Brucella mediated STAT6 signaling pathway
2.5 AS阻断STAT6对布鲁氏菌介导的细胞因子的影响
M2型细胞因子IL-4和IL-10 在感染72 h时,S2308菌株极显著(P<0.01),而AS对布鲁氏菌介导的IL-4和IL-10有抑制表达作用。M1型细胞因子TNF-α和IL-12的诱导在感染前期8和24 h 较为显著,RB51菌株差异显著(P<0.05),S2308在8 h 差异极显著(P<0.01),而AS对布鲁氏菌介导的TNF-α和IL-12具有促进表达作用(图6)。

与对照组比较, *. P<0.05; **. P<0.01;各菌株处理组比较, #.P<0.05; ##.P<0.01The expression was compared with the control group, *. P<0.05; **. P<0.01;A comparison between the treatment groups of each strain, #.P<0.05; ##.P<0.01图6 M1/M2型细胞因子表达量柱状图Fig.6 The histograms of expressions of M1/M2 cytokines
2.6 STAT6对布鲁氏菌胞内生存的影响
S2308感染后其胞内菌存活也呈先降低后上升趋势。下降至8 h达到最低值,回升至72 h达到最高值。S2308+IL-4组在感染8和72 h时高于S2308组。S2308+AS组在感染72 h时低于S2308组。RB51感染后细胞载菌量呈逐渐降低轻微回升趋势,12 h降到最低。而RB51+IL-4组和RB51+AS组与RB51组无显著差异(图7)。

A. S2308;B. RB51;C. S2308和RB51的CFU比较。S2308+AS组和RB51+AS组分别与S2308和RB51差异显著,*. P<0.05;S2308+AS组和RB51+AS组分别与S2308和RB51差异极显著,**.P<0.01A. S2308; B. RB51; C. CFU comparison between S2308 and RB51. The S2308+AS group and RB51+AS group were significantly different from S2308 and RB51, *. P<0.05; The S2308+AS group and RB51+AS group were significantly different from S2308 and RB51, **.P<0.01图7 布鲁氏菌S2308、RB51在细胞中的存活能力(CFU计数)Fig.7 The viability of Brucella S2308 and RB51 in cells (CFU counts)
3 讨 论
布鲁氏菌属于兼性胞内致病寄生菌,人与动物感染后引起免疫器官和生殖器官损伤,甚至引起机体慢性感染。而慢性感染机制主要是体现在它能隐匿于内质网来逃逸宿主免疫杀伤[18]。然而,布鲁氏菌免疫逃逸机制至今仍然不清楚。巨噬细胞是布鲁氏菌重要的宿主细胞,也是调控免疫稳态的重要免疫细胞。巨噬细胞在受到病原入侵后可释放Th1型和/或Th2型细胞因子,Th1型细胞因子(TNF-α、IL-12、INF-γ)主要介导细胞免疫应答,诱导Th1型免疫应答,对消除宿主病原微生物起关键作用[19]。Th2型细胞因子(IL-4和IL-10)主要介导体液免疫,但也有利于一些细胞内病原微生物的持续性感染[20]。
有研究表明,布鲁氏菌感染可能通过巨噬细胞表面受体与其结合[21],促使细胞极化为M1型来控制病原菌的入侵,而为了防止炎症反应过度,巨噬细胞通过机体内诱导的细胞因子的不同,将其表型发生改变,促使M2型巨噬细胞的转化来减轻炎症[11,22]。巨噬细胞极化是微环境的改变或异物的侵入引起的宿主保护“现象”,而不同的极化状态则是其参与疾病进展、调控免疫稳态的重要机制[23-24]。本研究发现布鲁氏菌能够直接影响巨噬细胞的极化状态,在感染早期可促进巨噬细胞向M1型分化,后期则由M1型、M0型巨噬细胞向M2型转化,这与王月丽等[25-26]在巨噬细胞中报道的结果相似,但布鲁氏菌是如何影响巨噬细胞极化需要进一步探究。
STAT6信号通路是影响M2型相关因子表达的重要转录分子,STAT6磷酸化的增强是促进M2型极化的重要因素。本研究结果发现S2308能显著激活STAT6信号通路,而RB51几乎不激活该通路,这可能由于巨噬细胞的极化受病原菌不同毒力影响[27]。为了进一步探索布鲁氏菌是否能够通过STAT6介导的M2型极化来影响Th2型细胞因子的释放与细菌胞内生存。后续通过ELISA试验发现加入AS在布鲁氏菌感染后期可抑制M2型因子IL-4和IL-10的释放,并促进M1型因子TNF-α和IL-12的释放。IL-10是调节巨噬细胞功能的关键分子,缺失IL-10的小鼠,其脾和肝内存活的细菌数会显著下降,促炎细胞因子增加,器官病变严重[12]。IL-4是STAT6激活分子,参与组织修复,抑制炎症反应[28],是胞内致病菌建立慢性持续性感染的重要分子。为了进一步探究STAT6介导的M2型细胞因子是否可影响布鲁氏菌胞内繁殖,CFU试验发现STAT6对布鲁氏菌胞内生存起促进作用,加入抑制剂可降低布鲁氏菌的胞内存活。结合以上结果和分析,本研究证实了布鲁氏菌在感染后期可能通过STAT6促进M2型抑炎因子的释放来抵抗宿主细胞的免疫杀伤。此外,笔者还发现相对于S2308,RB51作为粗糙型菌株并不能有效通过STAT6信号通路介导的巨噬细胞激活来影响胞内菌的存活,这可能由于RB51菌株LPS缺乏O链的缘故[1,29-30],具体原因和机制未见报道,尚需进一步研究证实。
4 结 论
本研究证实布鲁氏菌感染巨噬细胞前期能够诱导M1型极化,而在感染后期诱导M2型极化并激活STAT6信号通路,从而促进布鲁氏菌的胞内生存。这将为阐述布鲁氏菌胞内存活机制提供新的研究方向和理论基础。
