内蒙古不同小花棘豆种群苦马豆素及其内生真菌关系的分析
2022-03-08王维夫钱亚光李玉玲
王维夫,钱亚光,2,卢 萍*,何 珊,3*,杜 玲,李玉玲,高 峰
(1.内蒙古师范大学生命科学与技术学院,呼和浩特 010022;2. 喀喇沁旗农业环境保护能源站,赤峰 024400;3. 包头医学院医学技术与麻醉学院,包头 014040)
小花棘豆(Oxytropisglabra)为豆科棘豆属多年生草本植物,主要生长在草原、荒漠草原以及荒漠区的低湿地[1]。国际上将含苦马豆素(swainsonine, SW)的黄芪属和棘豆属植物统称为疯草,小花棘豆是内蒙古最重要的疯草,其生长周期均有毒,以渐进形式引起牲畜慢性中毒,对草原畜牧业造成重大损失。SW阳离子构型与甘露糖苷阳离子结构十分相似,与甘露糖有高度亲和性,在动物细胞中会竞争性抑制溶酶体酸性α-甘露糖苷酶Ⅰ和高尔基体α-甘露糖苷酶Ⅱ的活性,导致甘露糖积累,使蛋白质合成、加工以及转运受到一系列影响,细胞内部分低聚糖无法正常代谢而聚积,由此导致细胞变性空泡化,失去正常功能,严重时造成死亡。牲畜采食小花棘豆初期体重稍增加,继续采食后出现身体消瘦,精神沉郁、易受惊吓、四肢无力、反应迟钝、内脏空泡化以及生殖机能严重受损等症状,严重时导致死亡[2-4]。
SW是一种次级代谢产物,最早由Colegate从灰苦马豆(Sphaerophysasalsula)中分离纯化。SW的分子式为C8H15NO3,相对分子质量为173,熔点为144~145 ℃,纯品呈白色针状晶体,属于吲哚里西啶类生物碱,在吲哚里西啶环1,2,8位3个C原子上各连1个羟基,化学名为1,2,8-三羟基吲哚里西啶[5]。SW在医药领域内可作为一种有潜力的抗肿瘤药物,能抑制高尔基体α-甘露糖苷酶Ⅱ,从而阻断癌细胞的N-连接寡糖合成,抑制癌细胞转移,增加癌细胞对天然免疫的敏感性[6]。
卢萍等[7-8]进行了内蒙古3种棘豆属植物(O.glabra、O.aciphylla和O.racemusa)中SW相关因子的研究,发现仅小花棘豆(采自鄂尔多斯、巴彦淖尔和阿拉善地区的6个种群167株)含SW,检测了单株植物SW水平,在植物总DNA中扩增出真菌5.8S rDNA/ITS序列,部分植株分离出内生真菌,扩增了5.8S rDNA/ITS序列,经微生物学研究和序列比对分析,在属水平上鉴定该真菌为Embellisia,后修订为Alternaria,有该内生真菌的小花棘豆都含SW。后卢萍课题组继续在内蒙古西部采集8个种群135株小花棘豆,进行相关研究,得到相同结论,发现体外培养的小花棘豆Alternaria内生真菌产生了SW,提出小花棘豆SW毒性可能由Alternaria引起[9-11]。余永涛等[12-13]从甘肃棘豆、毛瓣棘豆、冰川棘豆中分离到Embellisia内生真菌(修订为Alternaria),该真菌检测到SW,在茎直黄芪分离了Alternaria内生真菌,真菌中也检测到SW。Martinez等[14]采集了不同地区的黄芪种群,提取单株SW,扩增出AlternariasectionUndifilum内生真菌并检测到SW。
本研究在前期基础上扩大采样量,从内蒙古鄂尔多斯鄂托克前旗和乌审旗8个不同地理种群采集120株小花棘豆,测定单株植物SW水平,从单株植物中分离培养内生真菌,进一步深入研究小花棘豆SW毒性与内生真菌的关系。
1 材料与方法
1.1 材料
选择内蒙古鄂尔多斯市鄂托克前旗和乌审旗8个小花棘豆地理种群,进行单株植物随机采样,采样地概况见表1。每个地理种群采集15株左右小花棘豆健康个体,株间距50 m以上。将新鲜叶片置变色硅胶中迅速干燥,带回实验室以备DNA提取,将整株植株带回烘干后,用于SW的提取、测定及内生真菌分析。
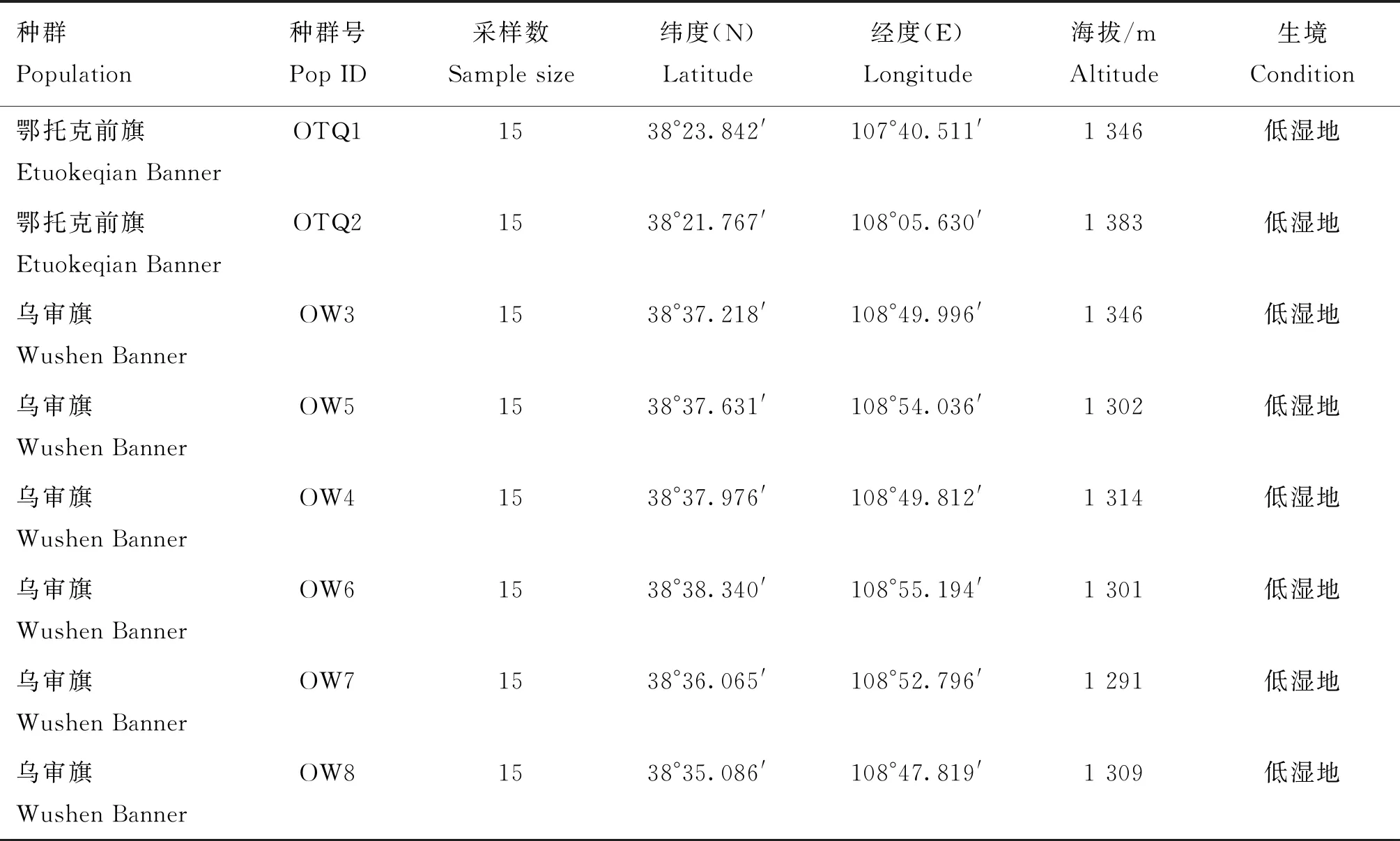
表1 小花棘豆采样地
1.2 仪器与试剂
仪器设备:Varian 450GC气相色谱仪(美国瓦里安公司)、Hettic MIKRO22R台式低温高速离心机(北奥企业集团有限公司)、WD-9405B水平摇床(北京六一仪器厂)、FZ102植物试样粉碎机(北京中兴伟业仪器有限公司)、ZHJH-1109超净工作台(上海智诚分析仪器有限公司)、Tanon GIS-2010凝胶成像系统(上海天能仪器厂)、050-810Tgradient48 PCR 扩增仪(德国 Biometra-grandient 公司)、DYY-6C电泳仪(北京六一仪器厂)。
试剂:甲基化-α-D-甘露糖苷(Sigma公司)、硅烷化试剂(三氟乙酰胺+三甲基氯硅烷) (Sigma公司)、SW标准品(西北农林科技大学)、Dowex 50 WX8 50-100(H)阳离子交换树脂(阿法埃莎天津化学有限公司)、2×TaqMaster Mix(南京博尔迪生物科技有限公司)、1 kb Plus DNA ladder(天根生化科技北京有限公司),均为色谱纯或分析纯。
1.3 单株小花棘豆总DNA提取及其内生真菌5.8S rDNA/ITS序列扩增
单株小花棘豆总DNA提取:CTAB 法提取总DNA[15],0.7%琼脂糖凝胶电泳,电泳结果用凝胶成像系统检测。内生真菌5.8S rDNA/ITS序列扩增:用真菌特异性引物P1/P2对其5.8S rDNA/ITS区进行PCR扩增,P1为正向引物,序列为5′-GGAAGTAAAAGTCGTAACAAGG-3′;P2为反向引物,序列为5′- GTTCAGCGGGTATCCCTA-3′。
10 μL PCR反应体系:3.5 μL 2×PCR master mix,总DNA模板10 ng,100 μmol·L-1引物各0.25 μL,用超纯水补足10 μL。扩增程序:94 ℃预变性3 min;94 ℃变性45 s,48 ℃复性1 min,72 ℃延伸30 s,30个循环;72 ℃延伸5 min。PCR产物用1.5%琼脂糖凝胶电泳分离,Tanon GIS-2010型凝胶成像系统检测。对扩增产物进行序列测定,所得结果序列进行同源比对。
1.4 单株小花棘豆SW水平检测SW提取
用电动粉碎机将已烘干的120株单株小花棘豆植物分别粉碎,使其通过直径0.5 mm筛。准确称取0.2 g过筛单株植物粉末,利用乙酸-氯仿浸提,用Dowex 50 WX8 50-100(H)阳离子交换树脂柱层析纯化[7,9-11]。
SW的GC检测:样品中加50 μL吡啶溶液,加16 μL甲基化-α-D-甘露糖苷(100 μg·mL-1)作内标物,再加入50 μL双(三甲基硅烷基)三氟乙酰胺+三甲基氯硅烷(99∶1)混匀,置于干燥器中进行30 min衍生化反应后进样。用吡啶配制SW标准溶液,用标准品和内标物峰面积比值作横坐标,SW标准溶液的浓度(μg·mL-1)作纵坐标,绘制标准曲线,依据标准曲线方程计算植株SW水平。气相色谱条件:石英毛细管柱(30 m×0.25 mm,0.25 μm),柱温210 ℃, 进样口温度300 ℃,氢火焰离子化检测器,检测器温度为280 ℃,高纯氮载气。测样进样量1 μL, 流速1 mL·min-1,分流比50∶1。
1.5 小花棘豆内生真菌的培养及其SW水平检测
内生真菌的培养:用60 ℃烘干的单株小花棘豆茎切段做外植体,在超净工作台内将约1 cm外植体用70%乙醇浸泡30 s、20%次氯酸钠溶液浸泡3 min, 用无菌双蒸水清洗2次,后置灭菌滤纸上吸干,接种到1.5%水琼脂培养基上,于25 ℃下培养。待外植体长出真菌菌丝体后,用接种环刮取菌丝体转至PDA培养基上分离单菌落。观察菌落和菌丝体形态。
小花棘豆内生真菌SW水平检测:在超净工作台内刮取培养45 d的真菌单菌落菌丝体,置于干燥器中干燥后,用研钵充分研磨至粉末状,从中提取SW,水平检测方法同“1.4”。
1.6 统计分析
SW水平两种群间差异性比较采用独立样本t-检验;SW水平多种群间差异性比较采用单因素方差分析,事后多重比较采用Bonferroni校正法。以P<0.05作为检验水准。
2 结 果
2.1 单株小花棘豆总DNA提取
部分小花棘豆单株植物总DNA提取电泳结果见图1,DNA质量较好,无降解。
2.2 内生真菌5.8S rDNA/ITS序列扩增
110株小花棘豆均扩增出真菌5.8S rDNA/ITS序列,部分PCR产物电泳结果见图2。经PCR产物测序分析,序列全长为517 bp,其中ITS1区1—199 bp、5.8S rDNA区200—369 bp、3 ITS2区370—517 bp,与课题组前期发表的结果相同,属于Alternaria。

M. 1 kb plus DNA相对分子质量标准;1~17. 小花棘豆DNA提取结果M. 1 kb plus DNA ladder;1-17. Results of DNA extraction from Oxytropis glabra图1 部分小花棘豆总DNA提取结果Fig.1 The extraction results of total DNA from Oxytropis glabra
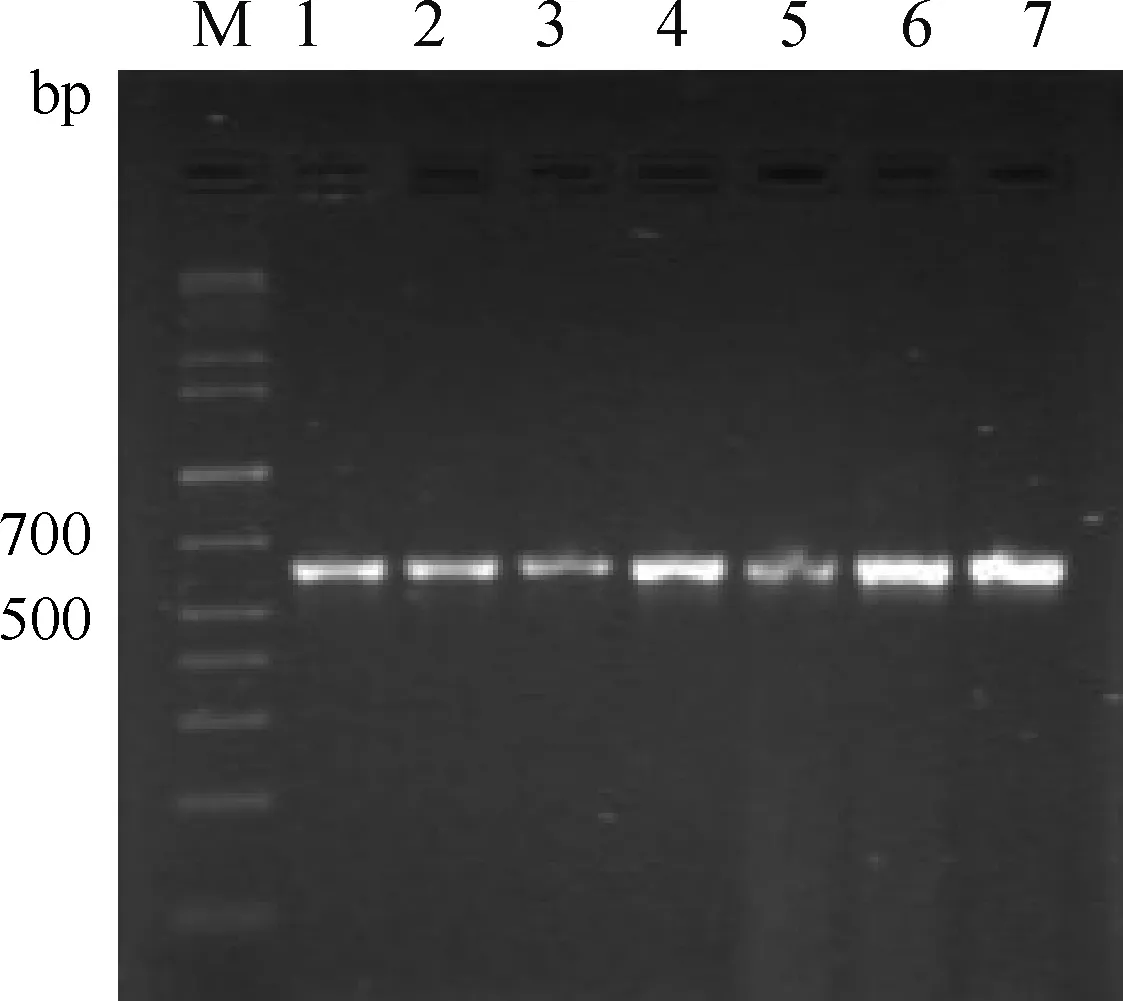
M. 1 kb plus DNA相对分子质量标准;1~7. 扩增结果M. 1 kb plus DNA ladder;1-7. Amplification results图2 部分小花棘豆植物中内生真菌5.8S rDNA/ITS序列扩增结果Fig.2 Amplification of 5.8S rDNA/ITS of endophytic fungi from Oxytropis glabra
2.3 单株小花棘豆SW水平检测
SW标准曲线见图3,其中R2=0.999 7,方程线性良好。
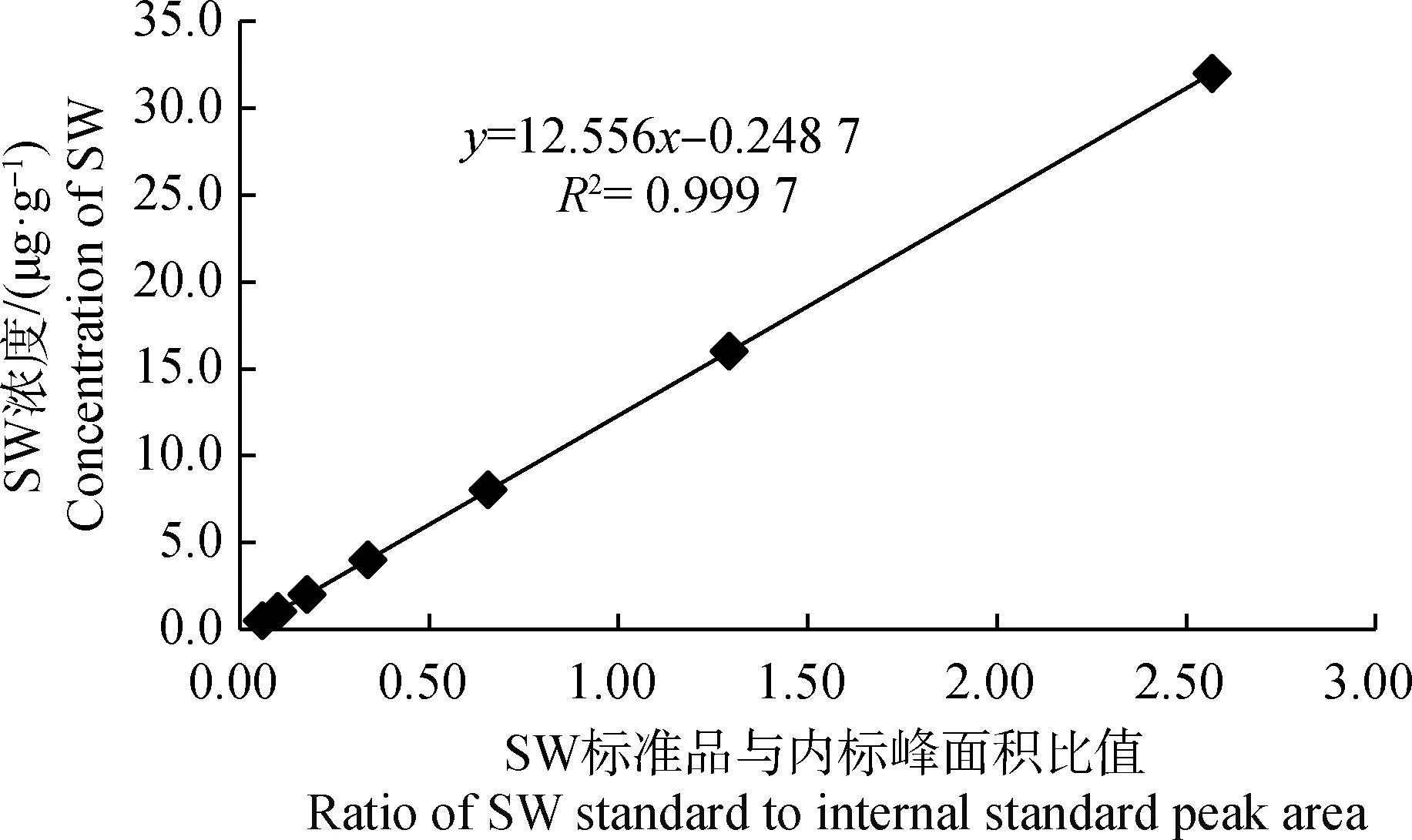
图3 SW标准曲线Fig.3 Standard curve of SW
2.4 单株小花棘豆SW水平
各样品进样后均出现与SW标准品相同保留时间的色谱峰,保留时间为4.4 min左右;内标物色谱峰保留时间为4.2 min左右,结果见图4、5。

图4 SW标准品气相色谱图Fig.4 GC map of standard SW

图5 植株样品SW气相色谱测定图Fig.5 GC map of SW from plant samples
根据标准曲线方程计算出小花棘豆待测植株样品的SW水平和PCR扩增结果见表2。120株小花棘豆中有111株测出SW,最高水平为369.05 μg·g-1,平均水平32.78 μg·g-1,未测出SW的9株扩增出了真菌条带,经测序分析不属于Alternaria。
鄂托克前旗有2个种群OTQ1和OTQ2,OTQ1的15株均测出SW,最低水平为OTQ1.13(0.10 μg·g-1),最高水平为OTQ1.1(16.00 μg·g-1),均值为4.15 μg·g-1;OTQ2的15株有13株测出SW,最高水平为OTQ2.6(21.80 μg·g-1),均值为3.65 μg·g-1。独立样本t-检验显示,鄂托克前旗OTQ1和OTQ2种群SW水平种群间差异无统计学意义(t=0.033,P=0.973)。
乌审旗有6个种群OW3至OW8。OW3的15株有8株测出SW,最高水平为OW3.14(92.40 μg·g-1),均值为9.53 μg·g-1;OW4的15株均测出SW,最低水平为OW4.7(2.46 μg·g-1),最高水平为OW4.2(139.12 μg·g-1),均值为54.31 μg·g-1;OW5的15株均测出SW,其最低水平为OW5.1(0.50 μg·g-1),最高水平为OW5.2(65.30 μg·g-1),均值为14.51 μg·g-1; OW6的15株均测出SW,最低水平为OW6.1(5.54 μg·g-1),最高水平为OW6.6(369.05 μg·g-1),均值为80.94 μg·g-1;OW7的15株均测出SW,其中OW7.14为痕量,最高水平为OW7.9(89.57 μg·g-1),均值为17.57 μg·g-1;OW8的15株均测出SW,最低水平为OW8.5(1.59 μg·g-1), 最高水平为OW8.10(243.56 μg·g-1),均值为77.57 μg·g-1。乌审旗6个种群检测出SW的样本进行单因素方差分析显示,SW水平与种群存在一定相关性(F=4.286,P=0.002),差异有统计学意义(P<0.01);Bonferroni校正的事后两两比较显示,OW6与OW5、OW6与OW7、OW8与OW5各组间SW水平存在差异,前者分别高于后者,差异有统计学意义(P<0.05),提示某些种群间SW水平可能存在一定差异性。
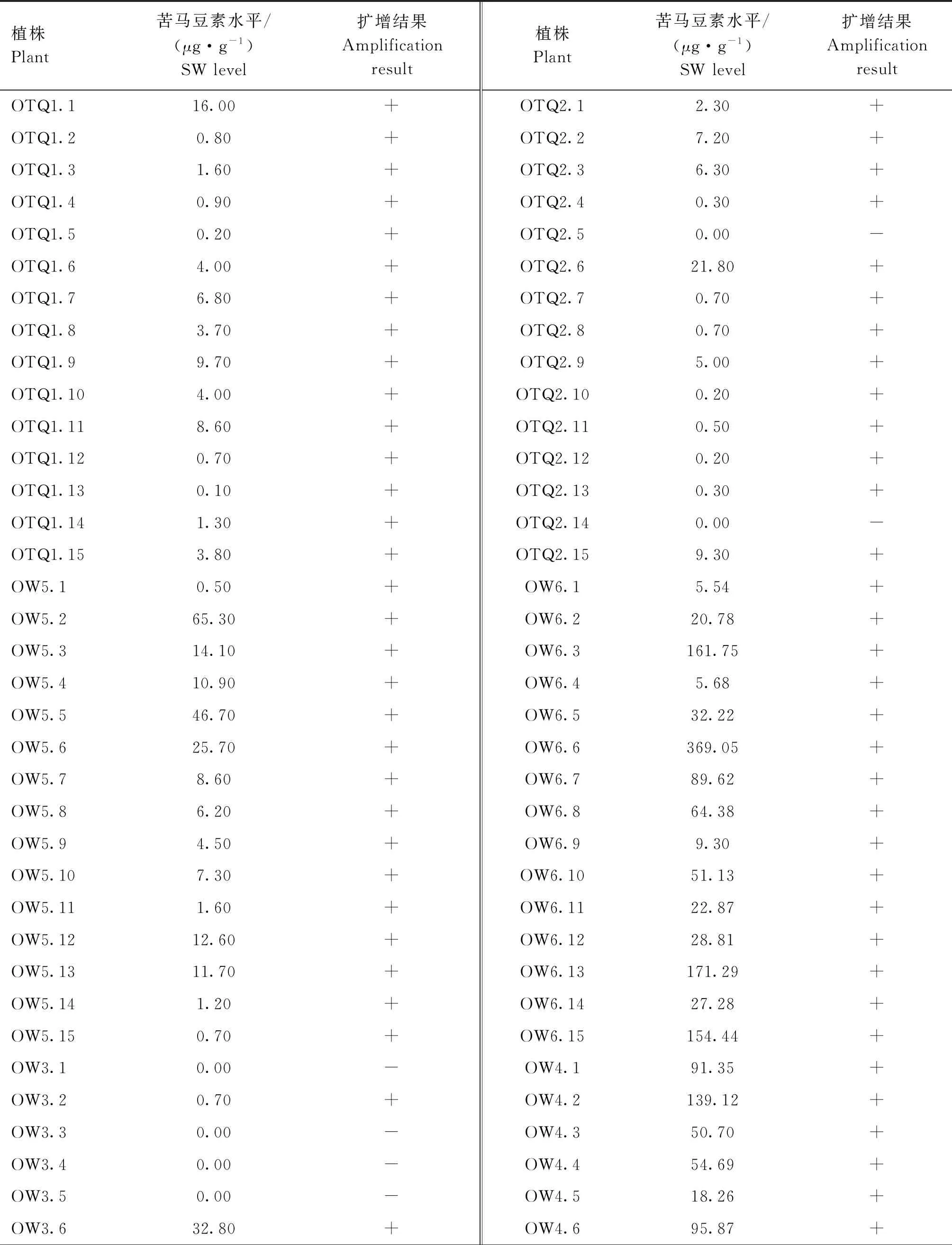
表2 小花棘豆单株SW水平及Alternaria真菌序列扩增结果

(转下页 Carried forward)
2.5 小花棘豆内生真菌
小花棘豆外植体于水琼脂培养基上培养1~2周,周围长出松散白色绒毛状真菌菌丝体(图6),划线培养得单株,真菌生长缓慢,呈现白色、圆形、隆起、边缘整齐、辐射状生长菌落,后来菌体分泌色素,菌落颜色逐渐加深,呈现灰色、深灰色或褐色至深褐色,有些菌落变为黑色,菌落背面颜色变化更明显(图7)。
2.6 小花棘豆Alternaria内生真菌SW水平
38株小花棘豆分离培养出Alternaria内生真菌,分离纯化其菌丝体中的SW,经GC检测结果显示,各样品均出现与SW标准品相同保留时间色谱峰(图8),保留时间为4.4 min左右,内标色谱峰保留时间为4.2 min左右。
不同内生真菌样品SW水平在0.83~2 573.24 μg·g-1变化,见表3。其中A-OTQ1.2~ A-OTQ2.13 的14个样品的SW水平均值为33.93 μg·g-1,最低水平为A-OTQ1.9(0.83 μg·g-1),最高水平为A-OTQ1.10(287.09 μg·g-1);A-OW3.2~A-OW8.14的24个样品的SW水平均值为492.28 μg·g-1,最低水平为A-OW3.13(2.05 μg·g-1),最高水平为A-OW7.8(2 573.24 μg·g-1)。
3 讨 论
本研究在中国内蒙古西部8个不同种群采集120株小花棘豆,单株SW水平为0.10~369.05 μg·g-1,均值为32.78 μg·g-1,分离培养出38株Alternaria内生真菌,均检测到SW,SW水平的均值为323.3 μg·g-1,范围在0.83~2 573.24 μg·g-1,在种群内和种群间有变化,与前期在其他种群中所得结论一致[7-11],与Gardener等[16]、Braun等[17]A.mollisimus、O.lambertii和O.sericae的研究结果相似;内生真菌菌落呈白色、圆形、边缘整齐、隆起,辐射状生长,后菌体分泌黑褐色色素,菌落颜色变化由白色至浅灰色直至黑褐色,与卢萍等[7-11]、Simmons[18]、陈伟群[19]、Pryor等[20]、Braun等[17]对疯草内生真菌Embellisia(后修订为Alternaria)的研究结果相同,测序所得内生真菌5.8S rDNA/ITS序列与Braun等[17]提交的相比有1个变异位点,位于5.8S rDNA区第227位(T→A),一致度为99.8%,二者高度同源。

图6 水琼脂培养基上小花棘豆内生真菌Fig.6 Endophytic fungi of Oxytropis glabra on the agar media

图7 PDA培养基上的小花棘豆内生真菌菌落Fig.7 Colonies of endophytic fungi from Oxytropis glabra on PDA media
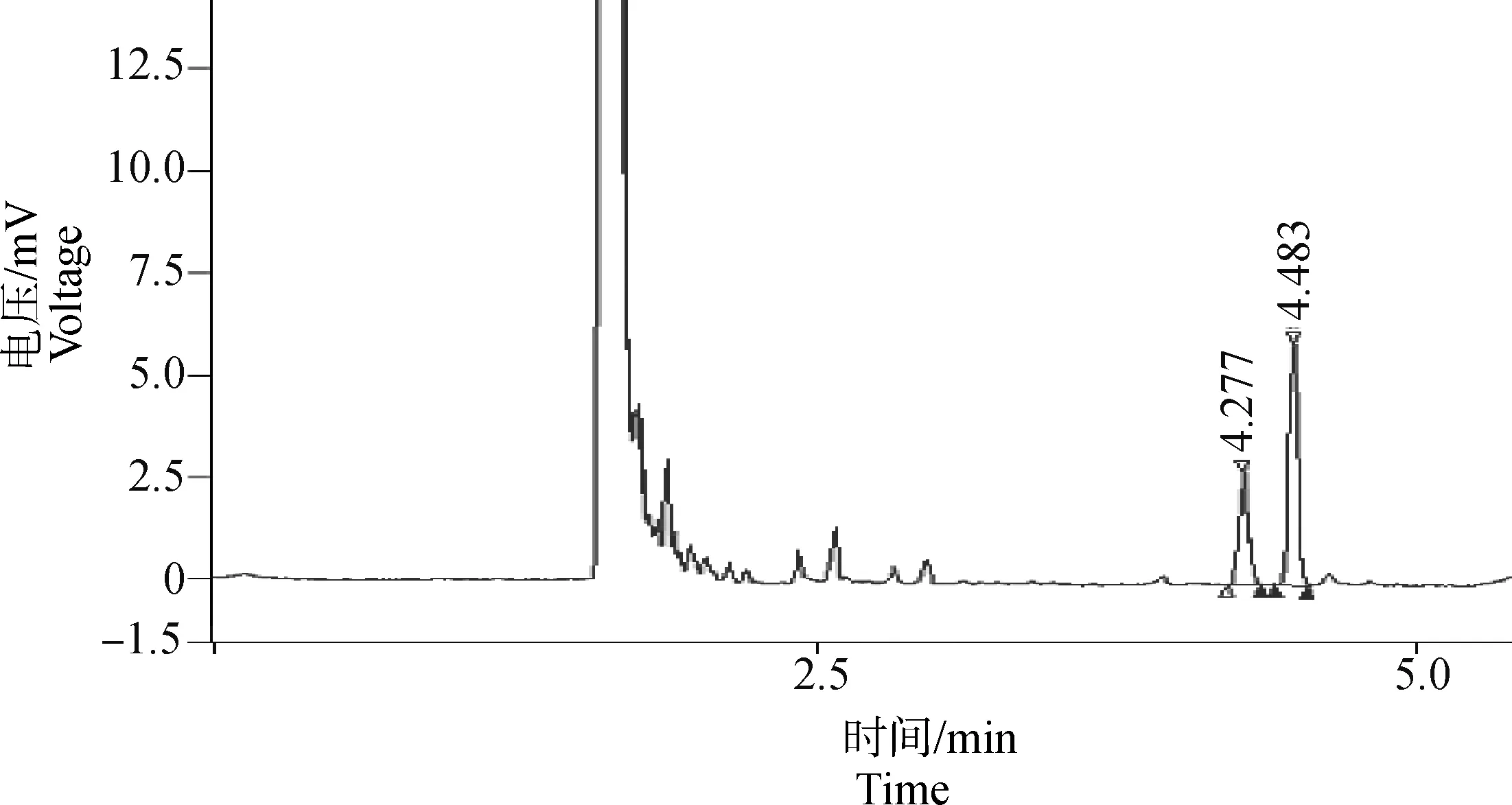
图8 Alternaria真菌SW标准品气相色谱图Fig.8 GC map of SW from Alternaria
Ralphs等[21]从黄芪属(Astragalus)和棘豆属(Oxytropis)中分离到内生真菌Embellisia(后修订为Alternaria),检测植株和内生真菌SW水平,发现含SW植株与内生真菌有相关性,认为内生真菌定殖宿主植株以及环境会影响宿主植株合成SW。在植物Astragalusoxyphysus和真菌Rhizotonialeguminicola的SW生物合成途径中,哌啶酸是一种前体物[22-23],深入研究内生真菌如何在疯草中合成SW及环境的影响很有必要。疯草内生真菌SW合成途径处于赖氨酸代谢途径的一个分支,尚有许多未解之谜,其合成途径:α-氨基已二酸→α-氨基已二酸半醛→P6C→哌啶酸→SW或赖氨酸→酵母氨酸→P6C→哌啶酸→SW,酵母氨酸还原酶(Sac)是合成SW的关键酶之一[24-25](P6C途径),近年推测疯草内生真菌Undifilumoxytropis中SW生物合成可能还有P2C途径,其生物合成机制及代谢途径尚不清楚,故对其进行深入研究有重要理论意义,同时在控制宿主小花棘豆SW含量、保护草原生态环境等方面具有潜在的应用价值[26]。课题组前期也克隆了A.oxytropisOW7.8的sac,构建了sac敲除株M1,发现其SW水平低于野生株OW7.8,而赖氨酸的水平变化很小,OW7.8中sac表达量越高、SW水平也越高[27-30];构建了sac互补株 C1,其SW水平高于M1和W7.8,推测表达载体上的强启动子驱动sac高表达,促进了SW的合成[31];探索了光照和培养基对A.oxytropis生长和苦马豆素含量的影响[32],综述了真菌中苦马豆素生物合成途径的研究进展[33],进行了OW7.8和 M1的转录组测序分析,注释到45 634个差异表达基因,从中初步鉴定出41个可能与SW生物合成相关,推测SW合成涉及P6C和P2C两条途径[34]。

表3 体外培养的小花棘豆Alternaria内生真菌SW水平
本研究通过比较分析不同小花棘豆种群SW及其内生真菌关系,可为深入研究内生真菌SW生物合成途径与调控机制提供基础数据,另外,也可筛选高水平SW菌株应用于医药和化工领域。将来课题组将继续深入研究小花棘豆基因组中关键基因对其合成SW及其前体物质积累的作用,探究植物与内生真菌如何互作合成SW,以及A.oxytropis的SW合成相关基因的克隆与功能研究。
4 结 论
内蒙古8个种群120小花棘豆株中111株测出含SW。从38株小花棘豆分离培养出了内生真菌,经微生物学研究及5.8S rDNA/ITS序列比对分析,在属水平上鉴定为Alternaria,该内生真菌均合成了SW,含Alternaria内生真菌的小花棘豆植株都检测出了苦马豆素。
