云南独龙鸡和白来航鸡卵巢组织转录组水平的比较分析
2022-03-08丁玥竹农燕鸿郭爱伟刘莉莉
任 宇,丁玥竹,农燕鸿,郭爱伟,刘莉莉
(西南林业大学生命科学学院,昆明 650224)
独龙鸡是我国云南贡山县独龙江乡独龙族饲养的独有地方品种,2010年被《国家畜禽遗传资源目录》收录[1]。纯种独龙鸡分布在独龙江流域最北边,这里群山环抱,地形陡峭,环境恶劣,交通极为不便,几乎无外来鸡种进入[2]。经过长期自然选择,独龙鸡具备了许多其他地方鸡种和新品种鸡不具备的优势,如觅食力强,产蛋量高,抗病力强,能适应高海拔、高湿度的恶劣环境等[3]。独龙鸡主要由当地农户饲养,鸡群多处于小范围的封闭状态,没有建立良种繁育体系,也缺乏系统的选种选育[3-4]。近年来,随着交通条件的改善和外地新品种的盲目引入,独龙鸡品种资源流失严重[5-6],对其优良的蛋品质等生产性状相关基因的挖掘和研究已成为家禽育种工作者的一项重要任务。
卵巢是鸡蛋形成的主要部位之一,是雌性动物调控生殖的最主要器官,卵巢产生的孕酮、雌二醇等类固醇激素不仅促进卵泡发育成熟和排卵,还参与机体的免疫调节过程[7-8],因此卵巢组织与蛋的形成及其他蛋品质等相关性状密切相关。白来航鸡产蛋量高且饲料消耗少,是我国蛋鸡生产的主要品种之一。目前,转录组测序(RNA sequencing,RNA-seq)在鸡重要经济性状候选基因鉴定方面的应用日渐成熟[9],但在独龙鸡上相对滞后,对独龙鸡蛋品质等相关性状候选基因的挖掘与鉴定研究更是空白。因此,本研究拟通过RNA-seq技术比较独龙鸡和白来航鸡卵巢组织的基因表达水平,以分析独龙鸡和白来航鸡的种质差异,为后续独龙鸡重要生产性状候选功能基因筛选、基因功能验证、品种改良和种质特性等研究奠定基础,为保护云南独龙鸡品种和开展分子育种改善独龙鸡蛋品质提供理论基础。
1 材料与方法
1.1 试验鸡群和样品采集
试验所用的种蛋由云南贡山县神山农业开发有限公司提供,种蛋在西南林业大学综合实训基地孵化,同一批次孵化的小鸡在同一条件下饲养,自由饮食采水。43周龄时观察到独龙鸡有连续的产蛋过程,随机选取3只健康状况良好的独龙鸡解剖并采集卵巢组织,编号为DL1、DL2、DL3,迅速投放入液氮罐中。
1.2 总RNA提取和质检
采用TRIzol法提取卵巢组织总RNA。使用Nanodrop 2000、Agilent 2100 bioanalyzer检测RNA浓度、纯度和完整度,以保障使用合格的样品进行转录组测序。提取的RNA样品浓度≥500 ng·μL-1,RIN值≥8且28S:18S≥1。
1.3 文库构建及测序
使用带有Oligo(dT)的磁珠富集mRNA,然后加入分离缓冲液(fragmentation buffer)将mRNA随机打断。以mRNA为模板,用六碱基随机引物(Random Hexamers)合成第一条cDNA链,然后加入缓冲液、dNTPs、RNase H和DNA Polymerase I合成第二条cDNA链,利用AMPure XP beads纯化cDNA。纯化的双链cDNA再进行末端修复、加A尾并连接测序接头。最后用AMPure XP beads选择文库插入的片段大小,并通过PCR富集得到cDNA文库。构建好的文库用q-PCR法准确定量,以保证文库有效浓度>2 nmol·L-1。当库检合格后,用Illumina高通量测序平台进行测序。
1.4 测序数据及其质量控制
测序完成后会产生大量的原始数据(raw data),使用Fastx_toolkit软件对这些原始数据进行过滤:去除含有接头的Reads,去除低质量的Reads(包括N比例大于10%的Reads和质量值Q≤10的碱基数占整条Read的50%以上的Reads),由此得到高质量的测序数据(clean data)。
1.5 转录组数据比对和组装
从NCBI网站上下载鸡的参考基因组序列(版本号:GCF_000002315.5),使用HISAT2(版本:2.0.4)将质控后的高质量数据比对到参考基因组上。比对分析完成后用StringTie对比对上的Reads进行组装和定量。
1.6 差异表达分析
以中国农业大学侯卓成课题组的相似饲养条件和周龄白来航鸡卵巢组织测序数据(https://trace.ncbi.nlm.nih.gov/Traces/sra/?run=SRR546478)为对照组,以本研究中独龙鸡样本为试验组进行差异表达分析。采用FPKM(Fragments Per Kilobase of transcript per Million fragments mapped)作为衡量基因表达水平的指标,将差异倍数(Fold change,FC)≥2且错误发现率(False Discovery Rate,FDR)<0.01作为筛选标准,使用DESeq2软件分析样品间的差异表达,获得差异表达基因集。试验组差异基因的表达水平高于对照组,为上调基因(up-regulated gene),否则为下调基因(down-regulated gene)。
1.7 差异表达基因富集分析
Gene Ontology(GO)分析是大规模基因功能富集研究中比较常用的方法,包含3个主要分支:生物学过程(biological process),分子功能(molecular function)和细胞组分(cellular component)。KEGG(Kyoto Encyclopedia of Genes and Genomes)存储了大量关于基因组学、生物途径、信号通路、疾病、药物和化学物质的数据。通过KEGG分析有助于把基因及表达信息作为一个整体,进一步解读基因的功能。差异表达基因的GO功能注释采用Wallenius非中心超几何分布的GOseq R包实现,KEGG通路分析采用KOBAS在线网站完成。以P<0.05和富集基因数为标准筛选差异表达基因显著富集的GO条目和KEGG通路。
1.8 差异表达基因蛋白互作网络分析
STRING(The Search Tool for the Retrieval of Interacting Genes)是收录多个物种预测的和实验验证的蛋白质-蛋白质互作的数据库(https://string-db.org/),包括直接的物理互作和间接的功能相关。为了更好的了解差异表达基因间的互作关系,使用STRING构建差异表达蛋白互作网络。提取的蛋白质-蛋白质相互作用对的互作得分>0.9。
1.9 实时荧光定量PCR(qRT-PCR)验证
选取13个差异表达基因,对独龙鸡和白来航鸡样本进行qRT-PCR验证,以检测测序结果及数据分析的准确性。以β-actin为内参基因,由北京擎科新业生物有限合成所需引物,序列见表1。扩增体系:2×ChamQ Universal SYBR qPCR Master Mix(Vazyme)10.0 μL,上、下游引物各0.4 μL(10 μmol·L-1),cDNA模板2.0 μL,7.2 μL水补足20 μL体系。扩增程序:95 ℃ 30 s;95 ℃ 10 s, 60 ℃ 30 s,40个循环。采用比较Ct值法,即2-ΔΔCT法计算基因相对表达量。采用Graphpad 8.0软件对每个基因的两组数据进行双尾非配对T检验,P<0.05 表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 测序数据产出统计
通过对43周龄独龙鸡和白来航鸡卵巢组织进行转录组测序,共获得24.04 Gb高质量数据,各样品高质量数据均达到2.02Gb,Q30碱基百分比在78.60%及以上,测得数据的总量和质量都满足后续分析的条件。分别将各样品的高质量序列与鸡的参考基因组序列进行比对,比对效率从77.84%到92.58%不等,具体结果见表2。各项数据表明测序产量和数据质量较好,可进一步分析。
2.2 差异表达基因筛选和富集分析
以白来航鸡为对照组,以|log2Fold Change |≥1,FDR<0.01为条件,共筛选出差异表达基因1 273个,其中上调基因522个,下调基因751个。两组样品中基因表达水平的差异以及差异的统计学显著性通过火山图显示(图1)。对独龙鸡和白来航鸡差异表达基因进行GO分析,发现在生物学过程中上调基因多注释到蛋白水解(GO: 0006508)、对革兰氏阴性菌的防御反应(GO:0050829)、对革兰氏阳性菌的防御反应(GO:0050830),而下调基因主要与翻译(GO:0006412)、基因表达的正向调控(GO:0010628)、细胞增殖的正向调控(GO:0008284)有关;在细胞组分中,上调基因多与胞外区有关,如细胞外泌体(GO:0070062)、细胞外空间(GO:0005615),而下调基因集中在膜表面,如膜(GO:0016020)、粘着斑(GO:0005925)、细胞表面(GO:0009986);在分子功能中,上调基因可显著注释到血红素结合(GO:0020037)、丝氨酸型肽链内切酶活性(GO:0004252),而下调基因主要与钙离子结合(GO:0005509)、核糖体的结构组成部分(GO:0003735)、转录因子结合(GO:0008134)有关,具体结果如图2所示。GO条目表明独龙鸡中上调差异基因主要参与免疫相关的生理生化过程,下调差异基因多与基因表达调控、蛋白质合成有关。
KEGG富集分析用于确定差异表达基因参与的主要生化代谢途径和信号通路。结果表明,差异表达基因在127个通路中富集,按P值由小到大筛选,前20条通路被展示出来(图3),其中7条通路显著富集(P<0.05),分别是核糖体(ko03010)、ECM(细胞外基质,extracellular matrix)-受体相互作用(ko04512)、氧化磷酸化(ko00190)、粘着斑(ko04510)、糖尿病并发症中的AGE-RAGE信号通路(ko04933)、产生IgA的肠道免疫网络(ko04672)、心肌收缩(ko04260)。
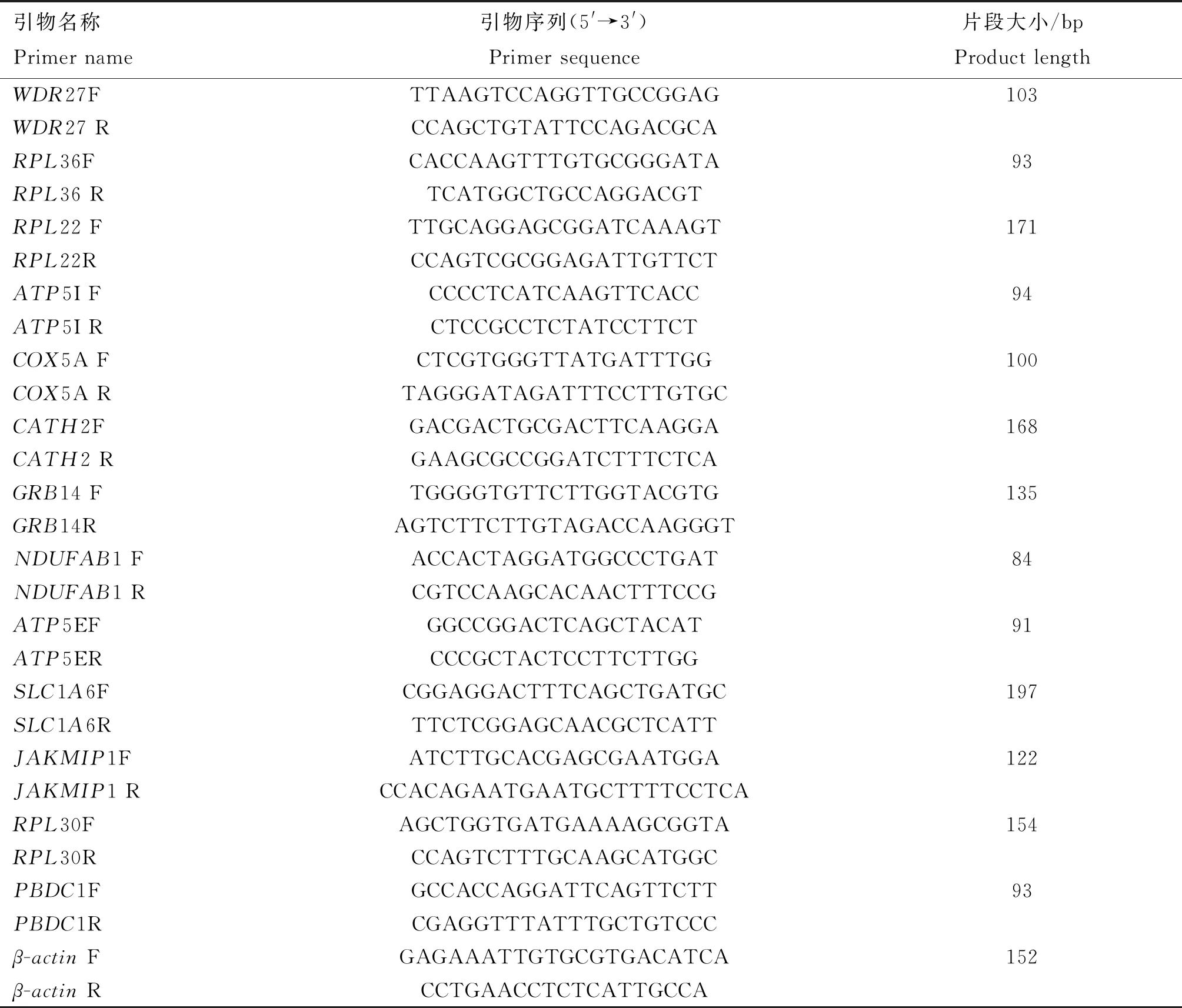
表1 差异表达基因的引物信息
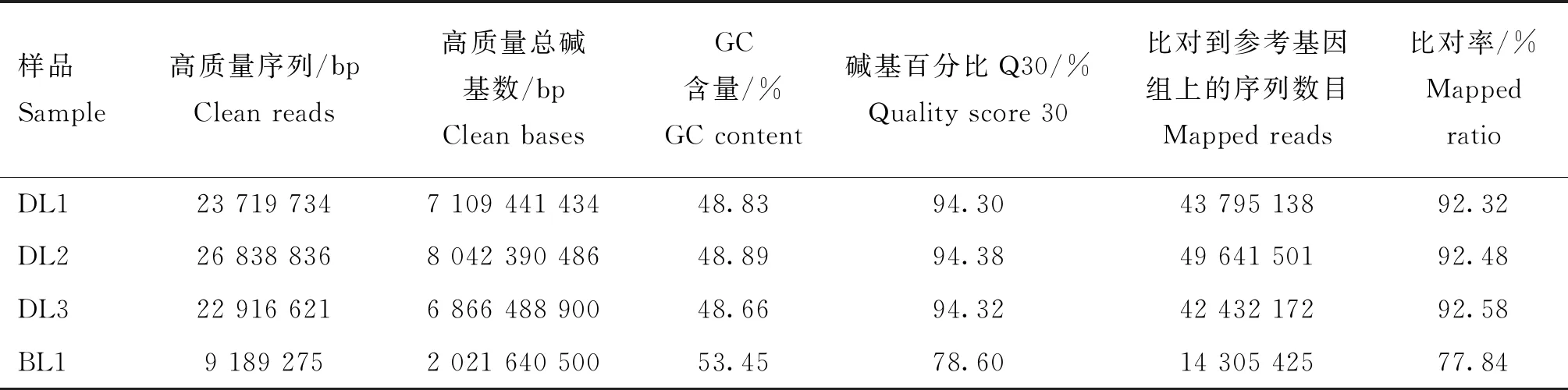
表2 测序数据质量分析
通过对差异基因的富集分析和文献检索,发现RPL22、RPL36、JAKMIP1涉及4个GO条目和1个KEGG通路,且与蛋白质合成有关,因此这些基因可能与蛋白重、蛋白高度、哈氏单位等蛋白品质相关;ATP5I、ATP5E、COX5A、NDUFAB1参与氧化磷酸化信号通路,卵泡的发育和成熟是一项复杂的耗能过程,因此这些基因可能与蛋重、蛋白重、蛋黄重等多种蛋品质有关。

图1 独龙鸡和白来航鸡卵巢组织的差异表达基因火山图Fig.1 The volcano plot of differentially expressed genes in ovarian tissues of Dulong chickens and White Leghorn chickens
2.3 差异蛋白互作网络分析
利用STRING数据库对差异表达的蛋白互作进行分析,结果显示,蛋白互作网络共有860个节点和1 124个相互作用(图4),其中,蛋白互作主要集中在RPS23、RPS2、RPL22、RPL30等核糖体组装的调控上。
2.4 差异表达基因qRT-PCR验证结果
结合富集分析和STRING蛋白互作结果,选取13个差异表达基因进行qRT-PCR验证,结果如图5所示。将测得的qRT-PCR数据与RNA-seq结果进行比较,发现13个基因的上下调趋势一致,表明转录组测序筛选出来的差异基因是可信的。相较于白来航鸡,CATH2、JAKMIP1、SLC1A6、WDR27在独龙鸡中显著上调,ATP5E、ATP5I、PBDC1、RPL22、RPL36、COX5A显著下调。GRB14、NDUFAB1、RPL30差异不显著。
3 讨 论
独龙鸡是我国云南少数民族独龙族饲养的独有地方品种,有关其种质特性和习性的研究相对欠缺,本研究利用转录组测序筛选独龙鸡和白来航鸡卵巢组织中的差异表达基因,然后利用生物信息学数据库分析差异表达基因参与的信号通路和生物学过程,探索独龙鸡的种质特性,为独龙鸡优良生产性状相关基因的挖掘和研究提供理论基础。
通过对差异表达基因进行GO功能注释,发现上调基因主要富集在生物学过程中的蛋白水解和免疫防御,细胞组分中的细胞外泌体,细胞外空间,以及分子功能中的结合活性。研究表明,蛋白水解在机体适应特殊环境中起着关键作用[10],蛋清蛋白及其水解产物具有抗菌、抗炎、抗高血压、抗血栓和免疫调节等多种生物活性[11-13],这些活性可能与独龙鸡对高海拔的恶劣环境有较强的的适应性有关。外泌体是细胞在一定条件下分泌的多囊泡体,是细胞间信号传递的重要工具[14]。大量研究表明,细胞外泌体不仅可通过转运细胞间抗原成分、杀伤性蛋白分子、炎症因子等免疫相关物质参与机体固有免疫的调节,还可通过介导抗原提呈过程增强机体适应性免疫应[14-15]。细胞外泌体相关基因如APAF1、BST1、CPQ、GALNT3等上调提示了相较于白来航鸡,独龙鸡有着较强的抗性,为独龙鸡的抗病育种研究提供了理论依据。
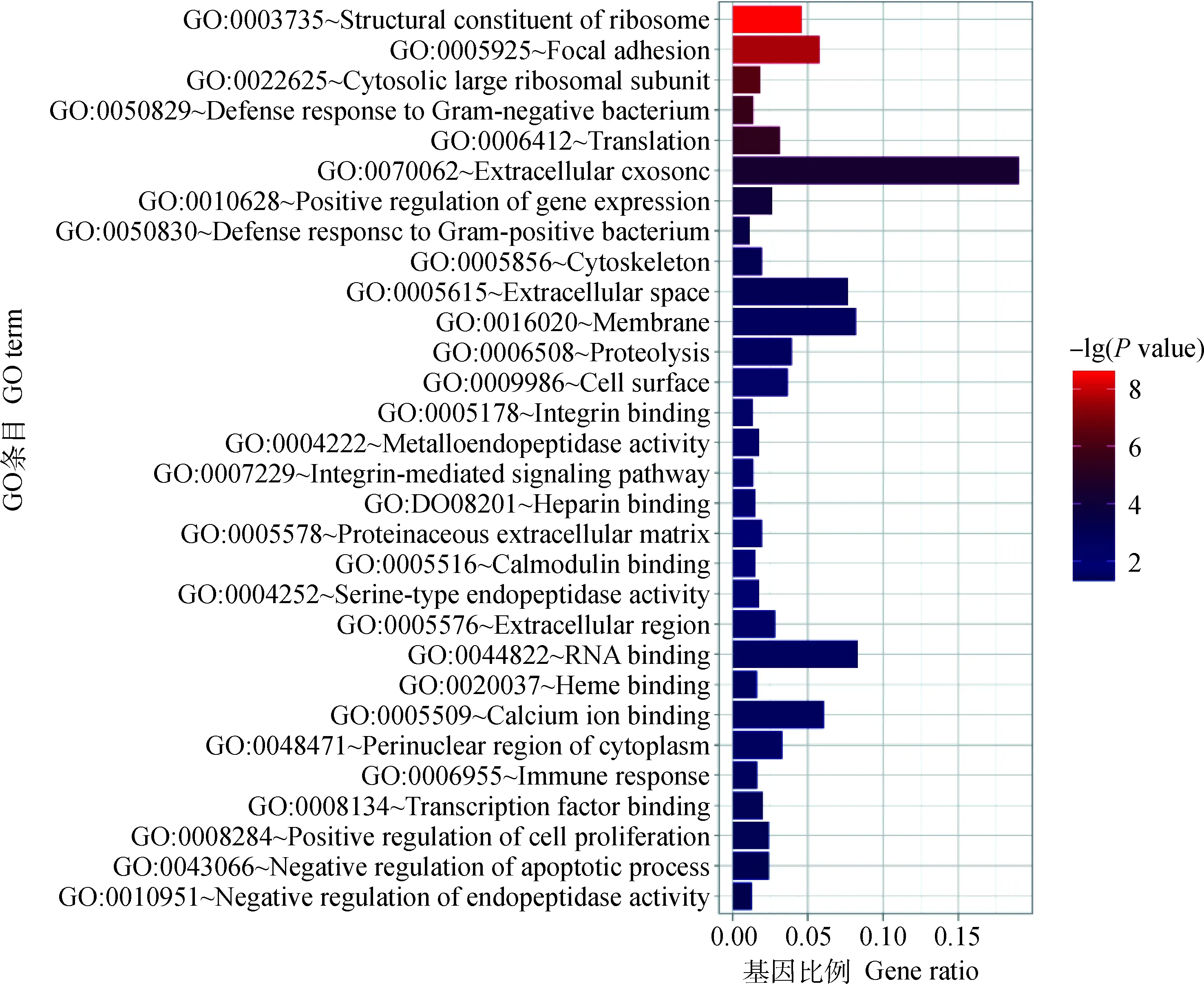
图2 独龙鸡和白来航鸡卵巢组织的差异表达基因GO富集分析Fig.2 GO enrichment analysis of differentially expressed genes in ovarian tissues of Dulong chicken and White Leghorn chicken
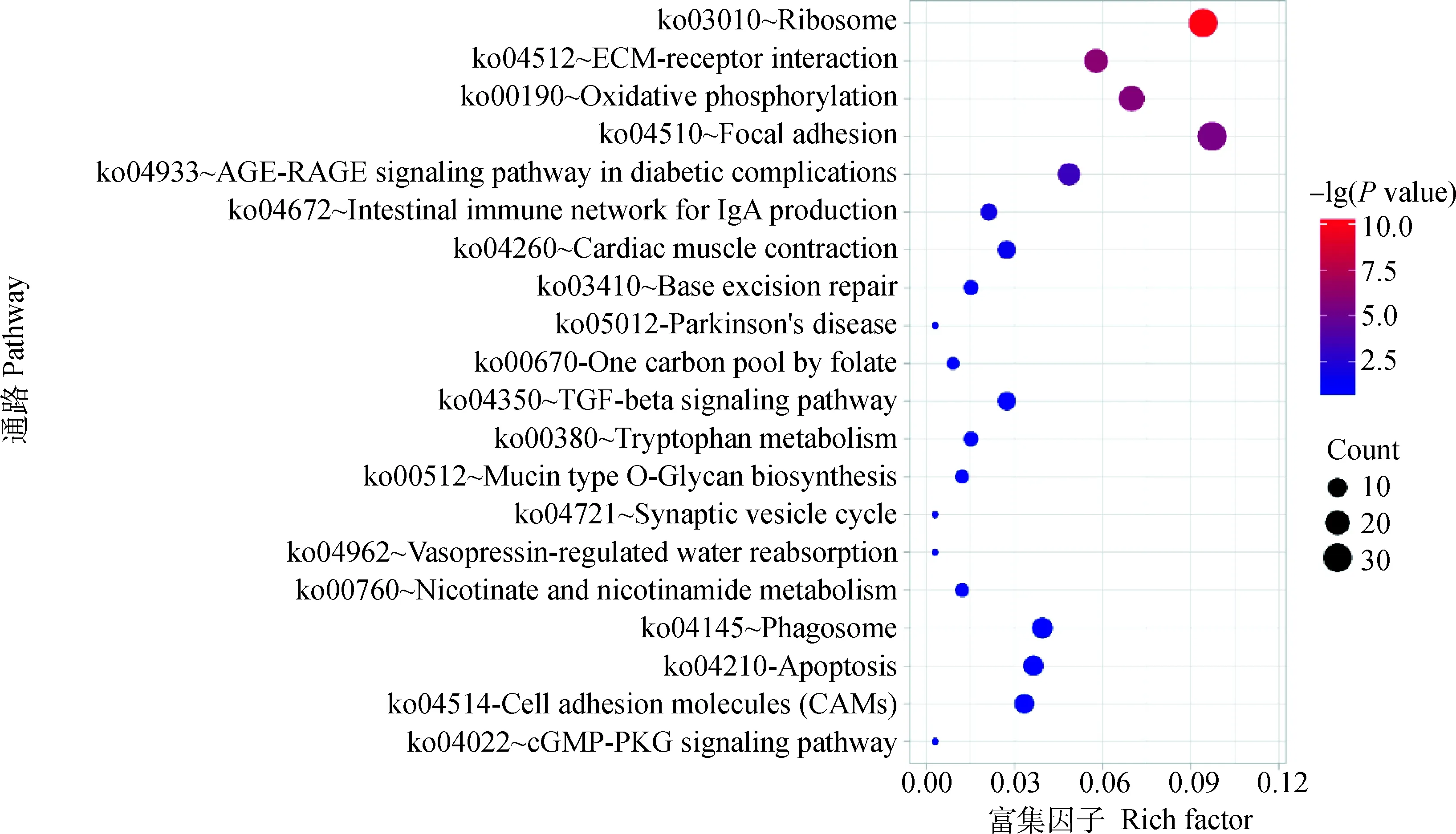
图3 独龙鸡和白来航鸡卵巢组织的差异表达基因KEGG通路分析Fig.3 KEGG pathway analysis of differentially expressed genes in ovarian tissues of Dulong chicken and White Leghorn chicken
KEGG通路富集分析显著性最可靠的是核糖体通路、ECM受体互作通路、氧化磷酸化通路和粘着斑等,研究表明这些信号通路与鸡的蛋品质和产蛋性能等性状有关[16]。蛋白是包裹在蛋黄周围的透明胶状物,主要由卵白蛋白、卵球蛋白、卵类黏蛋白和伴清蛋白组成[14]。输卵管膨大部含有很多核糖体,是蛋白质合成的主要部位[17]。膨大部的核糖体首先组装在mRNA上,然后沿着mRNA链翻译,合成的蛋白质包裹在卵黄的外面,由于输卵管的蠕动,包有蛋白质的卵也跟着旋转前进,逐渐形成卵黄外的浓、稀蛋白层,浓蛋白层越高,对应的哈氏单位值越大,蛋品质就越好[18]。在评价蛋品质高低的诸多性状中,哈氏单位是一个非常关键的性状,因此,核糖体通路很有可能与蛋白比例、蛋白高度、哈氏单位等蛋品质性状有关。细胞外基质是由数百种蛋白质组成的、分布在细胞表面或细胞间的大分子,这些大分子物质构成复杂的网架结构,为调节细胞生理活动和组织发育提供三维支持[19]。卵丘细胞外基质对卵丘的扩张和卵母细胞的成熟至关重要。当母鸡接近性成熟时,肝脏在雌激素的作用下逐渐合成和分泌卵黄前体,这些前体物质通过血液循环到达卵泡,并与卵母细胞表面的受体蛋白结合,从而通过胞吞作用进入卵细胞[20-21]。ECM为结合卵母细胞表面受体提供了细胞粘附结构域,从而导致细胞内信号传递[22]。因此,我们推测ECM受体互作、粘着斑极有可能与蛋黄重、蛋黄比例有关。氧化磷酸化是能量代谢通路,鸡卵母细胞生长完全依赖于卵黄提供营养成分,因此需要较高的能量代谢以确保足够的卵黄前体物质沉积到发育的胚胎中,维持产蛋过程[23]。本研究发现,相较于白来航鸡,独龙鸡在核糖体通路、ECM受体互作通路、氧化磷酸化通路上主要基因均以下调为主,RNA-seq结果显示RPS29、RPL22、RPL36的下调倍数在1.23~2.88之间,COL10A1、COL6A3、ITGA7的下调倍数在1.24~3.33之间,ATP5E、ATP5I、COX5A的下调倍数在1.94~2.19之间。独龙鸡和白来航鸡属两个不同类型品种,白来航鸡为著名蛋用型品种,性成熟早、无就巢性,产蛋量高[24],而独龙鸡为地方肉蛋兼用型品种,觅食力强,就巢性强[2]。白来航鸡为维持较高的产蛋能力有更高的基因表达量。本研究提示了可以通过分子育种手段从独龙鸡的核糖体通路和ECM受体互作等信号通路提高独龙鸡产蛋性能和蛋品质,同时也提示了独龙鸡作为优质的本地品种具有较大的遗传改良潜质。

图中的节点(node)为蛋白质,边(edge)为连接的两个节点间的互相作用关系。互作网络中节点的大小、颜色梯度(由红到绿)与此节点的度(degree)成正比,即与此节点相连的边越多,它的度越大,节点也就越大,对应的颜色也就越深(红)The node in the diagram is the protein and the edge is the interaction between the two nodes connected. The size and colour gradient (from red to green) of a node in an interworking network is proportional to the degree (degree) of this node, i.e. the more edges connected to this node, the greater its degree, the larger the node will be and the darker (red) the corresponding colour will be图4 独龙鸡和白来航鸡卵巢组织的差异蛋白互作网络分析Fig.4 Analysis of differential protein interaction network in ovarian tissue of Dulong chicken and White Leghorn chicken

图5 13个差异表达基因的qRT-PCR 验证Fig.5 qRT-PCR validation of seventeen selected genes that are differentially expressed
为验证差异基因在独龙鸡和白来航鸡上种质导致的表达差异,本研究筛选了13个差异基因进行验证。qPCR结果与测序结果一致。RPL22、RPL36是60S大核糖体亚基的蛋白质组成部分,Collart等[25]研究表明RPL22的突变可以改变蛋白质的合成效率。ATP5I、ATP5E是ATP合成酶的重要组成部分,与线粒体氧化磷酸化有关[26]。线粒体是真核细胞有氧呼吸的主要场所,为细胞增殖、迁移、生存提供所需能量,同时线粒体也与体内钙、铁平衡、凋亡、衰老等细胞活动有关[27]。Havlíckov等[26]研究表明,HEK细胞中ATP5E亚基的沉默导致ATP合成酶复合物的活性和含量降低。Wilde等[28]利用siRNA技术敲低ATP5I的表达后发现低PH环境能通过影响ATP合成酶增加线粒体ATP(mitochondrial ATP,mtATP)从线粒体基质中输出,这意味着当处于应激条件时,机体可得到最大能量供应以支撑抗逆境需求,这也解释了独龙鸡为什么能在高寒缺氧的恶劣环境生存并维持一定的产蛋能力。Xiao等[29]也指出了COX5A是参与线粒体电子传输的末端氧化酶的核编码亚基,与能量合成有关。CATH2是抗菌肽家族的一员,研究表明抗菌肽不仅能抑制和杀灭病源微生物,还具有多种免疫调节活性[30]。蛋壳是鸡蛋抵御微生物入侵的主要屏障,蛋壳品质的好坏与鸡蛋储存时间和破损率有关,蛋壳品质越差,鸡蛋变质速度越快。研究表明:禽类CATH2具有与哺乳动物抗菌肽相似的保守信号肽和cathelin结构域,且在呼吸道、胃肠道、淋巴器官、生殖器官等多种组织中均有表达[31],因此该基因可能与蛋壳品质有关。赵净颖等[32]也证实了CATH2表达量的鸡种具有更高的免疫机能。JAKMIP1是一种与JAK激酶和微管相互作用的蛋白质,在JAK家族介导的信号通路中起着重要作用[33-34]。当细胞因子与受体结合后,受体上JAK激酶构象改变并磷酸化,招募下游转录因子STAT磷酸化,使其以二聚体的形式进入细胞核调节目的基因表达[34]。研究表明,JAK-STAT信号通路参与细胞增殖,分化、迁移和凋亡等过程,对机体免疫防御,乳腺发育和泌乳,脂肪形成,两性生长至关重要[35]。Zhang等[36]研究发现JAK-STAT信号通路参与鸡生殖细胞体内分化过程,尤其是对雄性生殖细胞的早期形成具有重要调控作用。Richard等[37]指出激活的JAK-STAT可通过影响AOX、FAS等酶的表达直接调节脂质代谢,在本研究中,JAKMIP1显著上调,意味着独龙鸡卵母细胞中可能沉积了更多的卵黄物质。本研究表明,ATP5I、ATP5E、COX5A、NDUFAB1、JAKMIP1、CATH2等可能在调节独龙鸡蛋品质相关性状和免疫反应中起着重要作用,可作为重要的候选基因进行深入研究。
4 结 论
本研究首次利用RNA-seq技术分析了独龙鸡和白来航鸡的基因表达差异,然后通过富集分析工具GO、KEGG、STRING数据库筛选了独龙鸡和白来航鸡卵巢组织差异表达基因,其中RPL22、ATP5I、COX5A、JAKMIP1、CATH2基因主要富集在抗性、产蛋性能和蛋品质相关通路中,可进一步深入研究。本研究为独龙鸡后续基因功能、品种改良和种质特性等研究奠定了基础。
