mDIXON-Quant技术评估中老年女性骨质量的临床研究
2022-03-08唐睿汤光宇涂云张雪丽季锐华婷诸静其
唐睿 汤光宇 涂云 张雪丽 季锐 华婷 诸静其
同济大学附属第十人民医院放射科,上海 200072
骨质疏松症(osteoporosis, OP)是一种以骨量减少、骨强度降低、易导致脆性骨折为特征的全身代谢性疾病。随着人口老龄化的加剧,OP已成为影响中老年人健康的主要疾病之一。目前,对于临床诊断OP的金标准-双能X线吸收测量仪(dual-energy X-ray absorptiometry, DXA)不能准确诊断OP以及预测脆性骨折已有大量报道,故寻找新的影像学标志物、准确评估OP已成为国内外研究的热点。
虽然目前对OP的病理发生机制尚未达成共识,但国内外学者普遍认为骨髓脂肪含量的变化能够影响骨强度,并与脆性骨折的发生关系密切[1-2],既往针对骨髓脂肪的研究主要依赖于质子磁共振波谱(proton magnetic resonance spectroscopy,1H-MRS),通过测量骨髓脂肪分数(fat fraction, FF)定量脂肪,但1H-MRS扫描时间长,后处理复杂,导致其在骨骼系统中的应用受限。目前有关骨髓脂肪定量技术的研究已逐渐转向水脂分离技术,其中应用较为广泛的主要包括Philips公司的mDixon-Quant技术和GE公司的IDEAL-IQ技术。本研究拟采用DXA和定量CT(quantitative CT, QCT)分别测量面积和体积骨密度(bone mineral density, BMD)并运用mDixon-Quant技术测量骨髓脂肪含量及铁负荷,旨在探讨不同骨量中老年女性骨髓脂肪含量及铁负荷的差异,同时分别以DXA、QCT为诊断标准,比较mDIXON-Quant技术对骨量下降的诊断效能。
1 资料与方法
1.1 资料
研究对象为同济大学附属第十人民医院体检科患者,纳入标准:①年龄≥40岁的中老年女性;②自愿参加腰椎DXA、QCT和MRI检查。排除标准:①既往患有骨代谢异常疾病,如甲状旁腺功能亢进、糖尿病、库欣综合征、肾性骨营养不良;②服用影响骨代谢药物,如皮质类固醇、降钙素、维生素D、双膦酸盐、雌激素等;③既往患有腰椎压缩性骨折;④有恶性肿瘤及放疗史者;⑤卧床超过1周以上;⑥患有严重抑郁症、精神分裂症等精神疾病或长期服用抗精神病药物,患有幽闭恐惧症等无法进行磁共振检查者。最终纳入研究对象126名,年龄40~78岁,平均(57.44±8.05)岁。本研究经同济大学附属第十人民医院伦理委员会批准(批件号:SHSY-IEC-4.1/18-200/01)并在中国临床试验注册中心注册(注册号:ChiCTR-IPR-16009416、ChiCTR1900024511),所有研究对象均签署知情同意书。
1.2 方法
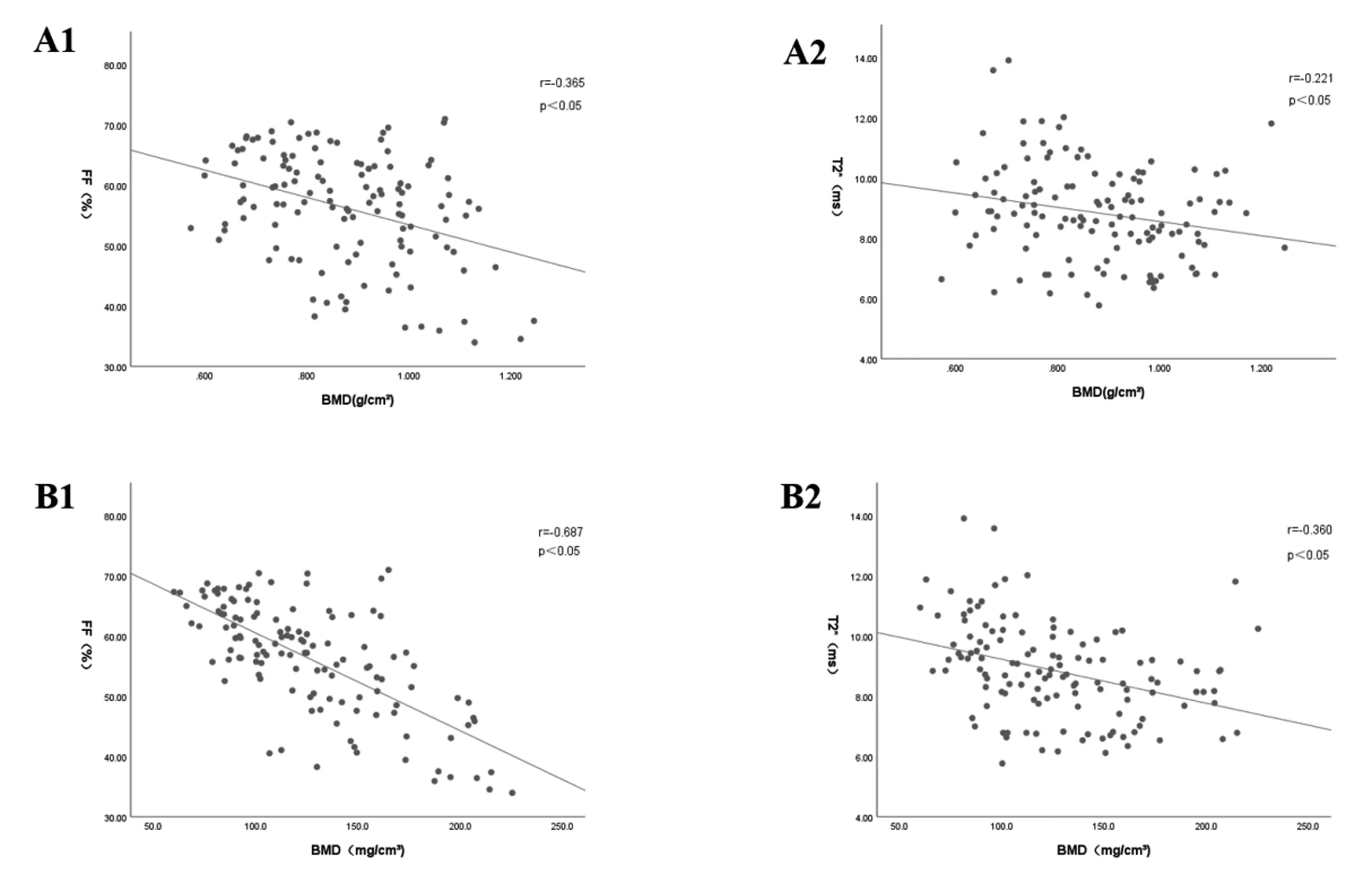
1.2.1DXA检查:采用美国HOLOGIC公司DXA骨密度测量仪(QDR4500),每天检查前进行质量校正,扫描参数:电压 76 kV,电流 3.0 mA,扫描长度 20.2 cm,扫描宽度 18.0 cm。依据骨量的DXA诊断标准,测量受试者腰1~4各椎体松质骨的面积BMD(单位为g/cm2),取均值并记录T值。根据WHO推荐的标准差诊断法,将受试者分为骨量正常组(T≥-1.0 SD)、骨量减少组(-2.5 SD 1.2.2QCT检查:采用德国Siemens公司双源CT(Somatom Force)扫描仪和Mindways公司质控体模(Mindways Software Inc, Austin, USA)。扫描参数:电压 120 kV,电流 100 mAs,螺距 0.984∶1,层厚 5 mm,FOV 320 mm×320 mm。扫描范围从 L1椎体上缘至L5椎体下缘。扫描后,重建1.50 mm层厚,将数据传至QCT PRO 工作站,采用QCT PRO5.10软件(Mindways Software Inc, Austin, USA),通过横断面、冠状面、矢状面绘制感兴趣区(region of interest, ROI),依据骨量的QCT诊断标准,测量L1~3椎体体积BMD(单位为mg/cm3),取平均值,根据QCT测得的BMD,将受试者分为骨量正常组(≥120 mg/cm3)、骨量减少组(80~120 mg/cm3)和OP组(≤80 mg/cm3)[3]。 1.2.3MRI检查:采用Philips公司3.0 T MR(Ingenia)扫描仪,16通道相控阵脊柱线圈,行腰椎自旋回波矢状位T1WI(TR 400 ms, TE 9 ms)、快速自旋回波矢状位T2WI(TR 2 000 ms, TE 90 ms)以及快速自旋回波矢状位T2W/SPAIR(TR 2 500 ms, TE 80 ms)扫描,矩阵256×256,层厚4 mm,排除炎症和占位性病变后再进行腰椎矢状位mDIXON-Quant扫描,扫描参数:TR 5.6 ms, TE 0.95 ms,层厚 2 mm,反转角3°,6个梯度回波,回波间隔时间1.3 ms, FOV 400 mm×350 mm×230 mm,三维图像分辨率 2.50 mm×2.50 mm×6.00 mm,敏感度编码2,NSA 1次,扫描结束后,系统自动生成水相、脂肪相、同相位、反相位、FF图以及T2*图,在机器自带的ISP V7工作站测量矢状位中央层面L1~5椎体松质骨的FF以及T2*值,ROI的大小、形状和位置与QCT测量所用矢状位ROI保持一致,取平均值。 1.2.4测量值的重复性评估:在研究对象中随机抽取30例,由甲、乙两名经培训合格的放射诊断医师采用同一方法分别进行测量,1周以后甲医师再次使用同一方法重复测量一次,分别采用组内相关系数检验一致性好以后,所有的数据改由甲医师独立测量。 应用SPSS 25.0软件进行统计学分析,对DXA、QCT、MRI检查的参数进行正态性检验,经检验符合正态分布,以均数±标准差表示。采用单因素方差分析(one-way ANOVA)比较三组间BMD(DXA/QCT)、FF以及T2*值的差异。使用Kappa值检验DXA与QCT对低骨量诊断的一致性,≤0.4为一致性差,0.4~0.75为一致性一般,≥0.75为一致性好。采用Pearson相关分析进行FF、T2*值与BMD(DXA/QCT)间的相关性分析。绘制受试者工作特征曲线(receiver operating characteristic curve, ROC),计算曲线下面积(area under curve, AUC),分析比较FF和T2*值对低骨量的诊断效能。P<0.05为差异有统计学意义。采用组内相关系数(intraclass correlation coefficient, ICC)评价两名测量者及同一名测量者2次测量值的可重复性,ICC越接近1表明结果的一致性越好。 测量者对腰椎BMD、FF、T2*值重复性检验结果见表1。甲、乙两名测量者间及甲测量者二次测量间ICC一致性较好(>0.80)。 以DXA测得的BMD进行分组比较(DXA分组):骨量正常组、骨量减少组和OP组的BMD、FF以及T2*值见表2,骨量正常组与OP组FF和T2*值、骨量减少组与OP组FF比较差异有统计学意义(P<0.05)。以QCT测得的BMD进行分组比较(QCT分组):骨量正常组、骨量减少组和OP组的BMD、FF以及T2*值见表3,骨量正常组与骨量减少组、骨量正常组与OP组FF及T2*值比较差异有统计学意义(P<0.05)。DXA与QCT对低骨量(DXA:T<-1.0 SD;QCT:BMD<120 mg/cm3)诊断的一致性评分Kappa值为0.462。 表2 各组FF、T2*值和BMD(DXA)比较 表3 各组FF、T2*值和BMD(QCT)比较 DXA分组相关性分析:FF与BMD呈负相关(r=-0.365,P=0.000;校正年龄因素后r=-0.205,P=0.022),T2*值与BMD呈负相关(r=-0.221,P=0.013;校正年龄因素后r=-0.205,P=0.022),见图1A1、图1A 2;QCT分组相关性分析:FF与BMD呈负相关(r=-0.687,P=0.000;校正年龄因素后r=-0.497,P=0.000),T2*值与BMD呈负相关(r=-0.360,P=0.000;校正年龄因素后r=-0.393,P=0.000),见图1B1、图1B2。 图1 DXA与QCT分组中FF、T2*与BMD的相关性分析Fig.1 Correlation analysis of FF, T2* and BMD in DXA and QCT groups 注:A1:DXA分组中,FF与BMD的Pearson相关性分析图;A2:DXA分组中,T2*与BMD的Pearson相关性分析图;B1:QCT分组中,FF与BMD的Pearson相关性分析图;B2:QCT分组中,T2*与BMD的Pearson相关性分析图。 分别对DXA分组及QCT分组进行ROC曲线分析:以低骨量(DXA分组:T<-1.0 SD;QCT分组:BMD<120 mg/cm3)为诊断阳性。DXA分组中单独使用FF进行诊断分析,AUC=0.625;单独使用T2*进行分析,AUC=0.631;联合应用FF、T2*分析,AUC=0.657。QCT分组中单独使用FF进行诊断分析,AUC=0.799;单独使用T2*进行分析,AUC=0.700;联合应用FF、T2*分析,AUC=0.813。见表4、表5、图2、图3。 表4 DXA分组FF、T2*的ROC曲线分析Table 4 ROC curve analysis of FF and T2* in DXA groups 表5 QCT分组FF、T2*的ROC曲线分析Table 5 ROC curve analysis of FF and T2* in QCT groups 图2 DXA分组中FF、T2*、FF+T2*的ROC曲线Fig.2 FF, T2*, FF+T2* ROC curves in DXA groups 图3 QCT分组中FF、T2*、FF+T2*的ROC曲线Fig.3 FF, T2*, FF+T2* ROC curves in QCT groups 采用BMD评估骨骼改变不能完全反映骨骼的生物力学特征,对OP诊断和预测脆性骨折仍有局限性[4]。有研究[5-7]指出,骨髓脂肪含量的增高使骨量减低且早于骨量改变。同时,近年研究[8-9]发现铁蓄积也可能是OP发生的独立危险因素,铁离子使氧化应激增加致成骨、破骨前体细胞分化异常,过量的铁沉积还能通过促进I型胶原蛋白降解从而降低BMD,目前检测铁沉积的最佳方法是T2*MRI技术,已被广泛应用于肝脏、心脏,但在骨骼方面应用较少,已报道的少量研究[10]显示T2*值与BMD之间存在一定负相关。mDixon-Quant技术作为改良的水脂分离技术,已证实与1H-MRS所测得的FF值有较强的相关性[11-12]。因此,mDixon-Quant技术替代1H-MRS定量骨髓脂肪具备可行性。 采用MRS测量骨髓脂肪含量的研究[13-14]发现随着BMD的减低,FF逐渐升高,二者呈负相关。几项使用mDixon-Quant和IDEAL-IQ技术的研究[15-17]也指出FF、T2*值均与BMD呈负相关。本研究使用的两种骨量诊断方法得出的结果均显示随着BMD的降低,FF与T2*值逐渐升高,在校正年龄因素后,FF、T2*值与BMD仍呈负相关,与上述研究报道一致。在以DXA为标准分组时,本研究结果显示FF、T2*值与BMD仅呈弱负相关(r值分别为-0.365、-0.221)。Li等[16]的研究结果同样显示FF与BMD的相关性较弱(r=-0.459)。而翟树佳等[18]使用同样方法得出了FF、T2*值与BMD的相关性较强(r值分别为-0.628、-0.468)的结论,造成差异的原因可能是前者以单个椎体测量,并且研究对象的平均年龄也较高。本研究使用QCT为标准进行诊断分组后,FF与BMD的相关性显著升高(r=-0.687),在校正年龄因素后r=-0.497,稍低于相关研究的结果[17,19],造成差异的可能原因是本研究人群仅限于中老年女性,由于受雌激素显著下降的影响,女性在绝经后BMD与骨髓脂肪含量的变化明显不同于男性[20]。Griffith等[21]指出60岁以上的女性,骨髓脂肪含量显著高于同龄男性。张勇等[22]的研究也证实女性50岁后骨髓脂肪含量的增加速度加快,高于同龄男性,60岁后BMD的下降速度加快,低于同龄男性。 本研究对BMD测量同时使用了DXA与QCT两种技术,DXA作为一种传统的测量方法,具备辐射少、方便快捷等优点,但DXA测量的BMD为面积BMD,易受骨质增生、椎前血管钙化等因素影响,造成测量结果较实际偏高,出现假阴性现象。Li等[23]以DXA和QCT对绝经后妇女OP检出率做过相关研究,显示DXA和QCT的检出率分别为17.1%、46.4%,两者间存在显著性的差异,并且部分DXA诊断为阴性而QCT阳性的患者已出现椎体压缩性骨折。因此,根据既往的研究推测,DXA诊断的低骨量敏感性将会低于QCT,但本研究中QCT诊断低骨量敏感性反而低于DXA,通过文献复习推测腹部脂肪堆积很可能是造成这一现象的原因,Yu等[24]在模拟体脂增加对DXA和QCT的测量影响时发现,在添加脂肪层后,降低了DXA测量的脊柱BMD值,同时增加了QCT测量的脊柱BMD值,并且与既往研究相比,DXA的准确性降低了1~2倍,但对QCT的影响很小。由于大部分中老年女性存在腹部脂肪堆积,更易产生测量误差。与DXA相比,QCT测量的体积BMD减少了骨质增生、钙化等因素的影响,对OP的诊断更加准确,但也增加了辐射剂量。本研究分别以DXA和QCT测得的低骨量为标准,对mDixon-Quant技术参数进行诊断效能分析,目前尚未见相关文献报道。DXA分组FF、T2*值的AUC分别是0.625、0.631,诊断效能一般,与翟树佳等[18]的结果(FF、T2*的AUC分别为0.82、0.79)相比,相差较大,但用测量单个椎体的各项参数来反映腰椎骨质量的变化这一方法存在较大误差,因此笔者推测出现差异的原因可能与诊断标准以及研究椎体不一致有关。本研究QCT分组FF、T2*值的AUC分别是0.799、0.700,诊断效能明显提高,与报道的结果接近[17,19],且诊断效能优于DXA,同时也发现单独应用FF可获得较好的诊断效能,而单独应用T2*效果不佳。Wu等[10]也指出,T2*与BMD之间的相关性并不理想,对骨质量的评估价值有限,联合FF与T2*值能更准确的反映骨强度变化。FF、T2*值与BMD的相关性提示骨髓脂肪含量增加关联骨量减少,这可能与骨髓间充质干细胞向成骨细胞和脂肪细胞分化紊乱密切相关,联合过量铁沉积促进破骨作用,共同导致BMD降低。本研究显示骨量减少的同时伴随FF与T2*不同程度的增加,ROC曲线显示了FF与T2*在鉴别骨量正常与骨量减少时各项参数均处于较高水平,提示依靠FF与T2*临界值能够较好地预测骨量正常与骨量减少患者,可作为筛查低骨量人群潜在的影像学检测指标,同时也为OP治疗和疗效随访的提供靶点。 当然,本研究也存在以下不足之处:①研究样本相对较小;②由于QCT诊断的OP人数过少,故将骨量减少组与OP组合并为低骨量组进行ROC曲线分析,未对mDixon-Quant测量参数诊断OP进行单独的ROC曲线分析;③本研究数据为初步结果,目前入组患者尚在随访中,所需时间较长,mDixon-Quant的临床价值有待随访结果验证。 综上所述,mDixon-Quant技术作为一项快速、简便、无创的检查方法,能够同时定量腰椎椎体的FF与T2*值,反映椎体骨质量的变化,克服单一骨量评估OP的不足,其评估以QCT为标准的低骨量的效能优于DXA,联合应用QCT与mDIXON-Quant技术能更好地综合评估中老年女性骨强度,有望为临床提供较理想的筛查、治疗和随访OP的靶点。1.3 统计分析
2 结果
2.1 测量值重复性检验
2.2 不同骨量组间FF以及T2*值的比较


2.3 FF、T2*值与BMD相关性分析
2.4 FF、T2*值诊断效能分析




3 讨论
