二苯乙烯苷调控miR-34a/SIRT1对骨质疏松大鼠的作用及机制研究
2022-03-08王奇杨鹏孙建军姚绍华
王奇 杨鹏 孙建军 姚绍华
萍乡市第二人民医院骨科,江西 萍乡 337000
骨质疏松症(osteoporosis,OP)是多发于老年及绝经后妇女的一种以骨量减少、骨结构异常及骨脆性增加为特征的代谢性骨骼疾病,可导致骨折,严重影响患者生命健康[1-2]。研究[3]发现,氧化应激可导致成骨细胞凋亡、减弱成骨分化,与OP患者骨密度及骨量减少关系密切。研究[4]报道,何首乌中有效成分-二苯乙烯苷(tetrahydroxy stilbene glycoside,TSG)具有较好的抗氧化应激作用,能通过降低成骨细胞氧化应激水平来抵抗成骨细胞凋亡,这预示TSG可能对OP骨丢失有一定的治疗作用,但其作用机制还不明确。微小RNA(microRNA,miRNA)是骨骼代谢的重要调节剂,研究[5]发现在骨密度(bone mineral density, BMD)异常降低的老年人体内miR-34a水平显著高于正常成年人,且miR-34a也可靶向调控沉默信息调节因子1(silent information regulator 1,SIRT1)表达来调控细胞氧化应激、衰老及凋亡等多种生理过程[6]。但miR-34a/SIRT1是否能通过调控氧化应激及凋亡作用,来缓解OP患者骨密度降低及骨丢失进程,目前还研究较少。本研究将通过体内与体外实验相结合,探讨二苯乙烯苷(TSG)调控miR-34a/SIRT1对骨质疏松大鼠的作用及机制,为TSG的开发应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1实验动物及细胞:SPF级SD雌性大鼠60只,体重200~220 g,6~7周龄,购自北京唯尚立德生物科技有限公司,动物生产许可证号为:SCXK(京)2016-0009,动物使用许可证号为:SYXK(京)2017-0016,动物质量合格证号为:K501397。本试验符合3R原则并经萍乡市第二人民医院伦理委员会批准。小鼠成骨前体细胞MC3T3-E1购自上海冠导生物工程有限公司,批号:GD-C18518572。
1.1.2主要试剂及仪器:TSG(南京泽朗生物科技有限公司,原料药,纯度≥98%,批号:BW1537);miR-34a过表达载体溶液、miR-34a过表达阴性载体溶液(北京索莱宝科技有限公司,批号:SL1048、SL1050);丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒、Trizol试剂、反转录试剂盒、荧光定量PCR试剂盒(北京伊塔生物科技有限公司,批号:SY6488、SY6454、SY3017、SY0209、SY7003);蛋白提取试剂盒、BCA蛋白测定试剂盒、苏木素-伊红(HE)染色试剂盒、Hoechst33258染色液(上海爱必信生物科技有限公司,批号:abs9217、abs5002、abs7114、abs4018);碱性磷酸酶(ALP)、骨桥蛋白(OPN)、骨钙蛋白(OCN)、SIRT1、β-actin单克隆抗体、羊抗鼠二抗(美国abcam公司,批号:ab186421、ab63856、ab92876、ab189494、ab109937、ab110035);小动物显微CT(Micro-CT)系统(广州中科恺盛医疗科技有限公司,型号:ZKKS-MCT-SHARP);实时荧光定量PCR仪(苏州雅睿生物技术有限公司,型号:MA-6000);凝胶成像仪(美国伯乐公司,型号:SYSTEM GelDoc XR+);光学显微镜、荧光显微镜(上海蔡康光学仪器有限公司,型号:DMM-300 D、XSP-13CC)等。
1.2 方法
1.2.1大鼠OP模型建立及分组给药:大鼠参照文献[7]摘除双侧卵巢建立OP模型,并于手术后一周,随机取两只大鼠股骨远端标本,参照文献[8]方法对大鼠股骨进行Micro-CT扫描,若大鼠出现骨结构断裂,骨量减少现象视为造模成功。共造模成功50只大鼠,随机分为模型组、TSG组(80 mg/kg)、miR-34a过表达(miR-34a-agomir)组(4 nmol/kg)、TSG+miR-34a-agomir组(80 mg/kg+4 nmol/kg)、miR-34a过表达阴性对照(antagomir-NC)组,每组10只。另取10只大鼠只暴露卵巢,不摘除,其余同模型组,视为假手术组。TSG参照文献[9]设置剂量,并用生理盐水溶解成浓度为8 mg/mL的溶液,按10 mL/kg的剂量灌胃给药,1次/d,miR-34a-agomir及antagomir-NC组参照文献[5]设置剂量,经尾静脉注射给药,1次/周;TSG+miR-34a-agomir组灌胃给予TSG同时,经尾静脉注射给予相应剂量miR-34a-agomir;模型组及假手术组给予相应剂量的生理盐水。各组连续给药3个月。
1.2.2大鼠血液标本及股骨远端标本采集:各组大鼠末次给药,禁食禁水12 h后,麻醉取腹主动脉血6 mL,于3 000 r/min、4 ℃条件下离心20 min,取上清液置于无酶EP管中- 80 ℃保存备用。断头处死大鼠,取大鼠左右两后肢股骨,仔细分离并剔除骨组织周围的肌肉和软组织,左侧股骨用生理盐水纱布包裹后,于- 80 ℃保存备用,右侧股骨标本用医用纱布包裹后,置入10倍体积的4 %多聚甲醛中固定备用。
1.2.3大鼠血清MDA、GSH-Px水平检测:取大鼠血清标本,于4 ℃条件下解冻后,按MDA、GSH-Px试剂盒说明书方法检测血清中MDA、GSH-Px水平。
1.2.4实时荧光定量聚合酶链式反应(qRT-PCR)检测大鼠血清miR-34a相对表达水平:取先前在- 80 ℃冰箱中保存的血清标本,在4 ℃冰箱中解冻后,于3 000 r/min、4 ℃条件下再次离心20 min后,用Trizol试剂提取总RNA并以总RNA为模板,反转录cDNA。取cDNA,按荧光定量PCR试剂盒说明书和PCR仪进行扩增,共进行50个循环:90 ℃ 100 s(1个循环),95 ℃ 20 s、50 ℃~55 ℃ 50 s、72 ℃ 50 s(40个循环),72 ℃ 100 s(1个循环)后终止反应。miR-34a以U6为内参,采用2-ΔΔCt法计算miR-34a相对表达水平。引物由生工生物工程(上海)股份有限公司合成,引物设计见表1。
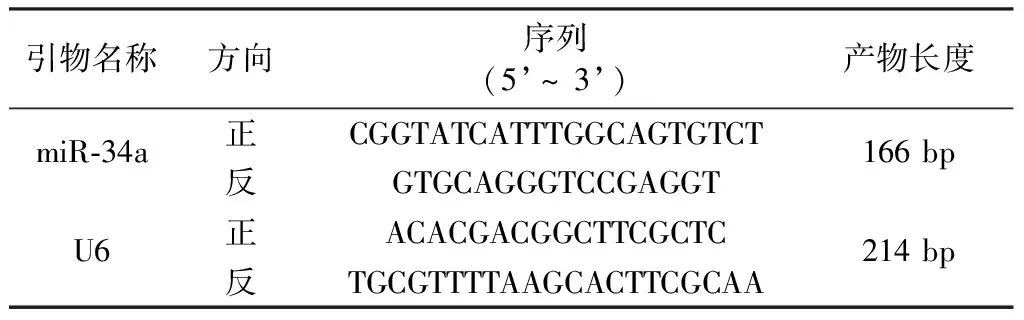
表1 qRT-PCR引物序列Table 1 Primer sequence of qRT-PCR
1.2.5蛋白免疫印迹(WB)法检测血清SIRT1蛋白相对表达水平:取先前在- 80 ℃冰箱保存的血清标本,在4 ℃冰箱中解冻后,用蛋白提取试剂盒提取蛋白,并用BCA试剂盒测定蛋白浓度,取25 μg蛋白进行电泳、转膜反应及封闭液封闭后,加入一抗[SIRT1(稀释倍数1∶500)、β-actin内参(稀释倍数1∶1 000)]孵育过夜后,加入羊抗鼠二抗(1∶2 000)在37 ℃条件下孵育3 h后,用增强化学发光法显色,以凝胶成像仪观察条带并拍照,并以Image-J软件分析各组蛋白相对表达水平。
1.2.6HE染色及Micro-CT法检测股骨组织结构变化:取右侧后肢股骨远端标本,进行螯合剂乙二胺四乙酸(EDTA)脱钙、脱水、透明、石蜡包埋后,切成厚度为5 μm切片,按HE试剂盒说明书进行染色、封片后置于显微镜下观察病理变化。取左侧股骨远端标本,按照文献[8]方法对大鼠股骨进行Micro-CT 扫描,并计算骨连接密度(Conn.D)、骨小梁数量(Tb.N)、骨小梁分离度(Tb.Sp)、BMD等指标。
1.2.7成骨细胞培养及分组处理:参照文献[4]取成骨前体细胞MC3T3-E1用α-MEM培养基于孵箱里培养、胰蛋白酶消化处理后,接种到6孔板中,并分为对照组、过氧化氢(H2O2)处理组、TSG组、miR-34a-mimic组、miR-34a-NC组、TSG+miR-34a-mimic组,对照组不做任何处理正常培养外,其余各组均加入300 μmol/L H2O2处理24 h,TSG组在H2O2处理组基础上加入终浓度为10 μmol/L的TSG进行培养,miR-34a-mimic组及miR-34a-NC组分别转染miR-34a激动剂及其阴性对照试剂,TSG+miR-34a-mimic组在TSG组基础上转染miR-34a-mimic试剂,各组均转染培养24 h。
1.2.8Hoechst33258染色观察细胞凋亡情况:取1.2.7项下的各组细胞,参照文献[4]方法,取细胞用4 %多聚甲醛固定后加5 mg/L Hoechst33258染液染色、甘油封片后,于荧光显微镜下观察细胞凋亡状态。
1.2.9qRT-PCR及WB法检测各组细胞miR-34a及SIRT1、ALP、OPN、OCN蛋白表达:取1.2.7项下的各组细胞,用Trizol抽提法提取细胞中总RNA后,按1.2.4项下方法检测细胞中miR-34a表达。取1.2.7项下的各组细胞,用蛋白裂解液裂解、蛋白提取试剂盒提取蛋白、BCA法检测蛋白浓度后取20 μg进行电泳及转膜反应后,加入一抗[SIRT1、ALP、OPN、OCN(稀释倍数均为1∶1 000),β-actin内参(稀释倍数1∶2 000)]孵育过夜后,按1.2.5方法检测细胞中SIRT1、ALP、OPN、OCN蛋白相对表达水平。
1.3 统计学分析
2 结果
2.1 TSG对OP大鼠血清miR-34a及SIRT1蛋白表达变化的影响
与假手术组相比,模型组大鼠血清miR-34a表达升高(P<0.05),SIRT1蛋白表达降低(P<0.05)。与模型组相比,TSG组大鼠血清miR-34a表达降低(P<0.05),SIRT1蛋白表达升高(P<0.05);miR-34a-agomir组大鼠血清miR-34a表达进一步升高(P<0.05),SIRT1蛋白表达进一步降低(P<0.05)。TSG+miR-34a-agomir组大鼠上述指标变化与TSG组相反且差异有统计学意义(P<0.05)。见图1、表2。

图1 各组大鼠血清SIRT1蛋白表达免疫印迹图Fig.1 Western blot of SIRT1 protein expression in serum of rats in each group 注:A:假手术组;B:模型组;C:TSG组;D:miR-34a-agomir组;E:TSG+miR-34a-agomir组;F:agomir-NC组。
2.2 TSG对OP大鼠股骨远端组织病理变化的影响

表2 各组大鼠血清miR-34a及SIRT1蛋白表达比较
假手术组骨组织结构完整,骨小梁排列有序、粗细均匀且结构致密,成骨细胞形态清晰。模型组大鼠可见股骨远端松质骨小梁断裂、减少且排列稀疏,骨细胞减少且结构模糊。TSG组大鼠可见松质骨骨小梁排列较致密且断裂较少,成骨细胞相对模型组较多。miR-34a-agomir组大鼠骨小梁断裂、减少、排列疏松现象较模型组严重。TSG+miR-34a-agomir组及agomir-NC组骨组织上述病理损伤程度与模型组相近。见图2。
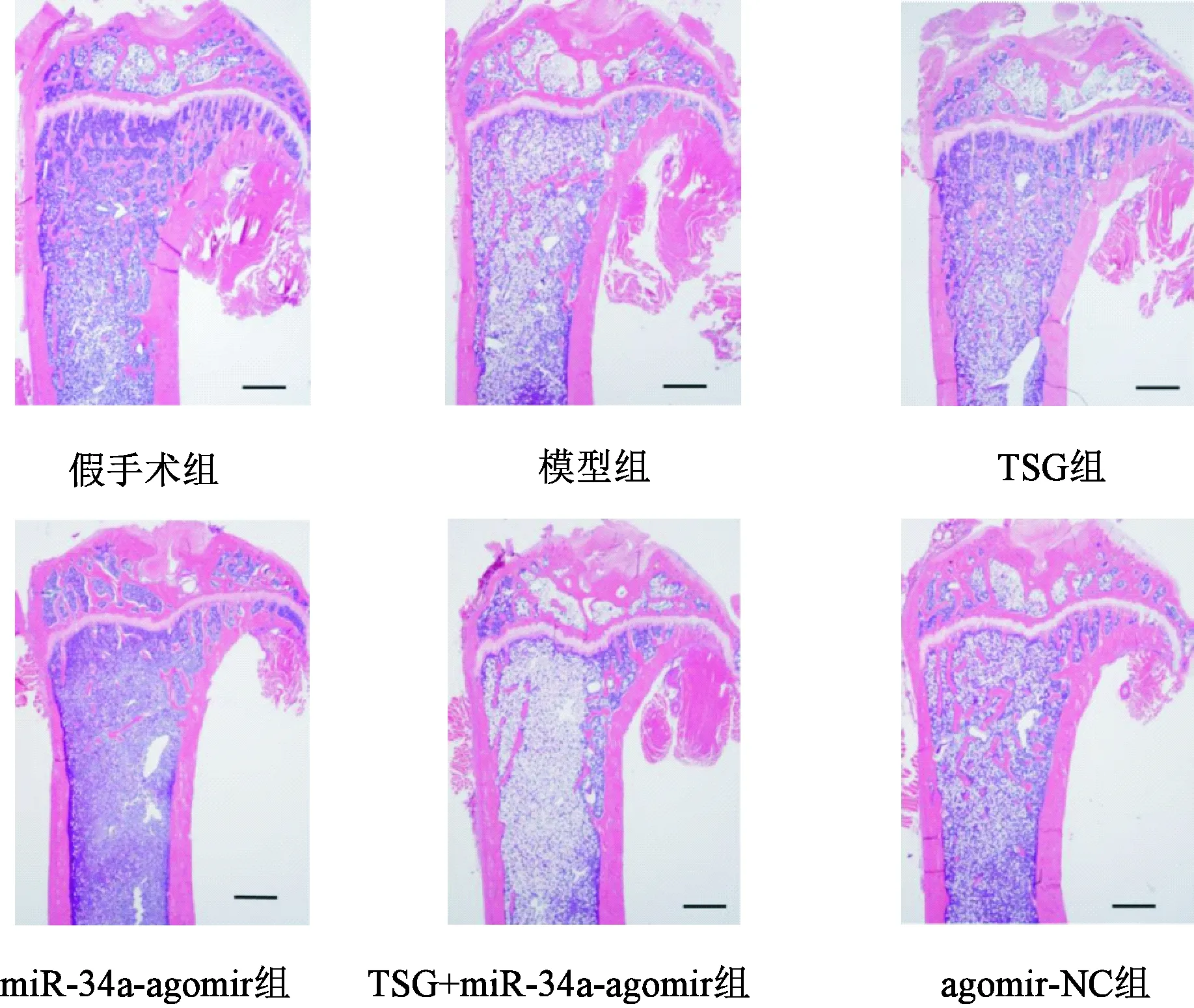
图2 大鼠股骨远端组织HE染色图(40×)Fig.2 HE staining of distal femur of rats in each group (×40)
2.3 TSG对大鼠骨组织超微结改变的影响
与假手术组相比,模型组大鼠Conn.D、Tb.N、BMD降低(P<0.05),Tb.Sp升高(P<0.05)。与模型组相比,TSG组大鼠Conn.D、Tb.N、BMD升高(P<0.05),Tb.Sp降低(P<0.05);miR-34a-agomir组大鼠Conn.D、Tb.N、BMD进一步降低(P<0.05),Tb.Sp进一步升高(P<0.05)。TSG+miR-34a-agomir组大鼠上述指标变化与TSG组相反且差异有统计学意义(P<0.05)。见图3、表3。

图3 股骨远端的显微CT成像Fig.3 Micro CT imaging of distal femur of rats in each group
2.4 TSG对大鼠血清MDA、GSH-Px变化的影响
与假手术组相比,模型组大鼠血清GSH-Px水平降低(P<0.05),MDA水平升高(P<0.05)。与模型组相比,TSG组大鼠血清GSH-Px水平升高(P<0.05),MDA水平降低(P<0.05);miR-34a-agomir组大鼠血清GSH-Px水平进一步降低(P<0.05),MDA水平进一步升高(P<0.05)。TSG+miR-34a-agomir组大鼠上述指标变化与TSG组相反且差异有统计学意义(P<0.05)。见表4。
2.5 TSG对成骨细胞凋亡的影响
荧光显微镜下显示,对照组成骨细胞结构正常。H2O2处理组可见成骨细胞核固缩、碎裂等凋亡现象严重。TSG组成骨细胞核固缩、碎裂等凋亡现象相对较轻。miR-34a-mimic组成骨细胞核固缩、碎裂等凋亡现象进一步加重。TSG+miR-34a-mimic组及miR-34a-NC组成骨细胞核固缩、碎裂等凋亡情况与模型组相近。见图4。

表3 各组大鼠骨组织结构参数比较Table 3 Comparison of bone tissue structure parameters of rats in each group
表4 各组大鼠血清MDA、GSH-Px水平比较

图4 各组细胞Hoechst33258染色图(×400)Fig.4 Hoechst 33258 staining of cells in each group (×400)
2.6 TSG对成骨细胞miR-34a、SIRT1、ALP、OPN和OCN蛋白表达的影响
与对照组相比,H2O2处理组成骨细胞miR-34a表达升高(P<0.05),SIRT1、ALP、OPN和OCN蛋白表达降低(P<0.05)。与H2O2处理组相比,TSG组成骨细胞miR-34a表达降低(P<0.05),SIRT1、ALP、OPN和OCN蛋白表达升高(P<0.05);miR-34a-mimic组成骨细胞miR-34a表达进一步升高(P<0.05),SIRT1、ALP、OPN和OCN蛋白表达进一步降低(P<0.05)。TSG+miR-34a-mimic上述指标与TSG组相反且差异有统计学意义(P<0.05)。见图5、表5。

图5 各组细胞SIRT1、ALP、OPN和OCN蛋白表达免疫印迹图Fig.5 Western blot of SIRT1, ALP, OPN and OCN protein expression in each group注:A:对照组;B:H2O2处理组;C:TSG组;D:miR-34a-mimic组;E:TSG+miR-34a-mimic组;F:miR-34a-NC组。
3 讨论
随着我国老龄化人口的增多,OP发病率及致残率逐年升高,大鼠切除卵巢是模拟人类绝经后OP的常见动物模型[10],本研究以此建立OP大鼠模型,发现大鼠股骨远端骨松质出现结构断裂、骨量、骨小梁数量减少现象,且CT检测发现骨组织超微结构Conn.D、Tb.N、BMD等参数降低,Tb.Sp等参数升高,提示造模成功。研究[3]发现氧化应激反应在OP过程中扮演重要角色,高水平的氧化应激反应可引起成骨细胞凋亡,减弱其分化,可能是导致OP患者骨组织及骨量丢失的原因之一。本研究在OP模型大鼠血清中检测到氧化应激指标MDA升高、GSH-Px降低,证实氧化应激在OP过程中发挥重要作用。

表5 各组细胞miR-34a及SIRT1、ALP、OPN和OCN表达比较Table 5 Comparison of the expression of miR-34a, SIRT1, ALP, OPN and OCN in each group
中医将OP归属为“骨萎”“骨枯”范畴,“肾精不足,骨髓化生及骨骼充养减弱”是其主要病机,补肾益精、填髓之物可促进骨髓化生及濡养,缓解OP骨死亡及枯竭[11]。中药何首乌有补肾益精、填髓、强筋骨之功,是治疗OP的常用药物,其活性成份TSG具有较好的抗炎、抗氧化应激、抗凋亡等多种药理作用[12]。本研究以TSG处理OP大鼠,发现大鼠股骨远端骨松质结构断裂缓解,骨量、骨组织体积分数、骨小梁数量及骨密度减少等均明显得到改善,并伴随着血清MDA降低、GSH-Px升高等氧化应激反应水平的降低,提示TSG可降低OP大鼠氧化应激水平,对其骨松质骨量减少、骨密度降低、骨结构异常有治疗作用,但其分子机制还需继续研究。
研究[13]发现,miRNA在OP患者血清及骨组织中表达异常,可作为OP筛查、诊治的指标,其中miR-34a参与介导OP骨稳态调节过程,上调miR-34a水平,可导致骨髓间充质干细胞衰老凋亡,还能下调SIRT1表达,降低骨密度[14];氧化应激反应是引发OP的重要机制之一[15],而SIRT1能介导氧化应激、炎症、自噬等多种生理过程,并可调控成骨细胞凋亡及分化,由此预测miR-34a/SIRT1可作为预治OP的潜在靶标。本研究检测到OP大鼠血清中miR-34a表达升高,SIRT1表达降低,miR-34a-agomir组大鼠随着miR-34a表达进一步升高及SIRT1蛋白表达的进一步降低,其骨量及骨密度减少也进一步加重,提示miR-34a上调,SIRT1下调可能是导致OP骨减少及骨密度下降的危险因子。TSG治疗组血清中miR-34a下调,SIRT1上调,而TSG与miR-34a-agomir联合应用后,大鼠miR-34a/SIRT1轴表达与TSG治疗组相反,OP骨量减少及骨组织结构改变症状也进一步加重,推测miR-34a-agomir可逆转TSG抑制OP骨量减少及组织结构改变的作用。另外本次体外试验发现TSG干预可明显降低H2O2诱导的成骨细胞氧化应激水平,并抑制其凋亡,降低miR-34a表达,上调SIRT1蛋白表达及成骨分化相关蛋白ALP、OPN和OCN的表达,促进成骨钙化过程。而TSG与miR-34a-mimic联合应用,其miR-34a及SIRT1蛋白表达与TSG单独干预相反,且成骨细胞凋亡增加,成骨分化减弱,提示TSG可上调SIRT1蛋白表达,抑制氧化应激条件下成骨细胞的凋亡,促进成骨分化,且上述作用可被miR-34a-mimic逆转。本研究体内外试验均证实TSG可下调miR-34a,上调SIRT1,抑制成骨细胞凋亡,促进其分化,改善OP骨量减少及骨微结构异常改变的症状。
综上所述,TSG可能通过抑制miR-34a表达、上调SIRT1蛋白表达来抑制氧化应激条件下成骨细胞的凋亡,促进其分化,改善OP大鼠骨量减少及骨组织结构异常的症状。但miR-34a/SIRT1信号轴调控机制复杂,TSG也可能通过miR-34a/SIRT1信号轴调控自噬、炎症及破骨细胞凋亡等途径来改善OP症状,这有待后续继续研究。
