中老年2型糖尿病患者血清FGF21、FGF23水平与骨量异常关系的研究
2022-03-08马艳琦刘露霞王瑛刘靖芳
马艳琦 刘露霞 王瑛 刘靖芳
1.兰州大学第一临床医学院,甘肃 兰州 7300002.兰州大学第一医院内分泌科,甘肃 兰州 730000
2型糖尿病(type 2 diabete mellitus, T2DM)和骨质疏松症是两种严重威胁人类健康的慢性疾病。T2DM对骨代谢的影响已被广泛研究,骨质疏松性骨折是糖尿病的严重并发症之一[1]。T2DM患者体内代谢的改变可引起钙稳态、骨骼代谢紊乱[2]。T2DM患者骨折的发生率增高[3]。研究[4-7]表明成纤维细胞生长因子(fibroblast growth factor,FGF)家族成员中的21、23(FGF21、FGF23)在骨稳态及骨调节中扮演了重要的角色。小鼠体内FGF21基因的过表达,或体外给予药理剂量的FGF21可诱导成年动物骨质的流失和骨密度(bone mineral density,BMD)的降低[5]。FGF23过表达可以抑制体外成骨细胞的分化和基质的矿化[6]。FGF23缺陷小鼠呈现骨矿化受损[7]。目前国内关于糖尿病患者血清FGF21、FGF23水平与骨量关系的研究仍较少,且存在一些争议。本研究拟对中老年T2DM合并骨量异常患者血清FGF21、FGF23水平进行分析研究,旨在为中老年T2DM患者预防骨质疏松的发生提供参考依据。
1 对象与方法
1.1 研究对象
选取2020年7月-11月于兰州大学第一医院内分泌科住院治疗的年龄≥45岁的T2DM患者250例,其中男性174例,女性76例,平均年龄(58.23±9.65)岁;所有研究对象均签署知情同意书,且经兰州大学第一医院伦理委员会批准。
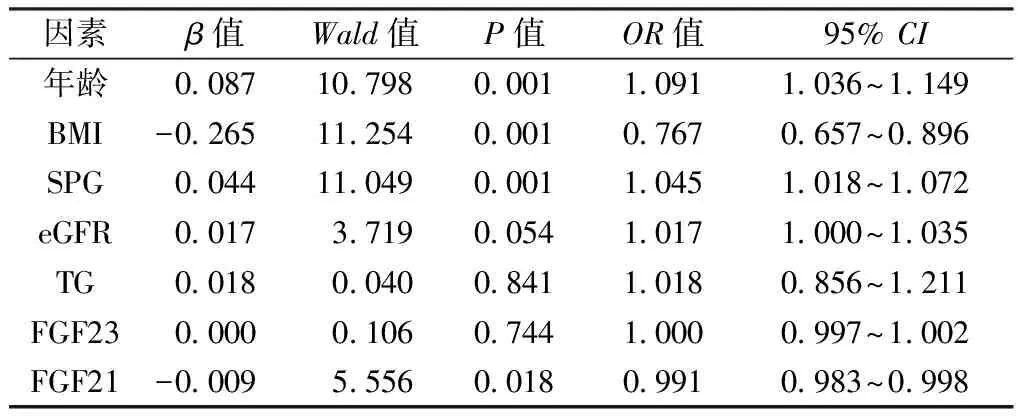
1.1.1诊断标准:250例患者均符合1999年WHO对糖尿病的诊断标准[8]。采用 Osteosys EXA-3000双能X线骨密度仪(北京格瑞朗博科技发展有限公司)测定受试者左前臂、右跟骨BMD,单位以g/cm2表示,软件自动分析得出T值。采用1994 年WHO推荐的方法[9],即测量的骨密度与同性别峰值骨密度相比,其骨密度下降的标准差(T值) ,如有1个或1个以上部位T值≤-2. 5为骨质疏松; -2. 5 1.1.2纳入标准:①2型糖尿病患者;②肾功能正常;③具有完整的病历资料;④签署知情同意书。 1.1.3排除标准:①1型糖尿病或其他特殊类型糖尿病;②骨折患者;③继发性骨质疏松症,如继发于甲状腺、肾上腺等疾患导致的骨质疏松症等;④合并感染性疾病、免疫缺陷、恶性肿瘤、严重肝肾功能不全者;⑤近期服用过激素及影响骨代谢的药物,如性激素、肾上腺皮质激素、钙剂、维生素D等。 1.2.1一般资料的收集:收集所有研究对象的性别、年龄、吸烟与饮酒史、糖尿病病程;由经过统一培训的测量人员对所有受试者在脱鞋、穿单衣情况下测量身高、体重,并计算体质量指数[BMI=体重(Kg)/身高2(m2)];测量腰围(取垂直站立位,以脐平面为测量部位,于呼气末读数)、测量血压(要求受试者静坐5~10 min,采用电子血压测量右上肢血压,间隔5 min后再次测量,取2次测量平均值)。 1.2.2生化指标的测定:所有研究对象均禁食水8 h后于清晨抽取肘静脉血5 mL,常规分离血清,通过BS-220全自动生化分析仪(深圳麦瑞生物公司)检测空腹血糖(fasting plasma glucose,FPG)、血钙(calcium,Ca)、血磷(phosphorus,P)、25羟维生素D[25 hydroxyvitamin D,25(OH)D]、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase, ALT)、碱性磷酸酶(alkaline phosphatase,ALP)、尿酸(uric acid,UA)、血肌酐(serum creatinine,Scr)、总胆固醇(total cholesterol,TG)、甘油三脂(triglycerides,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C),低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)水平,所有检测试剂均为梅高医疗科技有限公司生产。糖化血红蛋白(HbA1c)采用高效液相分析法测定(伯乐-D10)。空腹胰岛素(fast insulin, Fins)采用化学发光法测定(Centaur-XP全自动化学发光免疫分析仪),胰岛素抵抗指数(HOMA-IR)=FPG(mmol/L)×Fins(mU/L)/22.5,胰岛素分泌指数(HOMA-IS)=20×Fins(mU/L)/[FPG(mmol/L)-3.5]。测定所有研究对象的尿白蛋白排泄率(urinary albumin excretion rate,UAER),评估的肾小球滤过率(eGFR)=186×Scr(mg/dL)-1.154×年龄(岁)-0.203(女性×0.742)。 1.2.3血清FGF21、FGF23测定:采用双抗体夹心ELISA法分别检测血清FGF21、FGF23水平(江莱生物公司)。FGF21检测范围7.5~240 pg/mL,批内变异系数<9%;批间变异系数<11 %。FGF23检测范围12.5~400 pg/mL,批内变异系数<9 %;批间变异系数<11 %。根据说明书在除空白孔以外的各孔中加标准品或样品各50 μL,随即加辣根过氧化物酶(HRP)标记的抗体工作液100 μL,37 ℃恒温孵育箱孵育60 min;加入洗涤液洗涤5次后,加入底物A、B各50 μL,37 ℃避光孵育15 min;最后加入50 μL终止液,450 nm波长处测定各孔的OD值,绘制标准曲线计算样本中检测物浓度。 骨量异常组与骨量正常组性别构成比、吸烟、饮酒史患病率比较差异无统计学意义(P>0.05)。骨量异常组高血压患病率显著高于骨量正常组(P<0.05),见表1。 表1 骨量异常组与骨量正常组一般资料比较 [n (%)] T2DM伴有骨量异常组年龄、SBP显著高于骨量正常组(P<0.05);骨量异常组BMI、GFR、TG、右跟骨及左前臂BMD水平均显著低于骨量正常组(P<0.05)。骨量异常组血清FGF21水平显著低于骨量正常组(P<0.05);骨量异常组血清FGF23水平低于骨量正常组,但不具有统计学意义(P>0.05)。两组患者糖尿病病程、腰围、DBP、FPG、Fins、HbA1c、HOMA-IR、HOMA-IS、UA、Cr、UAER、血Ca、血P、25(OH)D、ALP、AST、ALT、TC、HDL-C、LDL-C水平比较差异均无统计学意义(P>0.05)。见表2。 排除年龄、SBP、BMI、GFR、TG等混杂因素后,通过协方差分析显示T2DM合并骨量正常组血清FGF21水平[(112.70±7.81)pg/mL]仍显著高于T2DM合并骨量异常组[(91.72±3.33)pg/mL],P=0.016。 表2 骨量异常组与骨量正常组临床指标比较 以T2DM是否合并骨量异常为因变量(骨量正常=0;骨量异常=1),年龄、BMI、SPG、eGFR、TG、FGF21、FGF23为自变量,进行二元logistic回归分析。结果显示:年龄、SPG是T2DM患者骨量异常的独立危险因素(OR=1.091;P=0.001;OR=1.045,P=0.001),BMI、FGF21是T2DM患者骨量异常的保护因素(OR=0.767;P=0.001;OR=0.991;P=0.018)。血清FGF23水平与T2DM患者骨量异常无独立相关性。见表3。 表3 T2DM合并骨量异常危险因素的二元Logistic回归分析 人血清FGF是一类在生长、发育、代谢中起重要作用的细胞因子。FGF家族由22个成员组成(FGF1~23,缺乏FGF15),按种系与序列分为7个亚科,其亚科之一的FGF19亚科成员FGF21、FGF23已被证实在糖脂代谢、骨稳态及骨调节中发挥着重要作用[4]。 FGF21是一种新型的糖脂代谢调节剂,尽管用FGF21类似物治疗对动物及人类的糖脂代谢有众多有益作用[10],但目前关于人类FGF21与骨代谢关系的研究较少,且结论不一致。本研究发现T2DM合并骨量异常患者血清FGF21水平显著低于骨量正常组,且二元Logistic回归分析提示FGF21是T2DM患者骨量异常的保护因素。Lee等[11]的一项主要针对绝经前女性的研究也提示血浆FGF21水平与骨密度呈正相关,其原因可能是与雌激素水平差异有关,雌二醇调节着棕色脂肪组织的生理功能,且FGF21主要由棕色脂肪组织分泌。另有一项纳入人群为中国绝经后女性、排除雌激素水平影响的大型临床研究[12]也同样显示血清FGF21水平与腰椎BMD显著正相关。关于牙周炎的病例对照研究[13]同样显示,慢性牙周炎患者在牙周治疗3个月后,牙周附着丧失程度减小的同时也伴随着血浆FGF21水平的升高。上述研究结果与本次研究的结论相一致。然而,也有研究[14]发现人类血清和滑膜液中FGF21水平的增高与膝关节骨量的丢失相关,人免疫缺陷病毒感染的患者血清FGF21水平与骨吸收生物标志物(骨保护素、I型胶原交联C-末端肽CTX-1及CTX-1/骨钙素)呈正相关[15]。本研究与以往结果存在差异的可能原因是本研究纳入的是中老年T2DM患者,并不一定能反映FGF21与正常人群BMD的关系。另外,本研究仅是横断面设计,只能反映一个固定时间点的一般情况,长期的前瞻性研究可能会更有价值。 动物研究显示FGF21通过增加氧化物酶体增殖物激活受体(peroxisome proliferator activated receptor-γ,PPAR-γ)的活性来抑制骨髓间充质干细胞成骨形成和增加骨髓脂肪生成,从而导致成骨细胞形成受抑、骨吸收增加[5]。FGF21可以与其受体FGFR1或FGFR3结合,从而通过拮抗生长激素对软骨细胞分化及增殖的影响来抑制骨生长,此外,高浓度的FGF21可直接抑制软骨细胞的分化及增殖[16]。本次研究得出血清FGF21与T2DM患者骨量减低呈正相关的结果,与动物研究结论不一致的原因可能是由于人与小鼠物种的差异,FGF21可以是小鼠3T3-L1脂肪细胞的一个分支,但人FGF21没有这种作用[17]。且也有报道[18]称,用重组人FGF21处理的小鼠在双能X线吸收仪扫描中并未出现骨量丢失,FGF21敲除小鼠也未出现骨量增加,这表明体内FGF21和PPAR-γ通路实际上可能并不相交。 FGF23是调节钙磷代谢的核心激素,作用机制主要是通过与其受体FGFR及共受体α-kolotho的结合激活FGF23信号转导,进而通过抑制近端肾小管磷酸钠共转运蛋白的表达来增加尿磷的排泄、降低血磷水平[19-20]。此外,FGF23信号传导抑制了1-α-羟化酶的表达,该酶负责1,25-二羟基维生素D3[1,25(OH)2VD3]的产生,1,25(OH)2VD3水平的降低会导致十二指肠磷酸盐吸收减少。FGF23在成骨细胞中的调控已被广泛研究,维生素D受体信号的激活[21]、FGF受体通路的激活[19]、炎症信号[22]、甲状旁腺素[23]、Notch[24]信号转导通路均参与了骨组织中FGF23表达的调控。本研究中虽然T2DM合并骨量异常患者血清FGF23水平低于骨量正常者,与大多数既往研究结果相似,但差异无统计学意义,这可能与研究人群较少有关,需要进一步加大样本量进行研究。 当然,本研究也存在以下不足之处:首先,由于所使用的骨密度仪限制,本研究仅测定了右跟骨、左前臂BMD,未测定腰椎、股骨颈等其它部位的BMD;其次,样本量偏小且纳入的人群为中老年患者;最后,降糖药物在降糖治疗的同时可能对糖尿病患者的骨代谢产生一定的影响,如二甲双胍、胰高血糖素-1(GLP-1)、噻唑烷二酮类、二肽基肽酶Ⅳ(DPP-4)抑制剂等,本研究未进一步排除不同降糖药物对骨密度产生的可能影响。 综上所述,中老年T2DM合并骨量异常患者血清FGF21、FGF23水平较骨量正常者降低,低血清FGF21水平可能是中老年T2DM患者骨量减少的危险因素。对中老年T2DM患者检测血清FGF21水平对于及早发现骨量异常可能具有一定的指导意义。1.2 方法
1.3 统计学方法

2 结果
2.1 两组研究对象一般资料比较
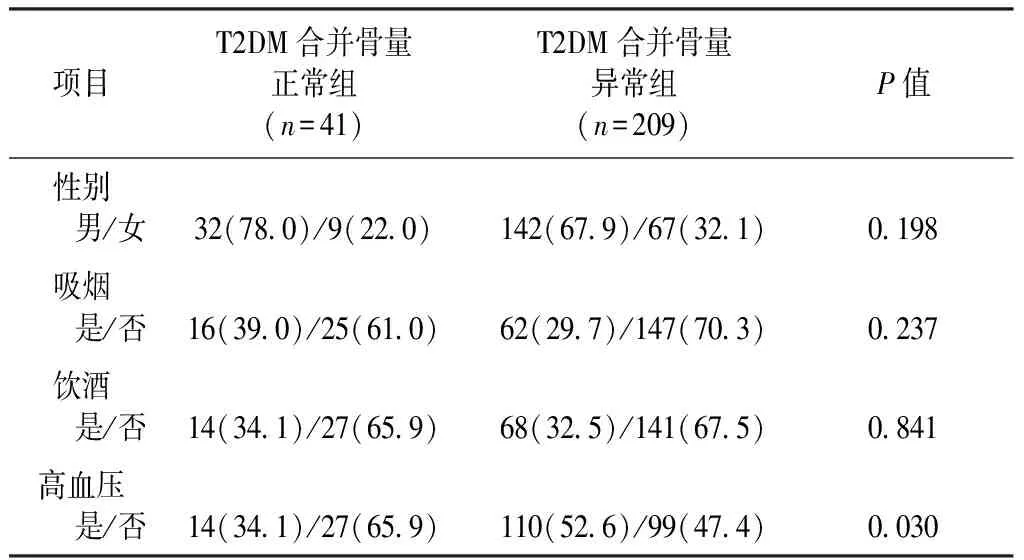
2.2 两组研究对象临床指标比较
2.3 T2DM合并骨量异常的危险因素分析
3 讨论
