MEBT/MEBO对糖尿病创面Smad1表达的影响的实验研究
2022-03-08隆采丹唐丽珠徐媛媛周安邦黄光京陈思蓉吴标良
隆采丹 唐丽珠 徐媛媛 周安邦 黄光京 陈思蓉 吴标良
【摘要】 目的 觀察皮肤再生医疗技术[湿润暴露疗法(moist exposed burn therapy,MEBT)/湿润烧伤膏(moist exposed burn ointment,MEBO)]对糖尿病大鼠创面骨形成蛋白(BMP)/Smad信号通路中Smad1表达的影响,探讨MEBT/MEBO促进糖尿病创面愈合的机制。
方法 将90只Wistar大鼠随机分成对照组、模型组和MEBO组三个组,每组30只,对照组建立普通创面模型,模型组和MEBO组建立糖尿病创面模型,模型组和对照组采用生理盐水纱布湿敷换药,MEBO组采用MEBO干预创面,分别于治疗第1天、第5天、第11天,对比创面的愈合情况,取创面组织采用qRT-PCR技术检测Smad1的表达水平,免疫组化法检测大鼠创面中Smad1蛋白表达水平。
结果 (1)治疗第5天、第11天,三组大鼠创面愈合率对比,MEBO组>对照组>模型组(P<0.05);(2)治疗第1天、第5天、第11天,模型组Smad1 mRNA表达均低于对照组,MEBO组Smad1 mRNA表达高于对照组(P<0.05),三组的Smad1 mRNA表达在治疗第5天降低,治疗第11天达到高峰;(3)免疫组化显示Smad1蛋白表达在第5天达到高峰。
结论 MEBT/MEBO可促进糖尿病慢性创面愈合,其机制可能是通过调控Smad1表达和BMP/Smad信号通路。
【关键词】 皮肤再生医疗技术;糖尿病创面;BMP/Smad信号通路;Smad1
中图分类号:R587.2 文献标志码:A DOI:10.3969/j.issn.1003-1383.2022.01.001
Experimental study on the effect of MEBT/MEBO on wound healing and expression of Smad1 in diabetic wound
LONG Caidan1,2, TANG Lizhu1,2, XU Yuanyuan1,2, ZHOU Anbang1,2, HUANG Guangjing1,2, CHEN Sirong1,2, WU Biaoliang1
(1. Department of Endocrinology, Affiliated Hospital of Youjiang Medical University for Nationalities, Baise 533000, Guangxi, China; 2. Graduate School, Youjiang Medical University for Nationalities, Baise 533000, Guangxi, China)
【Abstract】 Objective To observe the skin regeneration medical technique (moist exposed burn therapy[MEBT]/moist exposed burn ointment[MEBO]) on the expression of Smad1 in wound bone morphogenetic protein (BMP)/Smad signaling pathway in diabetic rats, so as to explore the mechanism of MEBT/MEBO in promoting diabetic wound healing.
Methods 90 Wistar rats were randomly divided into 3 groups: control group, model group and MEBO group, with 30 rats in each group. Normal wound model was established in the control group, and diabetic wound models were established in the model group and the MEBO group.The model group and the control group were treated with wet dressing with saline gauze, while the MEBO group were treated with MEBO to intervene the wound. And then, the wound healing was compared on the 1st, 5th and 11th day of treatment, respectively. Wound tissues were taken, and the expression level of Smad1 was detected by qRT-PCR, and Smad1 protein expression level was detected by immunohistochemistry.
Results (1) On the 5th and 11th day of treatment,the wound healing rates of the 3 groups were compared, which showed that MEBO group>control group>model group (P<0.05); (2) On the 1st, 5th and 11th day of treatment, the expression levels of Smad1 and mRNA in the model group were lower than those in the control group, and the expression levels of Smad1 and mRNA in the MEBO group were higher than those in the control group (P<0.05). The expression levels of Smad1 and mRNA in the three groups decreased on the 5th day of treatment and reached the peak on the 11th day of treatment; (3)Immunohistochemistry showed that the protein expression levels of Smad1 reached the peak on the 5th day of treatment.
Conclusion MEBT/MEBO can promote the healing of chronic wound in diabetes mellitus, and the mechanism may be through regulating Smad1 expression and BMP/Smad signaling pathway.
【Key words】 skin regeneration medical technique; diabetic wound; BMP/Smad signaling pathway; Smad1
糖尿病為常见病、多发病,截至2019年,全球共有4.63亿人罹患糖尿病,并且这个数值预计至2030年将增长至5.79亿[1]。糖尿病及其并发症对人类的健康产生了巨大的影响,其中糖尿病慢性创面是最严重及治疗费用最高的并发症之一,近年来许多学者对糖尿病慢性创面的治疗进行了许多研究。在关于皮肤再生医疗技术[湿润暴露疗法(moist exposed burn therapy,MEBT)/湿润烧伤膏(moist exposed burn ointment,MEBO)]治疗糖尿病慢性创面的研究过程中,学者们发现MEBT/MEBO扮演着很重要的角色,它可促进慢性创面的修复和再生[2],但其具体机制尚未明了。同时有研究结果表明,转化生长因子-β1(transforming growth factor-β1,TGF-β1)/Smad信号通路在促进创面愈合中举足轻重[3]。本研究旨在通过观察MEBT/MEBO在治疗糖尿病慢性创面中与骨形成蛋白(BMP)/Smad信号通路中Smad1表达的影响,进而探究其与糖尿病慢性创面愈合修复的可能机理。
1 实验材料与方法
1.1 实验动物
选择体重200~250 g范围内的健康雄性Wistar大鼠90只,由长沙天勤生物技术有限公司提供。动物饲养于右江民族医学院实验动物中心,设定温度在20℃~26℃范围,环境清洁,自由进食饮水。大鼠先适应性喂养7天方能进行正式实验。本实验符合动物实验的伦理学要求,经右江民族医学院动物伦理委员会批准(编号:2018112001)。
1.2 试剂
链脲佐菌素(Streptozotocin,STZ)购自北京华越洋生物科技有限公司,湿润烧伤膏购自汕头市美宝制药有限公司,水合氯醛购自成都市科龙化工试剂厂,Smad1、β-actin引物购自武汉金开端生物工程有限公司。
1.3 方法
1.3.1 实验动物分组及模型的建立
大鼠按随机数字表分为模型组30只、对照组30只、MEBO组30只,模型组及MEBO组大鼠予高脂饲料喂养1个月,造模前禁食不禁水16 h,一次性将45 mg/kg的STZ(以0.1 mol/L柠檬酸缓冲液配制)腹腔内注射,7日后大鼠出现三多一少症状,此时于尾尖静脉处采血,测量实验大鼠的空腹血糖,如空腹血糖≥16.7 mmol/L,则代表糖尿病模型建立成功,需隔日复测1次,2次以上达标则为造模成功,如血糖不达标可再次注射STZ;对照组大鼠喂食普通饲料,1个月后取0.1 mol/L柠檬酸缓冲液,进行腹腔内注射作为对照。造模成功后第7天,7%水合氯醛0.5 mL/100 g腹腔内注射麻醉,于大鼠足背部造模区域切除约2 cm×2 cm深至筋膜层的全层皮肤[4]。
1.3.2 创面及血糖管理
各组模型建立成功后每日换药2次,首先清洁创面,模型组及对照组使用1/5000呋喃西林液清洁,后于伤口处使用生理盐水纱布及消毒干纱布各2层包扎固定,MEBO组使用MEBO药纱及消毒干纱布2层覆盖包扎于创面处,模型组及MEBO组需使用长效胰岛素控制血糖值于16.0 mmol/L左右[5]。
1.3.3 标本采集与处理
三组均于创面建立成功后的第1天、第5天、第11天,每个时点各组随机选取10只大鼠,腹腔注射水合氯醛(浓度同造模时)麻醉,剪取创面组织,置于去核糖核酸酶的冻存管中,于-80℃冰箱中保存,取标本后处死动物。
1.3.4 记录创面面积、计算愈合率
创面建立成功后的第1天、第5天、第11天,每个时点各组随机选取10只大鼠,将刻度尺两边放在大鼠的创缘,尺子90°垂直,用数码相机拍摄尺子及创面,将图片保存,使用Image J软件对实验大鼠未愈合的创面面积进行测量,并计算愈合率。创面愈合率=(原始创面面积-未愈合创面面积)/原始创面面积×100%。
1.3.5 qRT-PCR技术检测Smad1 mRNA表达水平
将低温冰箱中的标本取出,使用高压灭菌过的研钵,将标本连同液氮一起充分研磨,直至研磨成粉末状,此时加入组织裂解液,按TAKARA试剂盒说明书提供的实验步骤进行总RNA的提取,实验需要的反转录模板选择A260/280比值范围在1.8~2.1的总RNA,依照反转录试剂盒的实验方法合成cDNA,而后进行PCR扩增和检测。实验用的引物序列如下,Smad1-F:TATGCGGAGTGCCTCAGTGA,Smda1-R:AGACCGTGGTGGGATGAAAG,β-actin:TGTCACCAACTGGGACGATA,β-actin-R:GGGGTGTTGAAGGTCTCAAA。
1.4 统计学方法
本实验首先对所有实验数据进行正态性检验,如数据符合正态分布,则以均数±标准差(±s)表示,不符合正态分布的数据以中位数和四分位数间距表示,两个样本间的比较如均符合正态分布,选择配对样本t检验,如均不符合正态分布或其中一组样本不符合正态分布,则选择配对样本的秩和检验,采用单因素方差分析比较多个样本。最终数据采用实验软件SPSS 25.0进行统计分析。检验水准:α=0.05,双侧检验。
2 结 果
3.1 三组大鼠创面愈合情况和愈合率的对比
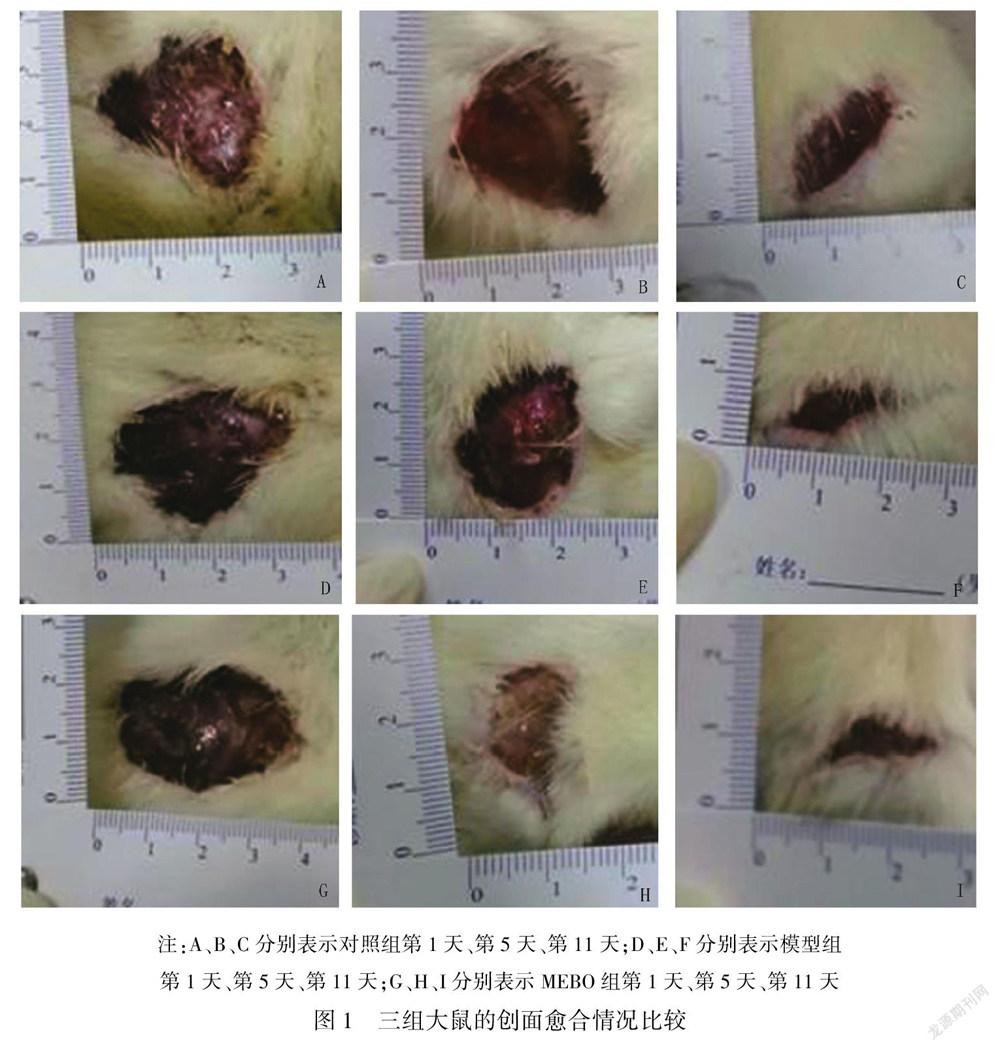
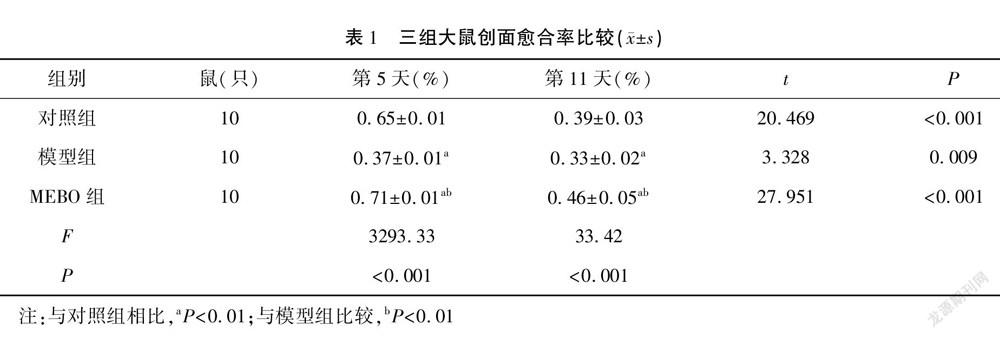
造模成功后,在饮食、睡眠、活动方面,各组大鼠未发现明显差异,治疗第1天,三组大鼠的创面外观均晦暗,表面湿润,有少许出血、渗液及周围组织水肿。治疗第5天,模型组的创面组织水肿仍明显,有较多渗血、渗液,无明显肉芽组织形成;对照组创面稍湿润,有少许出血、渗液,表面可见片状新生肉芽组织形成;MEBO組的创面较干燥,面积较前缩小,创面被许多新生肉芽组织填充。治疗第11天,模型组大鼠的创面较前明显缩小,表面稍湿润,可见肉芽组织生成;对照组创面较前缩小,创面被大片肉芽组织覆盖;MEBO组创面干燥,多数结痂,面积明显缩小(图1)。治疗第5天、第11天,三组大鼠创面愈合率对比,MEBO组>对照组>模型组,差异有统计学意义(P<0.05)。见表1。
3.2 三组大鼠创面组织中Smad1 mRNA表达水平对比
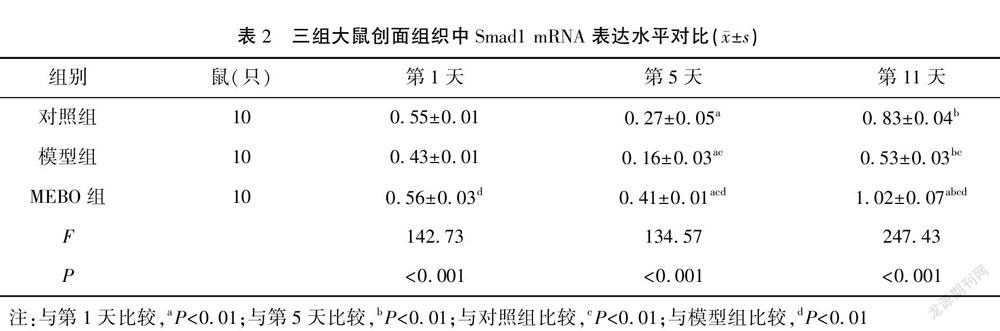
qRT-PCR检测结果显示,治疗第1天,与对照组对比,MEBO组和模型组的Smad1 mRNA表达量无统计学意义,MEBO组的Smad1 mRNA表达量较模型组的高(P<0.05);治疗第5天,与对照组对比,模型组的Smad1 mRNA表达量较低(P<0.05),MEBO组的Smad1 mRNA表达量较高(P<0.05),MEBO组的Smad1 mRNA表达量较模型组的高(P<0.05);治疗第11天,与对照组对比,模型组的Smad1 mRNA表达量较低(P<0.05),MEBO组的Smad1 mRNA表达量较高(P<0.05),MEBO组的Smad1 mRNA表达量较模型组的高(P<0.05)。与治疗第1天对比,对照组和模型组治疗第5天的Smad1 mRNA表达量较低(P<0.05),治疗第11天与第1天差异无统计学意义(P>0.05),治疗第5天Smad1 mRNA表达量低于第11天(P<0.05);而与治疗第1天对比,MEBO组治疗第5天的Smad1 mRNA表达量较低(P<0.05),治疗第11天表达量较高(P<0.05),治疗第5天的Smad1 mRNA表达量较第11天表达量低(P<0.05)。见表2。
3.3 免疫组化观察三组大鼠3个时间段Smad1蛋白表达水平
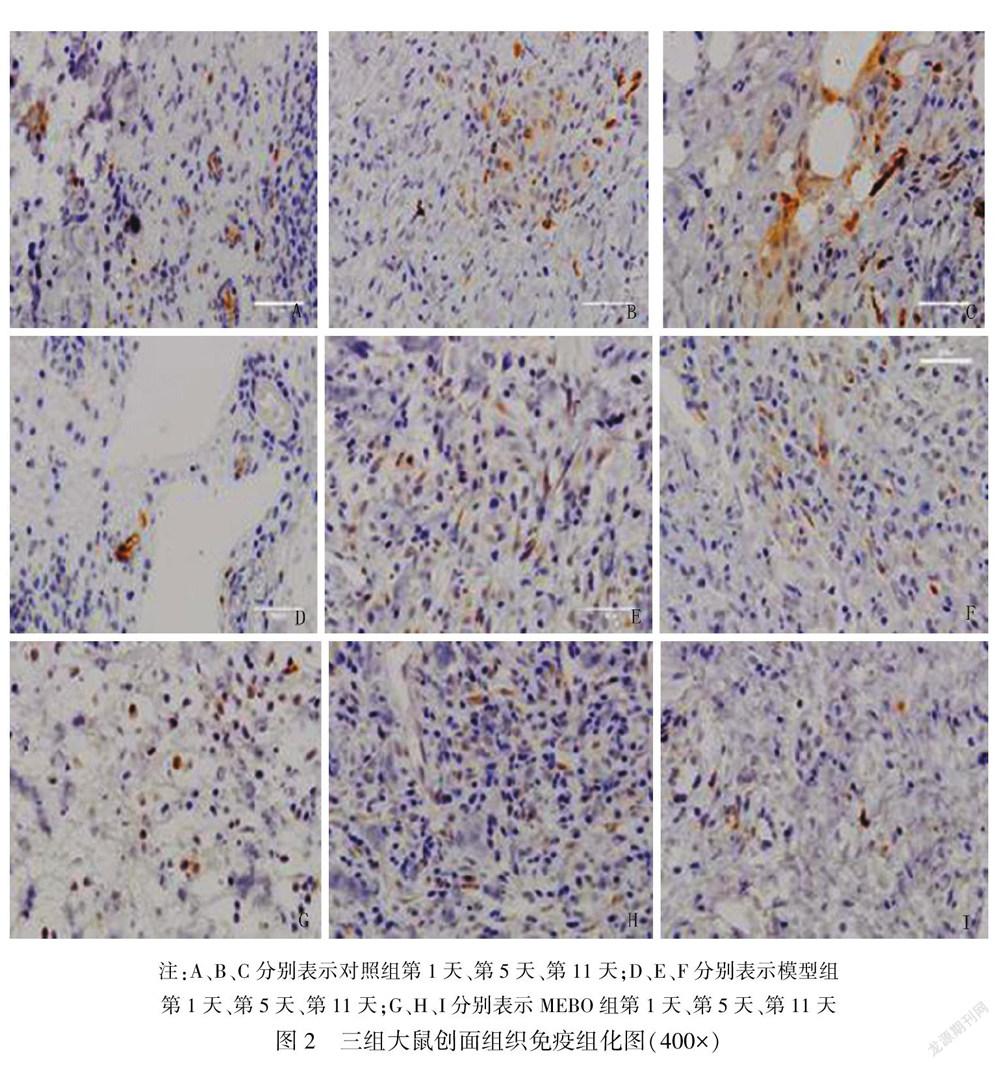
棕黄色染色代表阳性染色,蓝色染色代表细胞核。治疗第1天,模型组发现极少量棕黄染色,对照组及MEBO组可见散在棕黄染色,其中,对照组阳性染色大多位于细胞间质,MEBO组阳性染色基本位于细胞核附近;治疗第5天,模型组中可见少量棕黄色,部分位于细胞间质,部分位于细胞核附近,对照组可见散在棕黄染色较第1天增多,大多数蛋白在细胞间质表达,MEBO组可见散在棕黄染色较第1天增多,大多位于细胞核附近;治疗第11天,模型组仅有少量棕黄染色,大部分位于细胞间质,对照组细胞较第5天有较多棕黄染色,大部分位于细胞间质,MEBO组仅有少量棕黄染色,明显少于第5天。见图2。
3 讨 论
创面愈合主要包括炎症期、增生期及重塑期,是一个复杂的过程[6]。既往许多研究发现,MEBT/MEBO在糖尿病慢性创面的治疗上有显著的效果[7~8],但其促进慢性创面愈合的机制尚未明确。TGF-β在胚胎发育和成年组织内稳态的调节细胞增殖、生存、干细胞自我更新和分化中扮演着重要的角色,TGF-β超家族包括:BMP、生长分化因子(GDF)、抗缪勒式管激素(AMH)、激活素(Activin)、Nodal及TGF-β[9]。有学者研究发现,所有家族成员的典型TGF-β信号通路似乎只激活了两个不同的信号通路,即Smad2/3或Smad1/5/8信号通路[10],其中,TGF-β受体、激活素和肌生成抑制素(家族的TGF-b分支)通过Smad2和Smad3发出信号,而BMP通过Smads1/5/8发出信号[11]。Smad1/5/8的活化可上调BMP并抑制TGF-β1介导的纤维化基因的表达[12]。糖原合成酶激酶3β (glycogen synthase kinase-3β,GSK-3β)是PI3K/AKT信号通路的下游基因,是一种在进化上非常保守的丝氨酸/苏氨酸激酶,参与调控糖原合成酶的活性,调节细胞的分化、增殖和凋亡等[13],GSK-3β可介导Smad1磷酸化,在爪蟾胚胎中进行的体内上位性实验表明,GSK-3β介导的Smad1磷酸化在Wnt信号对原肠期和外胚层细胞神经发育的影响中起着关键作用,此实验还发现Smad1与造血基因附近的主调控因子共同占据位点,以调节造血干细胞的命运[14]。通过PI3K-Akt信号增强Smad1介导的转录激活可用于BMP诱导的集落刺激因子1 (CSF-1)的表达[15]。以上的研究显示,Smad1在调节细胞的生长发育、凋亡,促进细胞神经发育等过程中扮演着重要的作用,其调节造血干细胞及激活CSF-1的表达提示其对造血功能的恢复也有一定的作用。
本研究结果显示,采用MEBO/MEBT干预的MEBO组创面愈合率高于模型组,表明了MEBO/MEBT对糖尿病慢性创面愈合有促进作用;RT-PCR显示MEBO组及对照组的Smad1 mRNA的表达高于模型组,免疫荧光结果提示创面中有Smad1蛋白的表达,在治疗的第5天及第11天的表达较第1天高,表明了MEBO/MEBT对Smad1的调控作用,而上述既往研究表明Smad1在调节细胞的生长分化方面具有重要作用,因此,MEBO/MEBT对Smad1的调控可能是MEBO/MEBT促糖尿病慢性创面愈合的机制之一。
综上所述,MEBT/MEBO可显著提高糖尿病大鼠创面的愈合率,其机制可能是调控Smad1表达,进而调控了BMP/Smad信号通路变化。
参 考 文 献
[1] SAEEDI P,PETERSOHN I,SALPEA P,et al.Global and regional diabetes prevalence estimates for 2019 and projections for 2030 and 2045:results from the International Diabetes Federation Diabetes Atlas,9th edition[J].Diabetes Res Clin Pract,2019,157:107843.
[2] HUANG C,SHEN S,MA Q,et al.Blockade of KCa3.1 ameliorates renal fibrosis through the TGF-β1/Smad pathway in diabetic mice[J].Diabetes,2013,62(8):2923-2934.
[3] 唐强,黄志群,陆钢,等.再生医疗技术对深Ⅱ度烧伤患者的炎症因子水平及创面愈合的影响[J].中国美容医学,2020,29(4):94-97.
[4] 董方,蔡黔,刘毅.糖尿病足溃疡大鼠模型的建立[J].山东医药,2010,50(14):34-35.
[5] 宋紫辉,张慧霞,项宗尚,等.甘精胰岛素注射液对1型糖尿病模型大鼠的降血糖作用[J].首都医科大学学报,2016,37(5):646-650.
[6] LOU Z,ZHANG C,GONG T,et al.Wound-healing effects of 635-nm low-level laser therapy on primary human vocal fold epithelial cells:an in vitro study[J].Lasers Med Sci,2019,34(3):547-554.
[7] 李杰辉,唐乾利.MEBT/MEBO在慢性难愈合创面治疗中的基础与临床研究进展[J].中国烧伤创疡杂志,2021,33(2):77-81.
[8] ZHENG A,MA H,LIU X,et al.Effects of moist exposed burn therapy and ointment (MEBT/MEBO) on the autophagy mTOR signalling pathway in diabetic ulcer wounds[J].Pharm Biol,2020,58(1):124-130.
[9] BORENA B M,MARTENS A,BROECKX S Y,et al.Regenerative skin wound healing in mammals:state-of-the-art on growth factor and stem cell based treatments[J].Cell Physiol Biochem,2015,36(1):1-23.
[10] NICKEL J,MUELLER T D.Specification of BMP signaling[J].Cells,2019,8(12):1579.
[11] MACIAS M J,MARTIN-MALPARTIDA P,MASSAGU J.Structural determinants of Smad function in TGF-β signaling[J].Trends Biochem Sci,2015,40(6):296-308.
[12] LECHLEIDER R J,RYAN J L,GARRETT L,et al.Targeted mutagenesis of Smad1 reveals an essential role in chorioallantoic fusion[J].Dev Biol,2001,240(1):157-167.
[13] 劉谦,唐圆圆,张国海,等.糖原合成激酶-3β及其天然药物抑制剂研究进展[J].中国实验方剂学杂志,2010,16(9):223-229.
[14] TROMPOUKI E, BOWMAN T V, LAWTON L N, et al.Lineage regulators direct BMP and Wnt pathways to cell-specific programs during differentiation and regeneration[J].Cell,2011, 147(3): 577-589.
[15] MANDAL C C, GHOSH CHOUDHURY G, GHOSH-CHOUDHURY N.Phosphatidylinositol 3 Kinase/Akt signal relay cooperates with Smad in bone morphogenetic protein-2-induced colony stimulating factor-1 (CSF-1) expression and osteoclast differentiation[J].Endocrinology,2009,150(11):4989-4998.
(收稿日期:2021-07-05 修回日期:2021-11-13)
(编辑:潘明志)
