基于酶联适配体快速检测食品中葡萄球菌肠毒素A
2022-03-07林祥群杨国江卢春霞陶思桦闫圣坤
林祥群,杨国江,卢春霞,陶思桦,闫圣坤
(1.新疆石河子职业技术学院轻纺化工分院,新疆 石河子 832000)(2.新疆农垦科学院水土研究所,新疆 石河子 832000)(3.长江师范学院现代农业与生物工程学院,重庆 408100)(4.新疆农业科学院农业机械化研究所,新疆 乌鲁木齐 830091)
金黄色葡萄球菌(Staphylococcus aureus)是引发食源性疾病的主要致病菌之一,而引起金黄色葡萄球菌食物中毒的主要致病因子是葡萄球菌肠毒素(Staphylococcus enterotoxin,SEs)。据统计,在世界上由SEs引起的食物中毒事件占细菌性食物中毒总事件的25%~45%,其中SEA引起的食物中毒事件占所报道的葡萄球菌中毒病例的80%[1]。因此,如何快速、及时、准确地检出SEA是保障食品安全及有效预防食源性疾病的先决条件。
目前,SEA的鉴定和检测方法主要包括:(1)分子生物学方法:该法是基于SEs特异基因序列作为检测目标,采用聚合酶链式反应技术[2]、基因芯片技术[3]等对目标物进行快速检测。该法需要昂贵的仪器和专业的技术人员,无法满足现场快速检测的要求。(2)基于抗原-抗体识别的免疫分析技术,是目前最常用SEA快速检测技术,主要包括酶联免疫吸附分析(ELISA)[4]、胶体金试纸条[5]和各种生物传感器[6,7]。但是抗体的制备需要免疫动物,制备周期长、成本高。因此,迫切需要建立简便、经济、灵敏、快速的SEA检测方法,作为现有检测技术的补充,满足批量样品中SEA的快速筛查。而核酸适配体可弥补抗体在检测应用中的不足,为SEA检测提供了新的思路。
核酸适配体(Aptamer)是能与特定靶标结合的一段单链寡核苷酸,通过折叠成发夹、茎环、假结体及G-四聚体等结构与靶标进行特异性分子识别。基于随机文库的庞大库容和单链核苷酸空间结构的多样性,适配体几乎可与所有种类的靶标包括大到微生物小到有机小分子[8-16]发生结合。相较与抗体,核酸适配体还具有制备简单、生产成本低、应用范围广、易于修饰和标记等特点[17]。因此,适配体作为一种新型识别探针在食品安全领域成为人们研究的焦点[18-22]。2014年,Huang等[23]筛选出SEA核酸适配体,适配体亲和力达到 nmol/L级别,并通过氧化石墨烯与标记FAM荧光基团的SEA适配体之间的荧光共振能量转移原理,实现了对牛奶中SEA的检测,方法检出限达8.7 ng/mL。马欣月[24]以荧光标记的SEA适配体为分子识别元件,利用带正电荷的金纳米棒对核酸的静电吸附作用,以及对荧光基团的猝灭原理,建立一种特异性强、灵敏度高的SEA检测方法。在优化条件下,SEA线性检测范围为0.01~0.8 μg/mL,检出限为5.66 ng/mL,并将其成功应用于牛奶样品中的SEA检测。
酶联适配体分析技术是将传统 ELISA中的识别元件抗体替换为核酸适配体,借助酶催化显色及信号放大作用实现对目标物的高灵敏度、高特异性检测。因此酶联适配体分析法有望发展成为商业化试剂盒,具有广阔的市场前景。但目前尚未见到基于酶联适配体检测SEA的研究报道。因此,本研究以SEA适配体为识别分子,基于夹心模式建立了一种简便、经济、灵敏的检测新方法,为SEA检测提供新的技术支撑。
1 材料与方法
1.1 材料与试剂
本研宄中所用核酸适配体[23]由生物工程(上海)股份有限公合成并纯化。生物素化适配体 1:5’-bio-TACTTATGCATTTCCTCCCACGATCTTATTT GAGAGTGAC-3’;生物素化适配体 2:5’-bio-AGGCGATTACGCTTCTTGTACTTCAATAAC GACTCAACTC-3’。
SEA、SEB、SEC1,上海起发实验试剂有限公司;牛血清白蛋白(Bovine serum albumin,BSA)、卵清蛋白(Oval abumin,OVA)、吐温-20(Tween-20)、链霉亲和素-辣根过氧化物酶(Streptavidin-horseradish peroxidase,SA-HRP)、TMB显色试剂盒,生物工程(上海)股份有限公司;其余分析纯试剂国药集团化学试剂有限公司;SEA ELISA检测试剂盒,南京卡米洛生物工程有限公司;实验用水为超纯水(18.2 MΩ·cm);链霉亲和素包被的酶标板,苏州海狸生物医学工程有限公司;鸡肉和牛奶等食品样品,本地超市。
1.2 仪器设备
Thermo Scientific™Varioskan Flash全波长扫描式多功能读数仪,美国Thermo公司;5MX 96孔板混匀仪,美国Scilogex公司;5424R台式冷冻离心机,德国Eppendorf公司;Milli-Q Reference超纯水系统,美国密理博公司;万分之一天平,德国Sartorius公司。
1.3 实验方法
1.3.1 酶联适配体分析(ELAA)的建立
酶标板使用前用PBST缓冲液(10 mmol/LPBS,0.05% Tween-20)洗涤3~5次,拍干。加入200 μL适配体1溶液,室温孵育,PBST洗涤、拍干。随后加入300 μL的BSA封闭液,室温孵育,PBST洗涤。加入200 μL待测样品,室温孵育,PBST洗涤。加入200 μL适配体2溶液,室温孵育一定时间,PBST洗涤。然后加入 200 μL SA-HRP,室温孵育20 min,PBST洗涤。加入100 μL TMB底物显色液,反应5~7 min后,加入100 μL终止液终止反应,通过颜色变化定性检测SEA。定量检测时,采用全波长扫描式多功能读数仪在450 nm处测其吸光值。
实验过程中对适配体浓度、封闭剂BSA浓度、封闭时间、SA-HRP浓度、反应体系、靶标与适配体反应时间等条件进行优化。每个实验重复3次。
1.3.2 ELAA检测性能评价
1.3.2.1 灵敏度
在优化条件下,将SEA稀释成系列梯度浓度,采用ELAA方法进行测定,以不同SEA浓度的对数值为横坐标,以SEA各浓度对应的OD450nm值为纵坐标,绘制标准曲线,对标曲进行进行线性拟合,求得线性方程和相关系数。计算¯x0+2s(¯x0和s为10份零标准浓度的吸光值的平均值和标准差),以此该数据在标准曲线上计算出对应的浓度,即为检出限(Limit of detection,LOD)[25]。每个实验重复3次。
1.3.2.2 特异性
采用建立的 ELAA方法分别检测 SEA、SEB、SEC1、BSA、OVA,同时设置空白对照(SEA 适配体筛选缓冲液),以评估方法的特异性。
1.3.2.3 加标回收率
采用加标回收实验来考察该 ELAA方法的准确性。取鸡肉和牛奶空白样品,分别添加低、中、高三种浓度水平的SEA。参照GB/T 4789.10-2016[26]中附录B4.2的方法提取食品中SEA,按照ELAA方法进行检测。根据标准曲线计算样品中各SEA浓度,然后计算加标回收率和其相对标准偏差(Relative standard deviation,RSD)。每个添加水平设置3个重复。
1.3.2.4 重复性实验
采用批内和批间误差以评估ELAA的精密度。批内精密度:分别采集3份SEA添加(阳性)样品及2份空白(阴性)样品,采用同一批次的适配体,在同一块酶标板上对样品进行3次重复检测,测定OD450nm值,计算相对标准偏差(RSD)。批间精密度:按照建立的ELAA方法,采用3个批次的适配体,在同一酶标上分别检测3份阳性样品和2份阴性样品,每个实验重复3次,测定OD450nm值,计算RSD。
1.4 ELAA方法的应用
参照GB/T 4789.10-2016[27]中附录B4.2的方法提取不同食品中SEA。取200 μL样品提取液,按照上述ELAA方法进行检测,计算样品中SEA含量。同时采用国标法(GB/T 4789.10-2016)进行检测,并与检测结果对比验证,以评价本方法的准确性和可靠性。
1.5 数据处理
实验数据用平均值±标准偏差方式表示,采用单因素方差分析(One-WayANOVA)方法分析实验数据,显著性水准为α=0.05,使用Origin 8.5软件制图。
2 结果与分析
2.1 检测条件优化
2.1.1 适配体浓度
适配体1(bio-apt1)的包被浓度对检测灵敏度有一定影响。因此,本实验固定SEA浓度为500 ng/mL,适配体2浓度为100 nmol/L,结合时间1 h,SA-HRP稀释比例为 1:40000,考察了不同 bio-apt1包被浓度(10~200 nmol/L)对检测灵敏度的影响,实验结果如图1a所示。从图中可以看出,吸光值随着bio-apt1包被浓度的增加而增加,意味着结合SEA的量也逐渐增加,当bio-apt1包被浓度超过40 nmol/L后,吸光值变化趋于平缓。因此,后续实验选择40 nmol/L为bio-apt1的包被浓度。
固定适配体1包被浓度,考察适配体2不同浓度(10~200 nmol/L)对检测性能的影响,结果如图1b所示,吸光值随着适配体2浓度的增加而增加,当浓度为40 nmol/L时,吸光值变化趋势平缓。因此,适配体2浓度也选择40 nmol/L。
2.1.2 封闭条件
在酶联适配体分析中,封闭酶标版上多余位点至关重要,若封闭不完全,SA-HRP会与聚苯乙烯板发生非特异性结合,造成较高的背景值[27]。本实验固定适配体浓度为40 nmol/L,采用1% BSA封闭后直接加入 SA-HRP(1:40000,V/V),观察 BSA浓度和封闭时间对SA-HRP非特异性吸附的影响。结果显示(图2),当BSA封闭浓度低于0.5%,封闭不完全,随着BSA浓度的增加,吸光值逐渐下降,说明SA-HRP非特异性吸附降低。另外,非特异性吸附随着封闭时间的延长而降低,当封闭时间超过4 h后,吸光值无明显变化。综上分析,后续实验选择1% BSA封闭4 h。
2.1.3 反应体系对检测性能的影响
适配体的动态结构和稳定性易受环境变化影响,即反应溶液pH、离子成分及浓度等显著影响适配体的亲和力及特异性[28,29],因此最佳的反应缓冲液对检测性能至关重要。本实验分别采用SEA适配体筛选缓冲液(20 mmol/L Tris,100 mmol/L NaCl,5 mmol/L KCl,1 mmol/L CaCl2和 1 mmol/L MgCl2·6H2O,pH 7.4)[23]和10 mmol/L PBS缓冲液(pH 7.4)作为反应溶液用于稀释适配体、样品和 SA-HRP等,考察不同反应体系对检测性能的影响。结果如图3所示,筛选缓冲液作为反应体系时,吸光显著高于10 mmol/L PBS缓冲液。有研究证明,在分析过程中,改变适配体反应体系及离子强度等环境条件可能影响适配体的折叠结构,进而影响靶标与适配体的相互作用[28],故检测体系与配体筛选体系之间的一致性对提高检测性能至关重要。因此,后续实验选择SELEX缓冲液作为检测体系。
2.1.4 反应时间
充足的反应时间可保障SEA与适配体充分结合,但反应时间过长,则会影响检测效率。因此,本实验调查了不同反应时间对检测性能的影响。结果如图4显示,随着结合时间的增加,吸光值逐渐增大,当反应时间超过 30 min后,吸光值没有明显变化。表明SEA与适配体反应30 min即达到平衡状态,延迟反应时间并没有提高检测灵敏度。所以,后续实验选择反应时间为30 min。
2.1.5 SA-HRP稀释比例
SA-HRP是酶联适配体显色反应的关键因素,SA-HRP浓度低,显色反应不充分,浓度过高易引起非特异性吸附。本研究固定以上优化的实验条件,将SA-HPR稀释不同比例(1:10000~1:100000),检测结果如图5所示,当 SA-HRP稀释比例在 1:10000~1:40000范围时,吸光值无明显变化,随着稀释比例进一步增大,吸光值显著降低。故后续实验选择SA-HRP稀释比例为1:40000。
2.2 检测性能评价
2.2.1 灵敏度
在优化条件下,采用ELAA方法测定不同浓度的SEA(0、1、5、10、50、100、500、1000、5000 ng/mL),以SEA不同浓度为横坐标,以各浓度对应的OD450nm值为纵坐标,绘制标准曲线。图6为SEA的剂量反应曲线(外)和标准曲线(内),如图6a所示,OD450nm值随SEA浓度的增加而增大,SEA在5~500 ng/mL浓度范围内与OD值呈良好线性关系,相关系数(R)为0.996。基于¯x0+2s计算方法检出限为0.18 ng/mL。同时溶液颜色的变化与 OD450nm值的变化一致(图6b),在SEA浓度1 ng/mL时,溶液显色呈蓝色,故该方法目测可视化检测限为1 ng/mL。以上结果表明,本方法具有高的灵敏度。
2.2.2 特异性分析
采用ELAA分别检测SEA、SEB、SEC1、BSA、OVA,同时设置空白对照(结合缓冲液),以评估方法的特异性。结果见图7所示,BSA、OVA不产生识别信号,与空白对照吸光值相近,说明适配体与无关蛋白没有交叉反应。但适配体与SEB和SEC1有一定交叉反应,吸光值约 0.12~0.13。这与适配体本身特异性有关,推断原因在于 SEA与 SEB、SEC1具有40%~60%序列同源性,适配体对该共同结构域具有相同的识别位点[23]。
2.2.3 加标回收率
利用所建立的检测方法,对空白样品进行添加回收测定,进一步评价该方法的准确性和精密度。实验结果如表1所示,SEA在空白样品中的平均回收率为91.22%~101.30%,相对标准偏差(RSD)小于6.00%。以上结果说明所建立的 ELAA方法具有较高的准确性。

表1 本方法检测食品中SEA的加标回收率(n=3)Table 1 Recovery rates of SEA spiked from the food by the developed method (n=3)
2.2.4 重复性
采用批内和批间误差评估本方法的精密度。研究结果显示,批内相对标准偏差为2.82%~5.00%(表2),批间相对标准偏差为3.33%~7.50%(表3),结果表明批间和批内重复性良好,本方法具有高的精密度。

表2 批内精密度(n=3)Table 2 The precision of intra-batch (n=3)

表3 批间精密度(n=3)Table 3 The precision of inter-batch (n=3)
2.3 SEA检测方法比较
本研究以适配体代替抗体建立的ELAA方法,具有较高的灵敏度和回收率(见表4),与基于适配体的荧光传感检测方法比较,本方法不需要制备纳米材料和对适配体过多修饰,不需要特殊的仪器,简化了操作步骤。与基于抗体的免疫检测技术比较,本方法所用适配体可体外筛选获得(1~2周)和人工合成,具有制备周期短、成本低等优势,可极大降低检测成本。
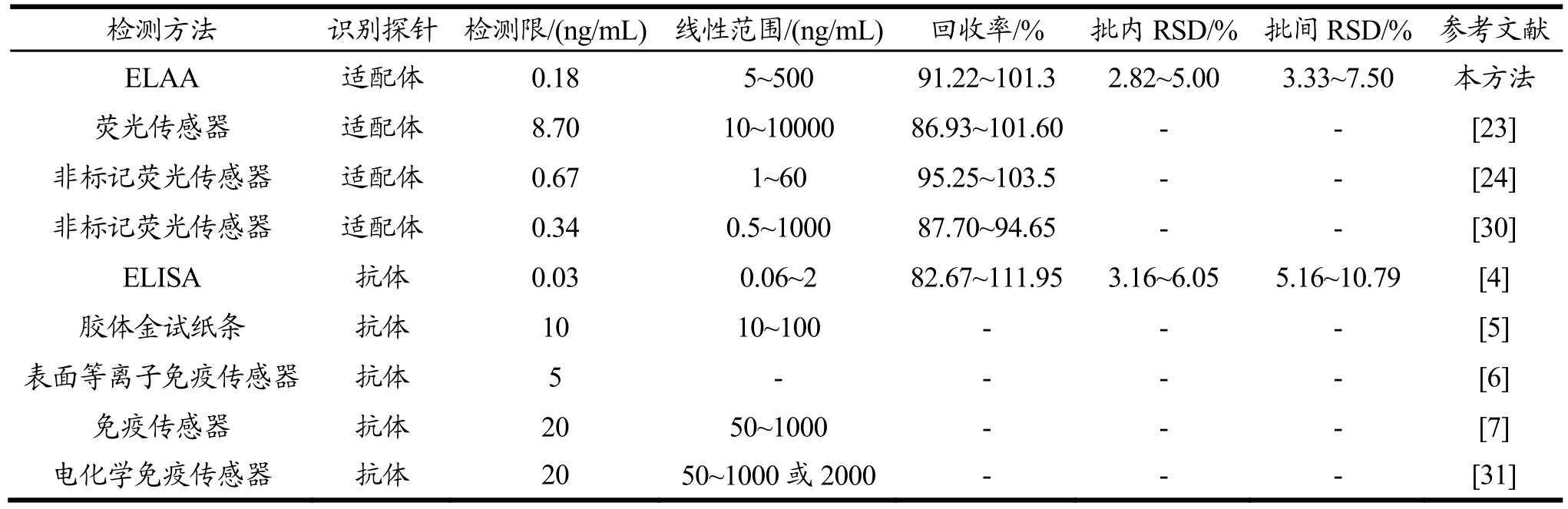
表4 本方法与文献报道方法的检测性能比较Table 4 Comparison of detection performance of between proposed method and reported methods
2.4 检测方法应用
为了验证本方法在实际样品中的应用效果,分别采用本方法与国标方法测定10组加标样本,计算样品中SEA含量。以本方法测定值为X轴,国标法测定值为Y轴作图,将二者浓度值进行相关性分析。从图8中可以看出,两种方法的检测结果具有高的相关性(R2=0.994),表明建立的方法准确度和可靠性较好。
3 结论
本研究以SEA适配体为识别分子,代替抗体建立了一种酶联适配体分析方法,在优化条件下,该方法具有低的检测限(0.18 ng/mL)、高的回收率(91.22%~101.30%)和精密度(RSD<8%)。将建立的ELAA应用于食品中SEA检测,检测结果与国标法相关性较高(R=0.994)。且该方法操作简单,适用于批量样品中SEA的高通量快速筛查。本研究为SEA检测提供一张简便、经济、准确的快速检测新技术。
