γ-氨基丁酸门控氯离子通道受体及其靶标杀虫剂
2022-03-07谭海军
谭海军
(苏州艾科尔化工科技有限公司,江苏昆山 215300)
昆虫的神经-肌肉、生长发育、呼吸和中肠是杀虫剂研发的主要生理学靶标[1]。作为神经肌肉突触间信号传递的重要方式之一,配体门控离子通道(LGIC)在脊椎动物和无脊椎动物体内广泛存在,并对其维持神经系统的正常生理功能和生存起重要作用。破坏LGIC开启或关闭的正常状态,可使靶标昆虫出现快速的肌肉痉挛、行动失调和麻痹瘫痪等症状,停止进食直至死亡。然而,哺乳动物体内LGIC上的受体在生物学结构和性质等方面与昆虫体内的存在较大差异,这使得LGIC受体逐渐成为现代杀虫剂研发的重要靶标资源。其中,以烟碱乙酰胆碱(nACh)、谷氨酸门控氯离子通道(Glu-Cl)和γ-氨基丁酸门控氯离子通道(GABA-Cl)受体为靶标研发的3大类杀虫剂也随之成为畅销全球的重要杀虫剂品类。
与其他LGIC受体靶标杀虫剂相比,GABA-Cl受体靶标杀虫剂(以下简称“GABA-Cl类杀虫剂”)的开发和应用时间较早,但发展较慢。20世纪中后期以来,林丹、狄氏剂和硫丹等多个GABA-Cl类杀虫剂先后得以广泛地开发和应用,对农业害虫和传播疾病虫媒的防控发挥了重要的作用。然而,这些杀虫剂的长期使用也带来了严重的环境安全性和害虫抗药性等问题,严重制约了GABA-Cl类杀虫剂的发展。
随着探索开发具有新颖化学结构和独特作用方式的新品种取得成功,GABA-Cl类杀虫剂又重新成为了研发的热点。氟虫腈、丁虫腈、唑虫酯、nicofluprole、氟噁唑酰胺和溴虫氟苯虫酰胺等多个含有芳基吡唑、异噁唑啉或间苯二酰胺结构的杀虫剂显示出了低害虫抗性风险、高哺乳动物安全性和生态环境相容性,其开发和应用必将为GABA-Cl类杀虫剂的发展注入新的活力,进而为害虫治理提供持续有效的新工具。本文对GABA-Cl受体及其靶标杀虫剂的研发情况进行总结,旨在为GABA-Cl类杀虫剂的研究、开发和应用提供指导。
1 GABA-Cl受体
作为一种重要的动物功能性非蛋白质氨基酸,γ-氨基丁酸(GABA)在神经系统突触前神经元中合成并贮存于突触小泡中。神经元在受到刺激后产生动作电位引发去极化,钙离子随之内流而促使突触小泡移向突触前膜并与之融合,GABA递质以胞吐的方式被释放,经突触间隙后与突触后膜上的特异性氯离子通道受体进行结合,引起该受体构象的变化和氯离子通道的开启。在通道门口暴露出来的大量带正电荷氨基酸残基的带动下,膜外的氯离子流至通道并顺着电位梯度迅速涌入膜内,产生膜电位超极化而诱发抑制性突触后电位(IPSP),使突触后神经元的兴奋性降低而处于保护性状态[2-3]。与乙酰胆碱递质使突触后膜去极化而引起神经元兴奋的生理作用相反,GABA对神经元传递的兴奋起抑制作用。
能识别GABA并与之发生特异性结合而介导GABA生物学功能的受体即为GABA受体。该受体广泛存在于脊椎动物和无脊椎动物的中枢和外周神经系统中,根据其药理特性的不同可分为GABAA、GABAB和GABAC3种类型。其中,GABAB受体为代谢型G蛋白偶联二聚体,GABAA受体和GABAC受体为半胱氨酸-环(Cys-loop)类配体门控离子通道复合五聚体(图1),与烟碱乙酰胆碱(nACh)受体、甘氨酸(Gly)受体和5-羟色胺3型(5-HT3)受体具有共同的遗传起源和相似的氨基酸序列。由于中心为氯离子通道,GABAA受体和GABAC受体又分别被称为GABAA-Cl受体和GABAC-Cl受体,二者合称为GABA-Cl受体。在动物神经系统中,GABAA-Cl受体的分布比GABAC-Cl受体的更为广泛,构成前者的亚基种类也更为丰富。以哺乳动物为例,构成同源或异源GABAA-Cl受体的亚基有16种类型(α1-6、β1-3、γ1-3、δ、ε、π和θ),而构成GABAC-Cl受体的亚基仅有3种类型(ρ1-3)[2]。
构成GABA-Cl受体的亚基都是4重跨膜功能蛋白,由500个左右的氨基酸残基分4个片段区域组成[2,4](图1)。片段TM1、TM2、TM3和TM4为跨膜区域,片段TM1-TM2和TM3-TM4为成环的胞内区域,片段TM1以外延伸的N-端亲水长链(内含由半胱氨酸二硫键与中间13个氨基酸残基组成的环)、片段TM4以外延伸的C-端亲脂短链以及成环的片段TM2-TM3为胞外区域。其中,片段TM3-TM4为最长的胞内环,TM1片段上的脯氨酸残基对该通道的开闭起重要作用,而5个两两靠近亚基上的TM2片段构成了氯离子通道的内壁。
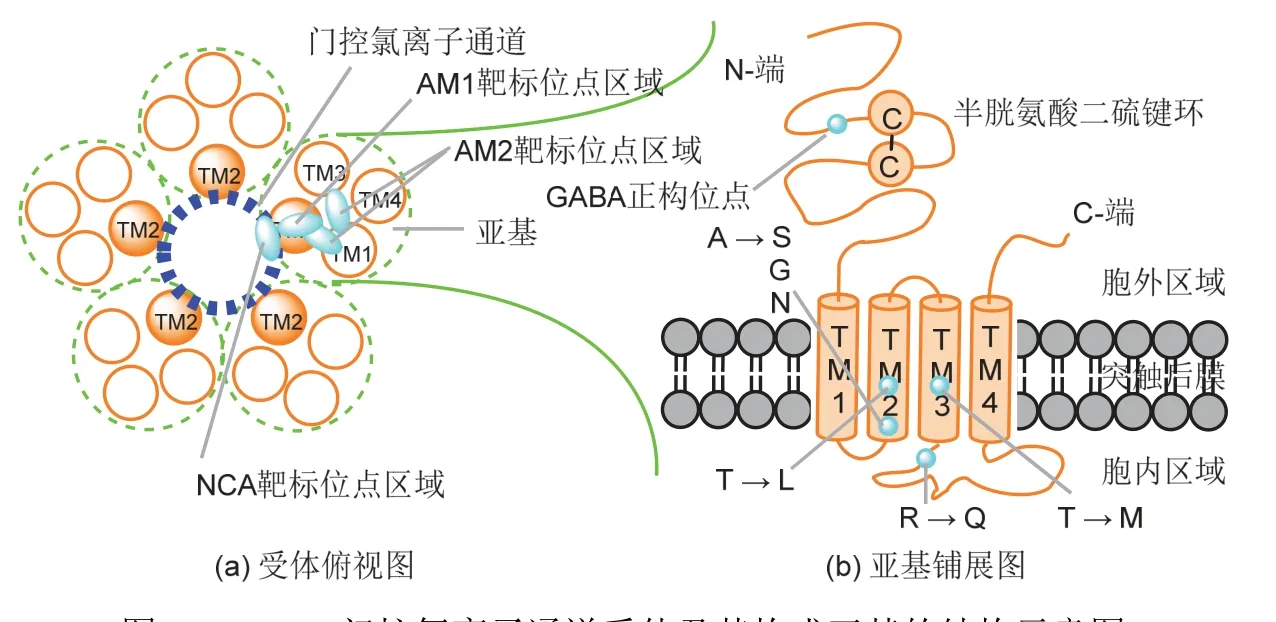
图1 GABA门控氯离子通道受体及其构成亚基的结构示意图
与GABA-Cl受体结合的位点即位于相邻亚基间或单个亚基上,如与内源性GABA结合的正构位点就位于相邻亚基的胞外N-端亲水长链间,与外源性配体结合的变构位点则位于单个亚基的TM2内侧、TM2表面靠氯离子通道内、TM1与TM2间或TM1与TM3间的口袋里(图1)。作为GABA-Cl受体有效的外源性配体,竞争剂在正构位点通过与受体更紧密的结合而抑制内源性GABA的结合,非竞争剂和变构调节剂则在变构位点通过与受体的结合而改变氯通道开放和关闭的时间或频率(非竞争剂不影响内源性GABA与受体的结合)。从对GABA-Cl受体的作用效果来看,激活剂和拮抗剂(包括反向激活剂)可分别激活和抑制氯离子通道的开启状态,内源性GABA可看作是该受体的激活剂。
昆虫体内GABA-Cl受体在结构和功能上与脊椎动物体内的存在较多的相似性,但二者亚基的构成种类不同,生理学和药理学等方面也存在较大的差异[4-7]。构成黑腹果蝇等昆虫GABA-Cl受体的亚基仅有抗狄氏剂受体亚基(RDL)、GABAA/Gly受体样受体亚基(GRD)以及配体门控氯离子通道同源3型受体亚基(LCCH3)3种类型,远少于哺乳动物的19种。昆虫的RDL与脊椎动物GABA-Cl受体亚基的基因序列相似性仅为30%~38%,由RDL构成的受体与哺乳动物GABAA-Cl受体对拮抗剂荷包牡丹碱(bicuculline)的敏感性相反(前者不敏感而后者敏感)[6]。这些都使得基于GABA-Cl受体靶标开发具有广谱杀虫活性和较高选择安全性特点的新型杀虫剂成为可能。
2 GABA-Cl受体靶标杀虫剂
以昆虫GABA-Cl受体为分子靶标,对作用于正构位点和变构位点的外源性配体的研究使得多种具有不同化学结构的GABA-Cl类杀虫剂得以开发。特异性放射配体结合、抗药性物种、定点诱变和分子建模等研究试验结果[8-9]表明,这些GABA-Cl类杀虫剂主要作用于5种不同的靶标位点,即2个非竞争性拮抗剂(NCA)类靶标位点NCA-A和NCA-B,3个变构调节剂(AM)类靶标位点AM1、AM2和AM3。相关杀虫剂及其分类见表1。

表1 GABA-Cl类杀虫剂及其分类
研究表明[1,8-11],作用于不同靶标位点的GABA-Cl类杀虫剂的分子大小和生理化学性质差异较大。其中,分子大小按NCA-B<NCA-A<AM1< AM2/AM3(分别代表相应类别的杀虫剂)依次递增,NCA-A与受体的结合可被AM1和AM2抑制,AM1与受体的结合可被AM2抑制而被NCA-A加强(但异噁唑啉类杀虫剂与受体的结合不受NCA-A的影响或受影响较小),AM2与受体的结合可被AM1抑制但不受NCA-A的影响,NCA-A和AM2与受体的结合均不受AM3的影响。此外,Glu-Cl受体、nACh受体和Gly受体对上述GABA-Cl类杀虫剂也具有一定的敏感性,但低于GABA-Cl受体的[4,12]。Glu-Cl受体和nACh受体比GABA-Cl受体分别对AM2[13]和AM3[9]更敏感,说明大环内酯类杀虫剂的主要作用靶标并非为GABA-Cl受体。由于苦毒宁、TBPS和EBOB一般用作放射性配体试验,林丹、毒杀芬、狄氏剂、氯丹、硫丹和毒鼠强等均也因环境持久性和生物累积性等问题被禁用,以下仅对芳基吡唑类、异噁唑啉类和间苯二酰胺类杀虫剂进行总结。
2.1 芳基吡唑类杀虫剂
2.1.1 研发背景及现状
芳基吡唑类杀虫剂源于拜耳公司(Bayer)及罗纳-普朗克公司(Rhône-Poulenc)对原卟啉原氧化酶(PPO)起抑制作用除草剂的研究。作为第一个商业化的芳基吡唑类杀虫剂,氟虫腈(代号RPA-030、MB46030)[14]由罗纳-普朗克公司最先开发并于1993年投放市场,后又在2003年被剥离给巴斯夫公司(BASF),被广泛用于农业和非农领域害虫防治。法国梅里亚公司(Merial,后被德国勃林格殷格翰公司Boehringer Ingelheim收购)还将其作为动物保健药进行了开发。在2005至2006年间,拜耳公司和诺华公司(Novartis)先后推出了新品种乙虫腈(代号RAP-107382)[15]和pyriprole(代号V3086)[16],分别用作水稻杀虫剂和动物杀外寄生虫药,后来pyriprole还被用于木材和土壤中的白蚁防治。近年来,以氟虫腈为先导化合物自主创制的丁虫腈[17]和唑虫酯[18]在农业上也得到了开发和应用,其中丁虫腈已在中国和越南等国登记上市。然而,由拜耳公司和日本三菱公司(Mitsubishi)开发的另外3个含硫的杀虫剂氟吡唑虫(代号RPA-098231)[19]、乙酰虫腈(代号RAP-115782)[20]和pyrafluprole(代号V3039)[21]一直未见商业化开发,由拜耳公司新开发的2个不含硫的杀虫剂替戈拉纳(代号BCS-CW88522、BAY 1272858)[22]和nicofluprole (代号BCS-CY39089)[23]也鲜见研究报道。上述10个芳基吡唑类杀虫剂的化学结构见图2。
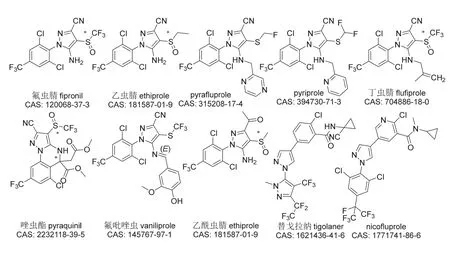
图2 芳基吡唑类杀虫剂的化学结构
2.1.2 化学合成
氟虫腈、氟吡唑虫、乙虫腈、pyrafluprole、pyriprole、乙酰虫腈和丁虫腈都可以1-(4-三氟甲基-2,6-二氯苯基)-3-氰基-5-氨基吡唑(a2)为原料采用相似的策略合成[14-17,19-21,24](图3)。唑虫酯可由氟虫腈的中间体3-氰基-5-氨基-1H-吡唑(b1)[18]或氟虫腈[25]来合成,丁虫腈也可直接由氟虫腈合成(图4)。替戈拉纳和nicofluprole的吡唑环与苯环或吡啶环直接相连,可通过卤代烃与硼烷或硼酸(酯)的偶联反应[22-23,26]来合成(图5)。
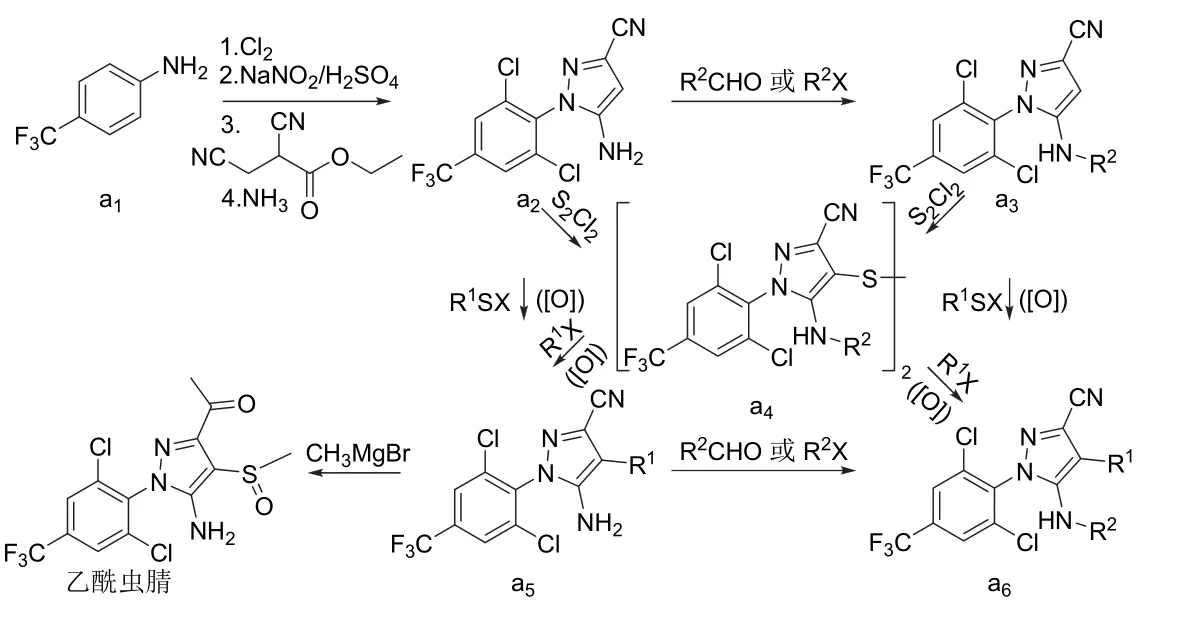
图3 7种芳基吡唑类杀虫剂的化学合成
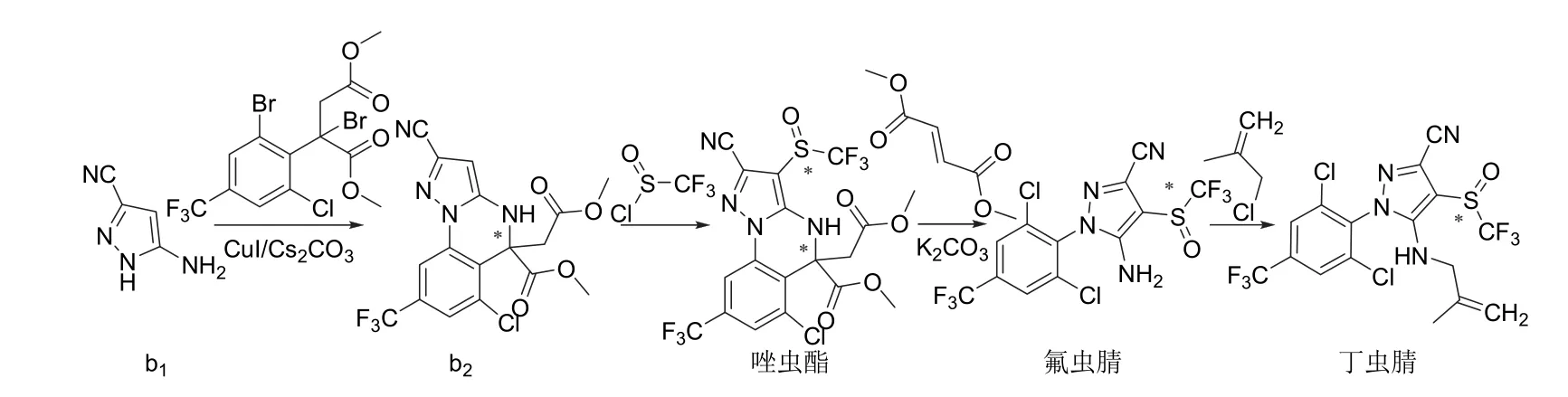
图4 唑虫酯和丁虫腈的化学合成
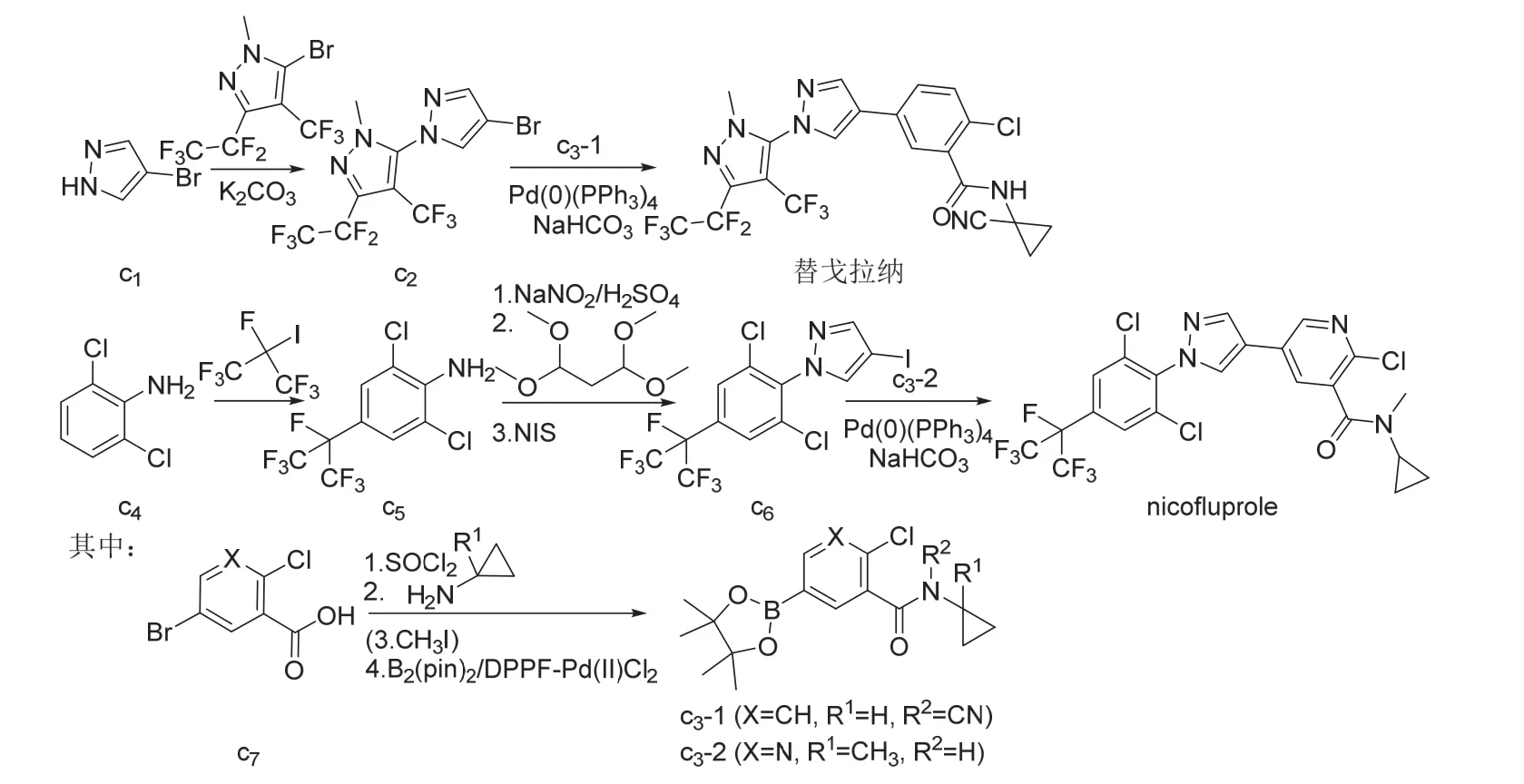
图5 替戈拉纳和nicofluprole的化学合成
2.1.3 作用机制
芳基吡唑类杀虫剂可同时作用于昆虫神经系统GABA-Cl受体、Glu-Cl受体和甘氨酸门控氯离子通道(Gly-Cl)受体[27-28],有效地阻断介导抑制性神经传递的氯离子流,从而引起昆虫的过度兴奋、抽搐和死亡。由于哺乳动物体内缺少Glu-Cl受体,且其GABA-Cl受体与昆虫体内的存在较大差异,芳基吡唑类杀虫剂对昆虫表现出了更高的选择毒性。在进入昆虫体内后,该类杀虫剂经细胞色素P450酶系氧化得到的代谢产物砜对GABA-Cl受体、脱敏型和非脱敏型Glu-Cl受体(脱敏型Glu-Cl受体需要预先激活)也具有拮抗作用,重复激活Glu-Cl受体还可加强其作用效果[29]。乙虫腈单一对映体及其外消旋体与GABA-Cl受体的结合无显著差异,但在昆虫体内的活性却存在差异[30],这可能与其代谢差异等因素有关。
根据国际杀虫剂抗性行动委员会(IRAC)的分组[1],芳基吡唑类杀虫剂主要为GABA-Cl受体非竞争性拮抗剂,其作用位点与狄氏剂和硫丹等多氯环烷烃和环戊二烯类杀虫剂的不同。丁虫腈和唑虫酯对氟虫腈产生抗药性的褐飞虱[31]、小菜蛾、甜菜夜蛾、小猿叶甲(Phaedon brassicae)和黄条跳甲[34]也有效,这说明它们对受体的作用位点和结合方式等与氟虫腈的不同。对抗性的微小牛蜱(Rhipicephalus microplus)的生测结果[22-23]也说明,替戈拉纳和nicofluprole可能存在新的作用方式。
2.1.4 生物活性
芳基吡唑类杀虫剂一般以触杀和胃毒作用为主,氟虫腈、乙虫腈和丁虫腈等还兼具一定的内吸活性,对白蚁等害虫没有趋避作用。该类杀虫剂对鳞翅目、半翅目、鞘翅目、双翅目、缨翅目、直翅目、蜚蠊目、等翅目、膜翅目和蜱螨目等多种类别的害虫以及线虫具有广谱活性,对低龄幼虫活性优于高龄的,广泛用于多种行栽和特种作物种植、谷物贮藏,以及公共卫生和动物保健等非农用领域。然而,各品种之间的生物活性又呈现出一定差异。氟虫腈对蚜虫、叶蝉、苍蝇、白蚁,以及鳞翅目幼虫和鞘翅目等害虫具有很高的杀虫活性[24,33]。乙虫腈对鳞翅目害虫的活性不如氟虫腈,但在植物体内的高内吸传导性加强了对蝽类害虫的活性[24,33]。乙酰虫腈对南方根结线虫(剂量10 g/kg土壤)、棉蚜、麦二叉蚜和家蝇的生物活性较好[20]。氟吡唑虫对烟青虫、亚热带黏虫(Spodoptera eridania)、墨西哥豆瓢虫(Epilachna varivestis)和家蝇等害虫具有广谱活性[19]。Pyrafluprole和pyriprole可用于蚜虫、褐飞虱、绿豆象、斜纹夜蛾和小菜蛾等农业害虫防治[24]。丁虫腈对菜青虫和二化螟的生物活性与氟虫腈大致相当,但对桃蚜和二斑叶螨无效[24]。唑虫酯在质量浓度100~500 mg/L时喷洒或饲喂对小菜蛾、甜菜夜蛾、豆蚜、红火蚁、小猿叶甲、黄条跳甲和草地贪夜蛾等的防效在90%以上[18,34-35]。替戈拉纳[22]和nicofluprole[23]在质量浓度100~500 mg/L时对桃蚜、辣根猿叶甲(P. cochleariae)、草地贪夜蛾、铜绿蝇(Lucilia cuprina)、家蝇和二斑叶螨等多种害虫具有优异的杀虫活性。
在动物保健方面,替戈拉纳[22]和nicofluprole[23]按剂量5 μg/cm2或5 μg/动物或100 mg/L饲喂、注射或喷洒对猫栉头蚤(Ctenocephalides felis)、希伯来花蜱(Amblyomma hebraeum)、红扇头蜱(R. sanguineus)和微小牛蜱等体外寄生害虫具有优异的成虫杀灭作用和卵孵化抑制活性。Pyriprole以浓度12.5 mg/kg施用1次可在30 d内控制狗身上寄生的猫栉头蚤[32]、蓖 麻 硬 蜱(Ixodes ricinus)、网纹 革蜱(Dermacentor reticulatus)和红扇头蜱[36],以及兔子外寄生螨虫羊痒螨(Psoroptes ovis)和驼背螨(Leporacarus gibbus)[37],并有效缓解由其引起的皮肤病。
对于存在立体异构的杀虫剂,氟虫腈[38]和乙虫腈[30]分别对小菜蛾、棉红蝽(Dysdercus cingulatus)、谷象、家蝇、褐飞虱、豌豆蚜虫(Acyrthosiphon pisum)等害虫无显著的立体选择活性差异,而唑虫酯4个对映异构体的杀虫活性则有所不同[34]。
2.1.5 安全性
芳基吡唑类杀虫剂对哺乳动物、蚯蚓、家蚕、鸟类、鱼类、捕食性天敌和作物等非靶标生物相对安全,但对传粉昆虫和水生生物存在一定的风险。氟虫腈对大型溞和藻类等水生生物和蜜蜂具有高风险,对鱼类、鸟类和哺乳动物还存在一定的毒性,在水和土壤中降解也较慢[24,33],现在中国已被限用作卫生杀虫剂和种子包衣处理剂。Pyriprole对哺乳动物和水中生物也存在不同程度的毒性[24]。乙虫腈大大提高了对哺乳动物安全性和在环境中的降解速率,丁虫腈对哺乳动物、鱼类、鸟类和家蚕均低毒,然而它们都还是对家蚕、蜜蜂和赤眼蜂等存在中到高风险[24,30,33,39],乙虫腈由于难被土壤吸附而对水生生物产生的影响也值得注意。新开发的唑虫酯对蜜蜂和斑马鱼的毒性较低[34],乙酰虫腈[20]、替戈拉纳[22]和nicofluprole[23]对哺乳动物安全。此外,氟虫腈[40]和乙虫腈[39]对蜜蜂等非靶标生物无立体选择毒性差异,无法通过手性拆分来降低其环境风险。
2.2 异噁唑啉类杀虫剂
2.2.1 研发背景与现状
异噁唑啉类杀虫剂是在研究双酰胺类杀虫剂过程中发现的,但其作用靶标却并非鱼尼丁受体,而是抑制GABA诱导的氯离子流[12]。氟噁唑酰胺(代号NC-515、A253)[41]是日产公司(Nissan)开发的第一个异噁唑啉类杀虫剂品种,但其在韩国、日本和美国等国的登记(商品名Gracia®)直到2018年才获批,现已用于蔬菜、果树、棉花和茶树等作物的蓟马、粉虱、潜叶蝇、甲虫和螨虫等害虫防治。第一个真正商业化的异噁唑啉类杀虫剂为阿福拉纳[42],由法国梅里亚公司开发并由德国勃林格殷格翰公司将其作为动物杀外寄生虫药在美国FDA登记。后来,由默克公司(Merck)、礼来动保公司(Elanco)和硕腾动保公司(Zoetis)分别开发的氟雷拉纳(代号A1443)[43]、洛替拉纳[44]和沙罗拉纳(代号PF-06450567)[45]也获得了美国FDA的登记批准。这些异噁唑啉类杀外寄生虫剂一般被制成咀嚼片剂或外用液,用于杀死猫和狗身上的猫栉头蚤,同时预防、治疗或控制蚤类和蜱类外寄生虫的感染及由其直接引起或媒介传播的疾病,具有优异的广谱性、速效性、持效性(1~2 m)、安全性和便捷性。在此之前,先正达公司(Syngenta)还研制出了新杀虫剂异噁唑虫酰胺(代号SYN547407)[46],于2013年开始在巴西、乌克兰、印度和印度尼西亚等国开展制剂0.01% RB、0.05% RB和100 g/L DC等在农业害虫防治上的试验研究。此外,阿福拉纳的(S)-对映异构体艾司索拉纳也正在开发之中。上述7个异噁唑啉类杀虫剂的化学结构见图6。
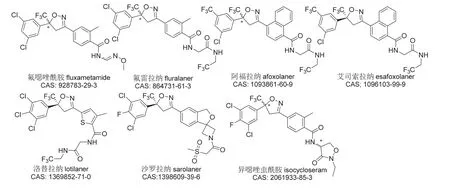
图6 7个异噁唑啉类杀虫剂的化学结构
2.2.2 化学合成
氟噁唑酰胺[41]、氟雷拉纳[43,47]和异噁唑虫酰胺[46]、阿福拉纳[42]和沙罗拉纳[45,48]分别可以3-甲基-4-溴苯甲醛、4-溴-1-萘甲醛或3-溴-4-碘苯甲醛(d1)为原料采取相似的策略来合成(图7),洛替拉纳[44]可以1-(4-甲基-5-溴-2-噻吩)乙酮(e1)或4-甲基-5-溴-2-噻吩甲醛(e4)为原料采用不同的环合次序策略来合成(图8)。艾司索拉纳、洛替拉纳和沙罗拉纳等手性异构体(f6)可由外消旋体进行手性分离得到,或直接进行不对称合成[49-50]来制备(图9)。
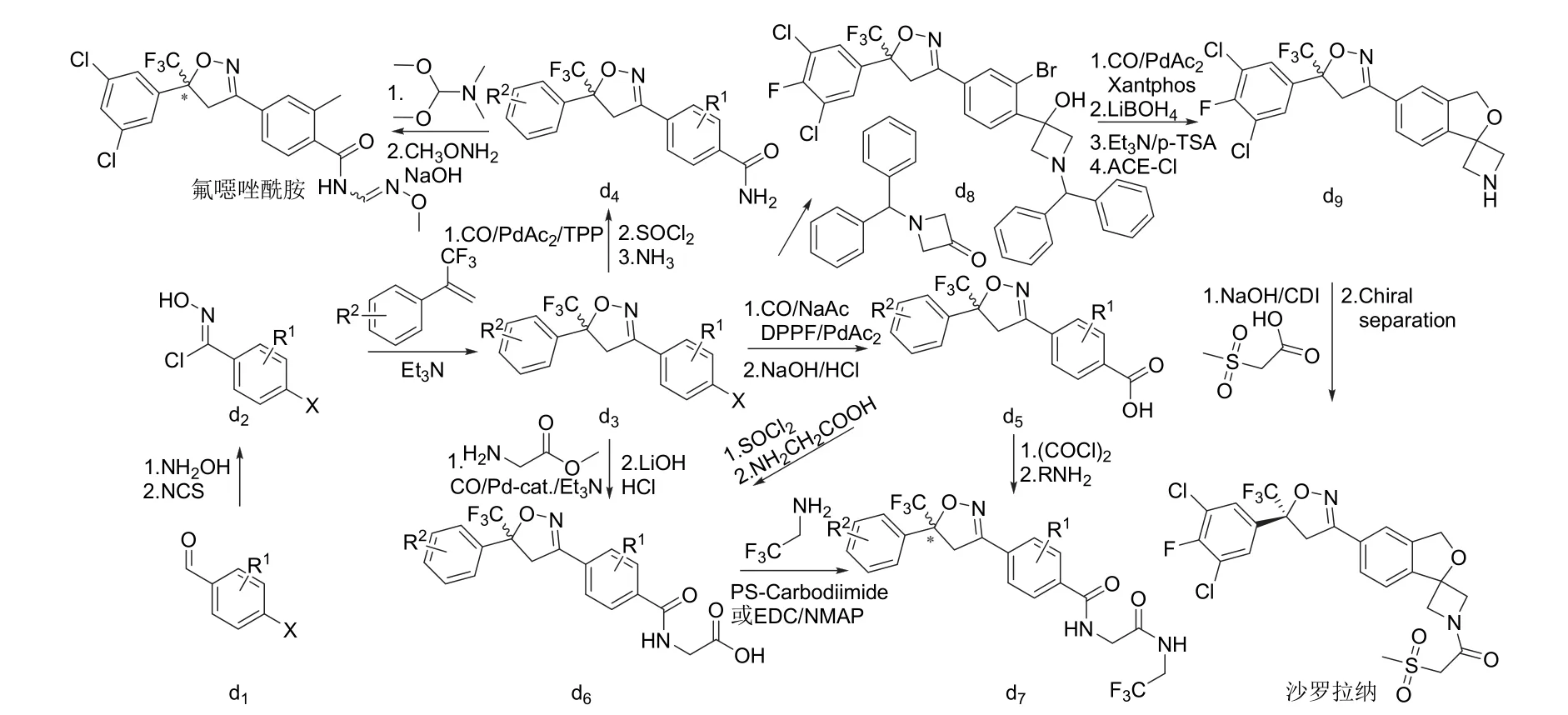
图7 异噁唑啉类杀虫剂的化学合成

图8 洛替拉纳的化学合成
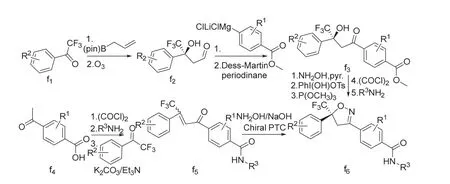
图9 (S)-异噁唑啉类杀虫剂的化学合成
2.2.3 作用机制
异噁唑啉类杀虫剂主要作用靶标为GABA-Cl受体[1],但其作用位点和作用方式等与NCA存在差异,与狄氏剂、氟虫腈等环戊二烯类和芳基吡唑类杀虫剂不存在或存在较低的交互抗性。低浓度的阿福拉纳[48]、氟雷拉纳[51]、洛替拉纳[52]和沙罗拉纳[53]即可有效抑制果蝇和猫栉头蚤等靶标害虫体内GAGA诱导的氯离子流,且各自对敏感品系和抗狄氏剂品系的抑制效果相近。氟雷拉纳[54]和氟噁唑酰胺[55]对抗氟虫腈的灰飞虱和二斑叶螨等害虫也有效。在无脊椎动物体内,氟雷拉纳[51,56]和洛替拉纳[52]对RDL构成的GABA-Cl受体的作用高于苦毒宁、狄氏剂和氟虫腈的。在家蝇体内,氟雷拉纳与靶标受体的结合对阿维菌素敏感而对氟虫腈、硫丹和狄氏剂不敏感[7,11,47],这说明氟雷拉纳的靶标作用位点与氟虫腈、硫丹和狄氏剂不同,可能与阿维菌素存在重叠。分子配体模拟结果显示,氟噁唑酰胺的作用位点位于GABA-Cl亚基跨膜区域TM2的表面(图1),而阿维菌素等大环内酯类杀虫剂的作用位点则位于Glu-Cl的外部[57]。
电生理学研究表明,氟雷拉纳和氟噁唑酰胺都可阻滞家蝇和微小牛蜱体内GABA和谷氨酸诱导的氯离子流,但GABA-Cl受体的敏感性是Glu-Cl受体的15~115倍左右[51,55-56]。GABA-Cl受体亚基TM3上的L315碱基突变后会显著提高氟雷拉纳对Glu-Cl受体的抑制活性,但会消除电流激活和增强效应[58]。然而,与对节肢动物的作用相比,氟噁唑酰胺对鼠GABA-Cl受体和人Gly-Cl受体的拮抗作用几乎微不足道[55]。
2.2.4 生物活性
异噁唑啉类杀虫剂具有高靶向活性,对小菜蛾、斜纹夜蛾、甜菜夜蛾、茶长卷蛾(Homona magnanima)、棉铃虫、桃小食心虫、草地贪夜蛾、西花蓟马、棕榈蓟马、日本二星蝽(Eysarcoris lewisi)、稻褐飞虱、桃蚜、银叶粉虱、日本臀纹粉蚧(Planococcus kraunhiae)、烟粉虱、玉米蜡蝉(Peregrinus maidis)、黄守瓜(Aulacophora femoralis)、马铃薯叶甲(Empoasca fabae)、三叶草斑潜蝇(Liriomyza trifolii)、二点斑叶螨、埃及伊蚊和铜绿蝇、侧多食跗线螨(Polyphagotarsonemus latus)和桔刺皮节蜱(Aculops pelekassi)等多种靶标害虫的卵、幼(若)虫和成虫均有较高生物活性。其中,氟雷拉纳对猫栉头蚤、微小牛蜱和红扇头蜱雌成虫、非洲钝缘蜱(Ornithodoros moubata)若虫等动物外寄生虫的生物活性优于氟虫腈、狄氏剂、吡虫啉和溴氰菊酯的[56],对外寄生蜱虫的杀虫活性优于跳蚤的[51]。阿福拉纳在质量浓度50 mg/L时对小菜蛾幼虫、草地贪夜蛾若虫、马铃薯叶甲和西花蓟马成虫杀死率(6 d)不低于80%,按剂量2.5 mg/kg单次口服对狗身上的猫栉头蚤和美洲狗蜱等外寄生虫30 d左右的防效达到90%以上[42,59]。沙罗拉纳对猫栉头蚤、软蜱(Ornithidorus turicata)和西方角蝇(Haematobia irritans)等外寄生虫具有超高生物活性[45],按剂量1.25~5 mg/kg的单次口服对猫栉头蚤、红扇头蜱、蓖麻硬蜱和网纹革蜱等多种蚤蜱28~30 d内的稳定防效达到99%以上,优于氟雷拉纳和阿福拉纳的[48,53]。洛替拉纳对黑腹果蝇、鲑鱼虱(Lepeophtheirus salmonis)和微小牛蜱的生物活性与氟虫腈相当[52],其外消旋体对猫栉头蚤和红扇头蜱灌胃或喷洒的EC90≤100 mg/kg[44]。异噁唑虫酰胺在质量浓度200 mg/L时对海灰翅夜蛾(Spodoptera littoralis)、小菜蛾、玉米根虫(Diabrotica balteata)、美洲烟夜蛾(Heliothis virescen)、桃蚜、葱蓟马和二点斑叶螨等害虫的杀死率不低于80%[46]。此外,异噁唑啉类杀虫剂具有较高的生物利用率和蛋白结合率,如沙罗拉纳用后1 d在动物体内的浓度达到最高值[53],外寄生害虫在2~72 h被麻痹、击倒,停止进食直至死亡[45]。然而,由于接触活性低、效力中等且作用较慢[60],氟雷拉纳并不适合用作蚊虫等媒介控制。
异噁唑啉类杀虫剂的主要活性成分为(S)-对映体,而(R)-对映体多无杀虫活性或活性相对较低[41,51-52],异噁唑虫酰胺以(5S,4R)-对映体的活性最高[46]。以氟噁唑酰胺[57]和沙罗拉纳[45,48]为例,其对小菜蛾、甜菜夜蛾、棉蚜、朱砂叶螨、猫栉头蚤和软蜱的杀虫活性都按(R)-对映体<外消旋体<(S)-对映体的顺序依次递增。这可能与活性异构体更利于与靶标蛋白结合的高疏水(亲脂)性,以及与靶标受体残基作用的强范德华力和静电(如氢键和阳离子-π作用等)有关[57]。对于甜菜夜蛾、桃小食心虫、桔刺皮节蜱、猫栉头蚤、美洲犬蜱、德国小蠊和家蝇等靶标害虫,氟噁唑酰胺的(Z)-式异构体显示出了比(E)-式异构体更高的杀虫活性[41]。与多异构体混合物相比,活性异构体可以更大限度地减少脱靶效应。
2.2.5 安全性
异噁唑啉类杀虫剂对猫和狗等哺乳动物相对安全,但有可能引起一些动物的肌颤、运动失调和癫痫等神经系统不良反应,同时对蜜蜂等有益昆虫可能存在一定的毒性。氟雷拉纳与家蝇和蜜蜂体内GABA-Cl受体结合的亲和力相近,大于鼠和人等哺乳动物的[51,56],而与哺乳动物受体结合的亲和力也远远低于氟虫腈和环氧七氯的[11]。阿福拉纳[44]、洛替拉纳[52]和沙罗拉纳[53]对哺乳动物安全,洛替拉纳在浓度高达10 μM时也对狗的GABAA-Cl受体无活性,沙罗拉纳按口服剂量的数倍到数十倍(20 mg/kg)也对狗的健康无不利影响。
氟噁唑酰胺对哺乳动物低毒,对鸟类、鱼类、水生甲壳、底栖生物和藻类等均为低毒,但对蜜蜂和家蚕存在急性经口毒性[61]。虽然氟噁唑酰胺对蜜蜂的急性接触毒性按(R)-对映体<(S)-对映体<外消旋体顺序依次降低,但其(S)-对映体对蜜蜂还是存在一定的毒性[57]。
2.3 间苯二酰胺类杀虫剂
2.3.1 研发背景与现状
间苯二酰胺类杀虫剂也是在研究双酰胺类杀虫剂的过程中偶然发现的,其特征结构与双酰胺类杀虫剂的相似但作用机制不同(因而也常常被归入双酰胺类杀虫剂)[62-64],目前已有溴虫氟苯双酰胺(代号MCI-8007、MIE-1209FL)和环丙氟虫胺(代号CAC-I-785) 2个品种得到了开发。其中,溴虫氟苯双酰胺[65]是日本三井农业化学公司(Mitsui)以氟苯虫酰胺先导化合物进行结构优化得到的首个间苯二酰胺类杀虫剂,可用于公共卫生及蔬菜、豆类和土豆等作物的苍蝇、白蚁、蚂蚁、蜚蠊、斜纹夜蛾、棉铃虫、草地贪夜蛾、菜心螟、小菜蛾和黄条跳甲等害虫防治。巴斯夫公司最先于2019年在澳大利亚取得该产品的卫生杀虫剂登记,随后还获得中国和日本等国的农药登记,而在美国、巴西、加拿大、墨西哥、印度和澳大利亚等国的登记也在进行之中。环丙氟虫胺[66]是将环丙甲基引入先导化合物溴虫氟苯双酰胺得到的自主创制品种,对水稻、玉米、棉花、大豆、果树和蔬菜等作物的鳞翅目类敏感及抗性害虫具有较高杀虫活性。目前,该品种已成为与先正达公司战略合作的重磅产品,在中国的农药登记也正在进行之中。间苯二酰胺类杀虫剂兼具良好的速效性与持效性,对现有品种无交互抗性,成为了当前研究和开发的热点,具有非常广阔的市场前景。溴虫氟苯双酰胺和环丙氟虫胺的化学结构见图10。
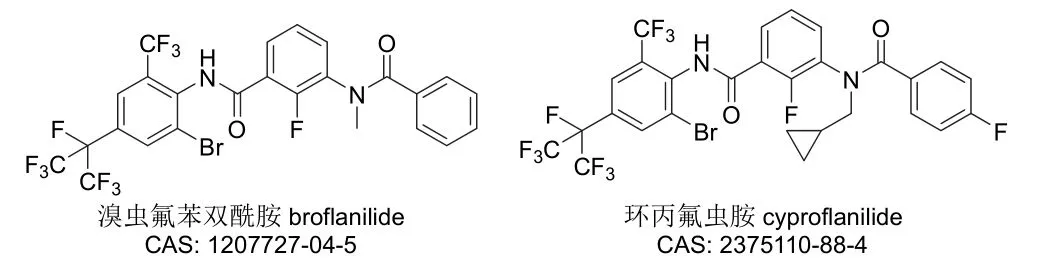
图10 溴虫氟苯双酰胺和环丙氟虫胺的化学结构
2.3.2 化学合成
溴虫氟苯双酰胺和环丙氟虫胺可由6-三氟甲基-4-七氟异丙基-2-溴-苯胺(g2)分别直接与2-氟-3-(N-甲基苯甲酰氨基)苯甲酰氯(g3-1)[65,67]和2-氟-3-[4′-氟-N-(环丙基甲基)苯甲酰氨基]苯甲酰氯(g3-2)[66]发生酰胺化得到,或先后经酰胺化、氟取代、硝基还原、烷基化和酰胺化得到(图11)。
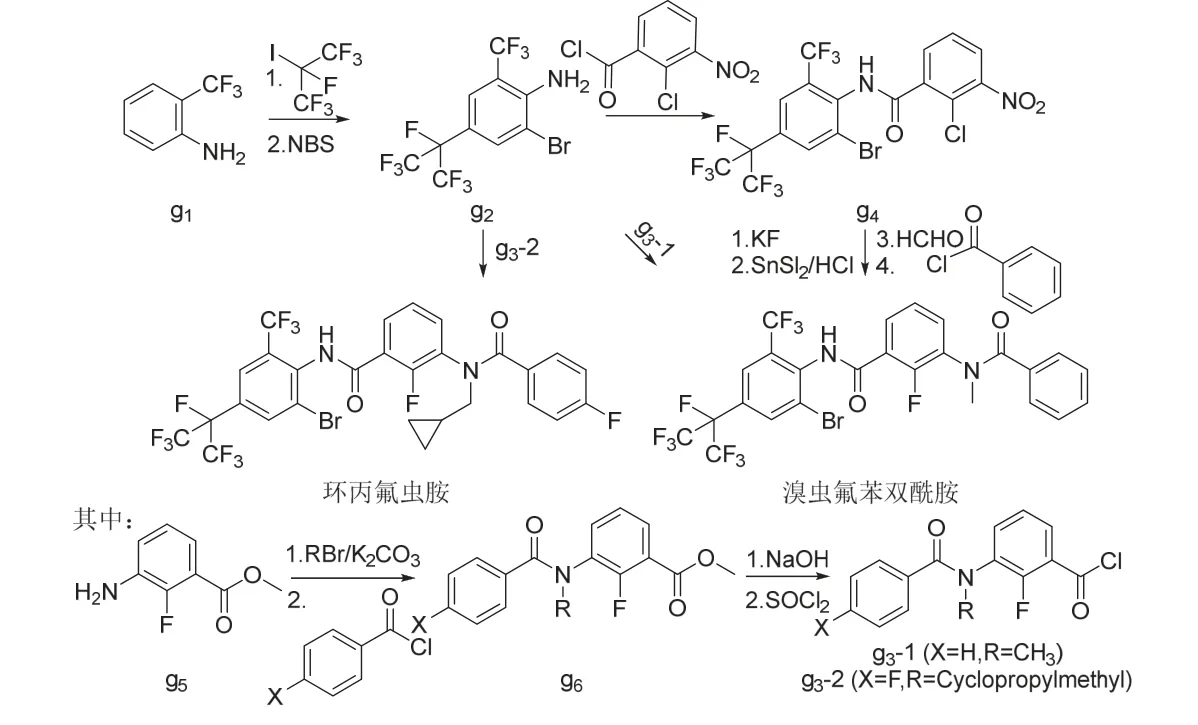
图11 溴虫氟苯双酰胺和环丙氟虫胺的化学合成
2.3.3 作用机制
溴虫氟苯双酰胺为前体杀虫剂,在靶标害虫体内代谢活化为脱甲基化合物mDA-7而发挥作用[68]。与氟噁唑酰胺等异噁唑啉类杀虫剂相同,溴虫氟苯双酰胺也为GABA-Cl受体变构调节剂[1]。从化学结构、中毒症状、杀虫谱和交互抗性等方面的相似性可以推测,环丙氟虫胺的作用机制与溴虫氟苯双酰胺相同。
间苯二酰胺类杀虫剂对GABA-Cl受体的抑制活性与昆虫RDL亚基TM2上A2´和T6´是否发生突变无关,但与TM3上纯合而非杂合突变的G336 (斜纹夜蛾的等效位点为G319)及其附近TM1上的I277和L281的突变相关[68-69],这与氟虫腈、苦毒宁、狄氏剂、硫丹和林丹等传统NCA的刚好相反。分子模型研究[68-70]结果表明:与NCA和GABA-Cl受体激活剂依托咪酯(etomidate)分别位于离子通道内部和亚基跨膜片段内部口袋里的结合位点不同,间苯二酰胺类杀虫剂与受体的结合位点可能位于RDL构成的受体G336或附近亚基跨膜区域TM1-TM3间的口袋里。间苯二酰胺类杀虫剂似乎与大环内酯类杀虫剂在GABAA-Cl受体上的作用位点存在重叠,但二者与该受体的结合方式不同,受亚基TM1上的I277F和L281C、TM3上的V340Q和V340N以及TM2上的A2´的突变的影响也不同,同时对Glu-Cl受体的作用效果也相差较大[70-71]。GABA-Cl在关闭状态下有利于与间苯二酰胺类杀虫剂的结合,反之则有利于与大环内酯类杀虫剂的结合。
哺乳动物GABAA-Cl受体中只有π亚基上存在果蝇G336的等效甘氨酸残基,间苯二酰胺类杀虫剂与其靶标位点结合的特异性低于氟虫腈,因而对哺乳动物具有更高的安全性[68,72]。
2.3.4 生物活性
间苯二酰胺类杀虫剂对鳞翅目、鞘翅目、缨翅目、双翅目、等翅目、膜翅目和蜚蠊目等多种类别害虫具有广谱生物活性,与新烟碱类、有机磷、氨基甲酸酯、沙蚕毒素类杀虫剂,以及三唑类和甲氧基丙烯酸酯杀菌剂等复配预混或桶混具有增效或相加作用。溴虫氟苯双酰胺在质量浓度1~100 mg/L时对斜纹夜蛾、小菜蛾、茶小卷叶蛾(Adoxophyes honmai)、茶长卷蛾、棉铃虫、水稻灰飞虱、棕榈蓟马、家蝇、德国小蠊和台湾乳白蚁(Coptotermes formosanus)等具有很高的杀虫活性[65,73],对小菜蛾的杀虫活性与氯虫苯甲酰胺大致相当[74]。环丙氟虫胺对小菜蛾、黏虫、二化螟、稻纵卷叶螟、斜纹夜蛾和甜菜夜蛾等的杀虫活性也很突出,对二化螟的LC50(3 d)为0.453 mg/L,显著优于阿维菌素、氯虫苯甲酰胺和甲氧虫酰肼[75-77]。田间试验表明[75],10%环丙氟虫胺SC按有效成分15~60 g/hm2施用对二化螟和稻纵卷叶螟药后20~21 d的防效达到92%以上,对小菜蛾药后10 d的防效达到98%以上。
特别地,溴虫氟苯双酰胺对氯虫苯甲酰胺和甲维盐产生抗性的棉铃虫和甜菜夜蛾也有效[78],环丙氟虫胺对抗性二化螟的防效显著优于阿维菌素、氯虫苯甲酰胺和虫螨腈的[75]。
2.3.5 安全性
间苯二酰胺类杀虫剂对靶标害虫具有较高的选择活性,对哺乳动物等非靶标生物相对安全。溴虫氟苯双酰胺对大型溞和藻类中毒,对鱼类高毒[79]。环丙氟虫胺对哺乳动物和斑马鱼、泥鳅、羊角月牙藻、大型溞、小龙虾和中华绒鳌蟹等非靶标生物(包含作物)的安全性相对较高[75]。
3 总结与展望
作为一种重要的内源性神经元递质,GABA通过与GABA-Cl受体进行特异性结合而诱导快速的氯离子流,在神经兴奋的传递中起抑制性保护作用。GABA-Cl受体广泛存在于脊椎动物和无脊椎动物的神经系统中,不同种类昆虫的GABA-Cl受体亚基间的同源性高、与哺乳动物的存在较大差异,使得该受体成为杀虫剂研发的理想靶标。由此开发的GABA-Cl类杀虫剂对鳞翅目、鞘翅目、半翅目、缨翅目、双翅目、蜚蠊目、等翅目、膜翅目和蜱螨目等类别害虫具有广谱的高选择活性。不同化学结构类别的杀虫剂在GABA-Cl受体作用位点和作用方式等方面存在差异,相互间的交互抗性风险较低。
新型芳基吡唑类、异噁唑啉类和间苯二酰胺类杀虫剂具有更低的哺乳动物毒性和更高的环境生态安全性,其在农业和动物保健等领域的开发和应用,可填补由林丹、狄氏剂和硫丹等高风险杀虫剂禁用所带来的空缺,为害虫抗性治理和综合防治提供持续有效的新工具。未来,可加强这些新型杀虫剂在小菜蛾、蓟马、果实蝇和线虫等顽固性和耐药性农业害虫防治方面的应用研究和推广。然而,不容忽视的是,它们还是对传粉昆虫和大型溞等无脊椎动物具有较高毒性,对有益天敌昆虫也存在一定影响,应加强研究并采取技术性措施加以控制。一方面,可通过开发具有协同增效作用的复配制剂或桶混组合、使用科学的用药规范和综合防治技术,降低该类杀虫剂的施用剂量,减轻或避免对有益生物和人类环境健康的不利影响。另一方面,可深化对靶标和非靶标生物的构效关系研究,重视活性异构体的开发,通过靶向设计来开发选择安全性更高的新型杀虫剂。此外,如何通过集约化生产和工艺优化来降低成本并提高药效对GABA-Cl类杀虫剂的应用开发也具有重要意义。
