多菌协同发酵生产低醇玉米芯饮品的工艺研究
2022-03-06陆步诗王婧璇李新社伍强
陆步诗,王婧璇,李新社,伍强
(1.邵阳学院 食品与化学工程学院,湖南 邵阳,422000;2.生态酿酒新技术与应用湖南省重点实验室,湖南 邵阳,422000)
玉米芯富含膳食纤维、矿物质、粗蛋白、粗脂肪等营养成分[1],具有防癌通便、降低胆固醇等药理作用[2-4]。玉米芯所含的膳食纤维对人体有一定保健功效[5],可降低人体血糖和胆固醇水平,消除外来有毒害物质,促进矿物元素的吸收[6-7]。有预防结肠癌、心脑血管等方面疾病的作用,然而玉米芯通常被丢弃焚烧,面临资源浪费、破坏生态环境等问题。近些年,对玉米芯的开发利用,主要通过物理、化学、生物等技术对玉米芯进行加工处理,获得需要的目的产物,实现资源的多重利用[8]。林标声等[9]利用菌霉协同发酵玉米芯制备饲料。冀晓珊等[10]向再生砂浆中混合粉碎后的玉米芯颗粒,制备玉米芯骨料生态混凝土。LI等[11]以玉米芯为原料,γ-戊内酯为溶剂,利用稀硫酸做介质催化玉米芯生产糠醛。
低醇饮品酒精含量通常在0.5%~7%[12],可以加速血液循环,减少体内脂肪沉淀。采用多菌协同发酵制备玉米芯保健饮品,具有降低胆固醇、促进肠胃消化等功效[13]。利用玉米芯生产低醇保健饮料,陆步诗等[14-15]采用多菌协同发酵生产低醇玉米芯饮品,玉米芯中的不溶性膳食纤维通过发酵转化为可溶性膳食纤维,可溶性膳食纤维能清除自由基,具有良好的抗氧化活性[16]。因此,利用多菌协同发酵生产低醇玉米芯饮品可以达到优化资源和保健的双重效果。
1 材料与方法
1.1 材料和菌种
干玉米芯(市场购买);黑曲霉(GDMCC 3.488)、米根霉(GDMCC 3.132)、酿酒酵母(GDMCC 2.167)均购自广东省微生物菌种保藏中心;纤维素酶(酶活5万U/g)、半纤维素酶(酶活3万U/g)均购自南宁庞博生物工程有限公司。
1.2 仪器与设备
G154DWS型立式自动压力蒸汽灭菌锅(致微(厦门)仪器有限公司);SW-CJ-1FD单人单面垂直净化工作台(苏州博莱尔净化设备有限公司);IS-RSD3 台式恒温振荡器(北京科伟永兴仪器有限公司);GH4500型隔水培养箱(天津市泰斯特仪器有限公司);3H16RI智能高速冷冻离心机(湖南赫西仪器装备有限公司);722型可见分光光度计(上海舜宇恒平科学仪器有限公司)。
1.3 试验方法
1.3.1 工艺方法
玉米芯酶解液→高压灭菌(121 ℃,15 min)→接种(无菌条件下活化接种,根据所需以玉米芯酶解液体积分数确定总接种量,设定酿酒酵母为总接种量的70%、黑曲霉与米根霉接种量按体积分数配比)→摇床培养(设置所需的温度和时间进行发酵,150 r/min)→检测理化指标并进行感官评价。
1.3.2 玉米芯酶解液制备
玉米芯→粉碎、过筛(450 μm[14])→干燥(75 ℃,24 h)→混料(m玉米芯∶V蒸馏水=1∶20 (g/mL)[15])→调节pH(5.0±0.2[15])→酶解(m纤维素酶∶m半纤维素酶=13∶2,酶添加量为2.5%,酶解温度为50 ℃,酶解时间为5 h)→离心得玉米芯酶解液。
1.3.3 菌种活化与种子液制备
1)培养基配制。PDA培养基(培养黑曲霉和米根霉):20%的马铃薯汁1 L,葡萄糖20 g,KH2PO43 g,MgSO4·7H2O 1.5 g,维生素B1 8 mg,琼脂20 g,pH自然(液体培养基不加琼脂)。YM培养基(培养酿酒酵母):蛋白胨5 g,葡萄糖10 g,酵母粉3 g,麦芽提取物3 g,蒸馏水1 L,琼脂20 g,pH为6.2(液体培养基不加琼脂)。
2)菌种活化。菌种→100 mL液体培养基活化→转接至固体培养基,28 ℃恒温培养(黑曲霉和米根霉5 d、酿酒酵母2 d)→选取单菌落于液体培养基扩大培养至浓度为1×108CFU/mL(温度时间同上)→4 ℃条件下储存备用。
1.3.4 单因素试验
预试验确定酿酒酵母接种量为总接种量的70%,菌种浓度为1×108CFU/mL,设置黑曲霉与米根霉的配比分别为(1∶3,1∶2,1∶1,2∶1,3∶1)、菌接种量(体积分数)分别为(0.4%,0.6%,0.8%,1.0%,1.2%)、发酵温度分别为(24 ℃,26 ℃,28 ℃,30 ℃,32 ℃)和发酵时间分别为(1 d,2 d,3 d,4 d,5 d)4个因素,确定其他3个因素条件不变,进行单因素试验,做3次重复的平行试验,检测发酵液的酒精度、残糖量并进行感官评价,以确定每个因素的最佳条件。
1.3.5 响应面试验
根据单因素试验。以黑曲霉与米根霉菌种配比(A)、两菌混合接种量(B)、发酵温度(C)、发酵时间(D)为因素,以酒精度为响应值,进行四因素三水平的响应面试验设计,设计表见表1。
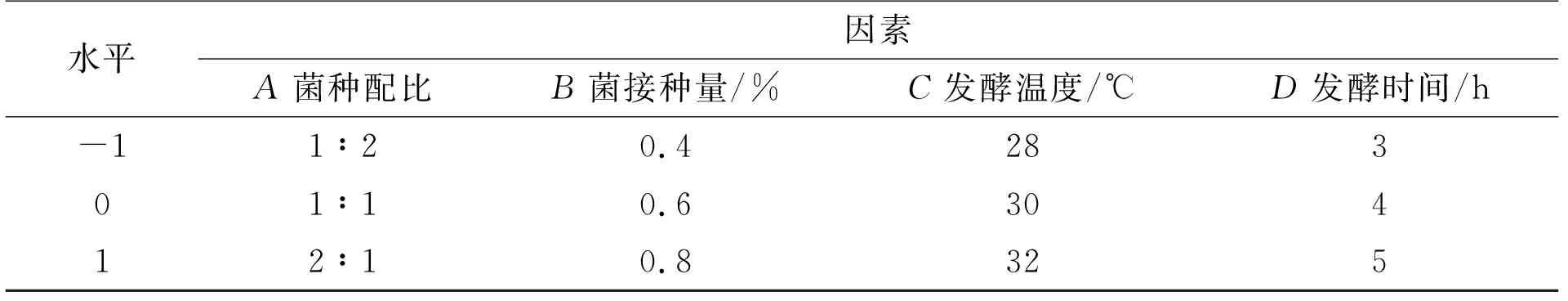
表1 响应面试验设计
1.3.6 测定方法
酒精度:根据 GB 15038—2006《葡萄酒、果酒通用分析方法》,采用酒精计法测定;
残糖量:根据3,5-二硝酸水杨酸法[17]测定;
感官评价:由10位食品感官评定人员对口感、气味、色泽和体态等方面进行评分,评价标准见表2。

表2 感官评价标准
2 结果与分析
2.1 菌种配比对酶解液发酵的影响
确定酿酒酵母接种量为总接种量的70%,黑曲霉与米根霉配比分别为1∶3,1∶2,1∶1,2∶1和3∶1,菌接种量为0.6%,发酵温度为30 ℃,发酵时间为4 d的条件下进行发酵,通过检测酒精度、残糖量并对其进行感官评价,分析菌种配比对酶解液发酵的影响,结果见图1。由图1可知:酿酒酵母利用酶解液中所含还原糖来保证自身生长繁殖的代谢活动,并进行发酵产酒[18]。添加黑曲霉与米根霉会在发酵过程中对发酵液中除还原糖以外的糖类物质进行糖化作用。当酿酒酵母接种量为混合菌种接种总量的70%、黑曲霉与米根霉配比为1∶2时,还原糖转化率最高,此时发酵液中残糖量最低、产酒量最高,感官评分也达到了最大值。因此,选择菌种配比为1∶2作为最佳发酵配比。

图1 菌种配比对酶解液发酵的影响Fig.1 Influence of strain proportion on the fermentation of enzymatic hydrolysate
2.2 菌接种量对酶解液发酵的影响
确定酿酒酵母接种量为总接种量的70%,黑曲霉与米根霉配比为1∶2,菌接种量分别为0.4%,0.6%,0.8%,1.0%和1.2%,发酵温度为30 ℃,发酵时间为4 d的条件下进行发酵,通过检测酒精度、残糖量并对其进行感官评价,分析菌接种量对酶解液发酵的影响,结果见图2。由图2可知:当两菌种混合接种量为0.6%时,酿酒酵母分解还原糖,使发酵玉米芯酶解液酒精度最高。当增加黑曲霉与米根霉接种量后,黑曲霉与米根霉会进一步分解玉米芯生成还原糖,但还原糖含量达到一定量后会对糖化酶形成反馈抑制作用[19]。且黑曲霉与米根霉接种量过高,会跟酵母竞争酶解液中的营养物质,从而导致酒精度下降。同时,菌种过高会使有机酸增多[20],影响产品口感。因此,当菌接种量为0.6%时,发酵效果最佳。

图2 菌接种量对酶解液发酵的影响Fig.2 Influence of the amount of bacteria inoculation on the fermentation of enzymatic hydrolysate
2.3 发酵温度对酶解液发酵的影响
确定酿酒酵母接种量为总接种量的70%,黑曲霉与米根霉配比为1∶2,菌接种量为0.6%,发酵温度分别为24 ℃,26 ℃,28 ℃,30 ℃和32 ℃,发酵时间为4 d的条件下进行发酵,通过检测酒精度、残糖量并对其进行感官评价,分析发酵温度对酶解液发酵的影响,结果见图3。由图3可知:当温度过低时,不利于霉菌生长代谢,随着温度升高,产酒量增加。当温度升高到30 ℃后,继续升高会加速酵母的生长速度,使酿酒酵母的死亡加快,产生酸败使酒精度下降[21]。因此,选择30 ℃为最佳发酵温度。

图3 发酵温度对酶解液发酵的影响Fig.3 Influence of fermentation temperature on the fermentation of enzymatic hydrolysate
2.4 发酵时间对酶解液发酵的影响
确定酿酒酵母接种量为总接种量的70%,黑曲霉与米根霉配比为1∶2,菌接种量为0.6%,发酵温度为30 ℃,发酵时间分别为1,2,3,4和5 d的条件下进行发酵,通过检测酒精度、残糖量并对其进行感官评价,分析发酵温度对酶解液发酵的影响,结果见图4。由图4可知:发酵时间为1 d时,酶解液本身有玉米香气,但没有酒精味,继续发酵,随着霉菌糖化变大,酒精含量也增大。当发酵时间达到4 d后,发酵时间继续增加,酒精含量增加不明显,霉菌活性也有所降低[22],因此,选择4 d作为最佳发酵时间。
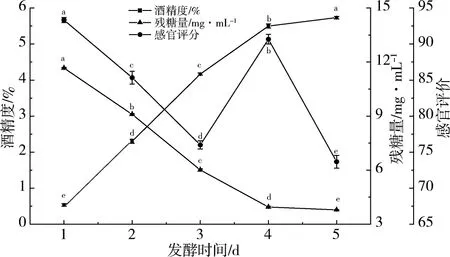
图4 发酵时间对还原糖含量的影响Fig.4 Influence of fermentation time on reducing sugar content
2.5 响应面试验结果与分析
2.5.1 响应面试验结果
根据单因素试验结果以菌种配比、菌接种量、发酵温度和发酵时间为变量因素,以酒精度作为响应值,进行四因素三水平的响应面设计试验,确定多菌协同发酵生产低醇玉米芯饮品的最佳发酵工艺条件,结果见表3。

表3 响应面试验结果
将表3中数据用Design-Expert.V8.0.6.1软件经过回归拟合后,得到的二次多项回归方程:W=5.56-0.18×A+0.23×B+0.13×C+0.68×D+0.080×AB+0.60×AC-0.36×AD-0.62×BC-0.14×BD-0.032×CD-0.65×A2-0.62×B2-0.38×C2-0.81×D2。回归方程中,W为酒精度,A为菌种配比、B为菌接种量、C为发酵温度、D为发酵时间。通过软件进行分析后得到关于此模型的回归系数及其方差分析结果,见表4。
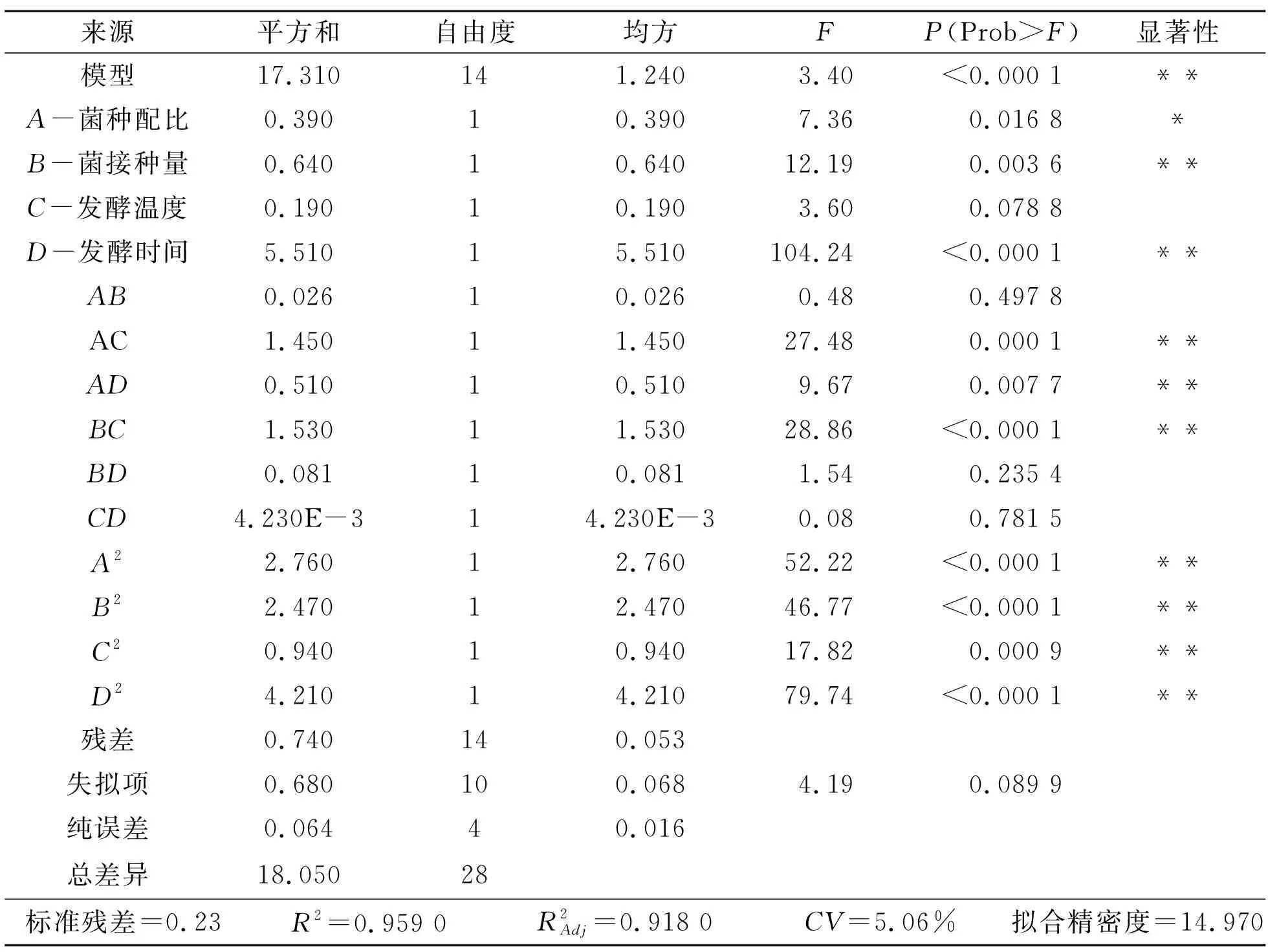
表4 响应面试验的方差分析结果

2.5.2 影响因素的交互作用分析
影响因素的交互作用见图5。由图5可知:随着菌种配比、菌接种量、发酵温度和时间的增加,多菌协同发酵玉米芯酶解液产生的酒精度是逐渐增加的,但增加到一定程度后,酒精度呈下降趋势。菌接种量与发酵温度间的交互作用是极显著的,与模型中方差分析结果无异。且等高线图的椭圆和稀疏程度与3D响应面图的弯曲程度都与模型预测一致[23]。

图5 各因素交互作用等高线及响应曲面图Fig.5 Contours and response surfaces of the interaction of various factors
2.5.3 最优条件的选取与验证
根据响应面模型的预测结果,由黑曲霉、米根霉和酿酒酵母协同发酵玉米芯酶解液的最佳发酵条件是:总接种量为0.68%,其中,酿酒酵母为总接种量的70%,黑曲霉与米根霉接种量配比为1∶1.47,发酵温度为28.83 ℃,发酵时间为4.52 d,此条件下响应面软件预测的酒精度为5.79%。为验证回归模型预测,选择总接种量为0.68%,其中,酿酒酵母接种量为总接种量的70%,黑曲霉与米根霉接种量配比为1∶2,发酵温度为29 ℃,发酵时间为4.5 d的条件下进行3次平行试验,重复试验结果取平均值后得到的酒精度为5.65%,与模型预测的结果相差不大,表明该模型可以有效反映各因素对酒精度的影响,模型可行。
因此,选用多菌种协同对玉米芯酶解液进行发酵,通过单因素试验,确定多菌协同发酵生产低醇玉米芯饮品的最佳条件为:菌种总接种量为0.68%,酿酒酵母接种量为菌种总接种量的70%,黑曲霉与米根霉接种量配比为1∶2,发酵温度为29 ℃,发酵时间为4.5 d,此条件下得到的玉米芯发酵液酒精度为5.65%,残糖量为3.88 mg/mL,感官评分为92分。
