白藜芦醇对脑缺血再灌注大鼠JNK、P38和神经元凋亡的影响*
2022-03-06李世英张晋霞张志勇
李世英 张晋霞 张志勇 张 蕊 任 伯 刘 斌
(华北理工大学附属医院,河北 唐山 063000)
脑血流的恢复是缺血性卒中后生存的基础[1]。然而,脑血管再通后可能通过钙超载、炎症反应、凋亡、血脑屏障(BBB)损伤等机制进一步加重脑组织的损伤[2-3],这就是脑缺血再灌注损伤,但其具体机制尚不清楚。凋亡是由Bcl-2家族和Fas系统等促凋亡和抗凋亡蛋白调控[4-5],在缺血-再灌注损伤(I/R)的过程中起着非常重要的作用。研究证实,如果细胞的凋亡受到抑制,I/R损伤的程度将有所减轻[6-7]。在线粒体信号通路中,Bcl-2家族在凋亡中起着关键性作用。Bcl-2与Bax之间的平衡发生改变可能会加重或抑制神经元细胞的凋亡。在I/R损伤的机制中,JNK、ERK1/2和p38等信号通路在调控细胞凋亡中发挥重要作用[8-10]。ERK信号通路启动自我修复过程,在脑I/R损伤的恢复中发挥重要作用。p38和JNK是细胞应激的介质,参与炎症和神经元细胞凋亡[11]。
1 材料与方法
1.1 实验动物
SPF级健康雄性SD大鼠购于北京华阜康公司,许可证号SCXK(冀)2015-0038,共36只,鼠龄为8~10周,体质量250~300 g。实验动物饲养于华北理工大学屏障动物实验室,室内温度维持在21~23℃,湿度保持在50%~60%。36只SD大鼠随机分为假手术组、I/R组、Res组,每组12只。6只大鼠用于制备石蜡组织块,进行HE染色和TUNEL染色,6只大鼠用于Western blotting法检测大鼠脑组织JNK、p-JNK、P38、p-P38的表达。
1.2 试药与仪器
白藜芦醇购自Sigma公司(货号R5010,含量≥99%),TUNEL试剂盒购自武汉博士德公司,JNK、p-JNK、P38、p-P38抗体均购自abcam公司。光学显微镜购自日本OLYMPUS公司,蛋白电泳仪购自北京六一公司,SDS-PAGE电泳槽购自美国Bio-Rad公司。
1.3 模型制备
参照改良的Longa法[13],大鼠称重后用10%水合氯醛按照350 mg/kg腹腔麻醉。颈部正中切口,钝性分离出右侧颈总动脉(CCA)、右侧颈外动脉(ECA)和右侧颈内动脉(ICA)。结扎右侧ECA,CCA、ICA用动脉夹夹闭。在右侧颈外A刺破一小口,将MCAO线栓从ECA缓慢插入,松开右侧CCA动脉夹,将MCAO线栓插入右侧CCA,深度一般为(18.5±0.5)mm,感到有阻力感后停止,逐层缝合。2 h后缓慢将线栓拔出约10 mm。假手术组只分离相应的血管,但不结扎血管。神经功能检查由2名不知情人员进行,0分为没有神经功能缺陷,1分为大鼠左前爪无力,2分为大鼠走路时向左转,3分为大鼠走路时向对侧摔倒,4分为大鼠不能自然行走,甚至出现昏迷。选取0~3分大鼠进行后续实验。
1.4 分组及给药
随机将大鼠分为假手术组、模型组、白藜芦醇组,每组12只。造模成功后,白藜芦醇组在2 h将MCAO线栓拔出即刻给予腹腔注射白藜芦醇40 mg/kg,假手术组大鼠同一时间腹腔注射等体积0.9%氯化钠注射液。
近年来,晚霜、倒春寒、冰雹等自然灾害都会导致樱桃减产甚至绝收。其中,倒春寒导致樱桃花期授粉受精不良,每年樱桃损失约20%的产量;雹灾在果实膨大接近成熟期时危害樱桃果实,可导致15%~85%的樱桃受损;成熟期遇阴雨天气,可导致近20%的樱桃果实采前落果和裂果。虽然全区一直在增强对基地建设的支持力度,但绝大多数果园投入侧重于保证樱桃苗木的定植成活,少有果园在机耕道、生产便道、小水窖及其他必要农机的配套上实现相对完善,严重影响樱桃果实采收后的运输,增加了果品种植和采收成本,降低了种植户的经济效益,削弱了抵御自然灾害的能力。
1.5 标本采集与检测
1.5.1 大鼠脑组织的病理学观察 大鼠I/R后24 h,每组各取6只大鼠,麻醉后断头取脑,用4%多聚甲醛固定脑组织,石蜡包埋,用切片机切成4 μm厚的切片,按照HE染色步骤进行去脂,苏木精伊红染色,封片。使用光镜观察大鼠脑组织的病理学变化。
1.5.2 Western blotting法 大鼠I/R后24 h,每组取6只大鼠,麻醉后迅速断头取脑,取新鲜脑组织,4℃生理盐水冲洗。收集脑组织,放入-80℃冰箱储存待用。制备蛋白样品:取出所需的脑组织样本,在预冷过的玻璃器皿中研磨至粉末,加入裂解液,冰上放置30 min,放入4℃离心机中,12 000 r/min离心20 min,取上清待测。使用BCA蛋白试剂盒测定蛋白的浓度。将100 μg蛋白与缓冲液混合,取适量蛋白上样,经10% SDS电泳结束后,用湿转法将蛋白转移到硝酸纤维素膜上,然后用5%脱脂奶粉在室温下孵育1 h,加入不同的已稀释的一抗,4℃过夜。洗膜,加入相应的二抗,室温孵育2 h。对条带进行扫描,用Quantity One图像软件分析条带结果。
1.5.3 TUNEL法 严格按照TUNEL试剂盒的实验方法进行操作。将制备好的脑组织石蜡切片常规进行脱蜡水化,PBS冲洗3 min共3次;37℃胃蛋白酶孵育60 min,PBS冲洗3 min共3次;3% H2O2在37℃孵育30 min,PBS冲洗3 min共3次;37℃TUNEL反应液孵育60 min,PBS冲洗3 min共3次;辣根过氧化酶抗体37℃孵育30 min,PBS冲洗3 min共3次;DAB显色,自来水冲洗,苏木素复染,梯度酒精进行脱水,二甲苯透明,中性树胶封固。光镜下观察大鼠凋亡细胞:阳性的细胞为神经元细胞核被染成棕黄色颗粒,计算细胞凋亡率(%)=凋亡数/总细胞数×100%。
1.6 统计学处理
使用IBM SPSS24.0统计软件进行分析,数据以()来表示。多组间比较釆用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠神经行为学评分比较
见表1。脑缺血再灌注后1 d,白藜芦醇组大鼠的神经功能缺损评分与模型组比较差异有统计学意义(P<0.05)。说明白藜芦醇在大鼠脑缺血再灌注后可以明显减轻大鼠神经功能受损程度。
表1 各组大鼠神经功能缺损评分及梗死侧神经细胞凋亡率比较(±s)

表1 各组大鼠神经功能缺损评分及梗死侧神经细胞凋亡率比较(±s)
注:与模型组比较,*P<0.05,**P<0.01;与假手术组比较,△P<0.05,△△P<0.01。下同。
组 别n 神经功能缺损评分(分)n 凋亡率(%)假手术组模型组白藜芦醇组12 12 12 0.00±0.00 2.46±0.38 1.86±0.52*6 6 6 1.64±0.53 29.37±6.32△△19.36±3.85**△△
2.2 各组大鼠脑组织病理学观察
光镜下假手术组脑组织结构正常,未发现神经元有明显的破坏或神经元发生缺失。神经元细胞核结构正常,核仁清晰,细胞的包浆丰富。与假手术大鼠相比,模型组大鼠梗死侧脑组织结构紊乱,神经元细胞的数量明显减少,体积缩小,细胞核发生固缩。白藜芦醇组与模型组比较,神经元数量有所增多,细胞水肿较轻,神经元结构破坏程度较I/R组有所减轻。结果显示白藜芦醇可以改善I/R大鼠的脑组织的损伤程度。见图1。
2.3 各组大鼠梗死侧神经细胞凋亡情况
见图2,表1。凋亡细胞核深染,出现皱缩,假手术组中仅观察到少量tunel阳性细胞。模型组组大鼠tunel阳性细胞明显多于假手术组(P<0.01)。白藜芦醇组tunel阳性细胞明显少于模型组(P<0.01)。提示白藜芦醇可以减轻I/R大鼠脑组织凋亡的发生。
2.4 各组大鼠梗死侧脑组织JNK、p-JNK、P38、p-P38表达的比较
见图3,表2。结果显示,JNK和p38在各组脑组织中的表达无明显差异(P>0.05)。假手术组p-P38的表达较弱,脑缺血再灌注后明显上调了p-P38的表达,与假手术组比较差异有统计学意义(P<0.05)。白藜芦醇组下调了p-P38的表达,与模型组相比,差异有统计学意义(P<0.05)。假手术组p-JNK的表达较低,脑缺血再灌注后明显上调了p-JNK的表达,与假手术组比较差异有统计学意义(P<0.05)。白藜芦醇组下调了p-JNK的表达,与模型组相比,差异有统计学意义(P<0.05)。
表2 各组大鼠梗死侧脑组织JNK、p-JNK、P38和p-P38蛋白表达比较(±s)
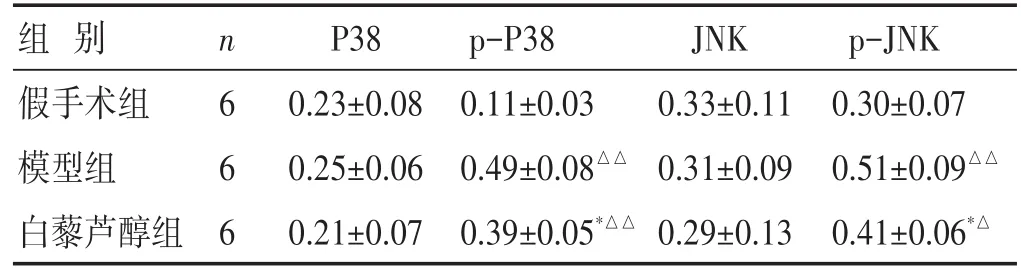
表2 各组大鼠梗死侧脑组织JNK、p-JNK、P38和p-P38蛋白表达比较(±s)
组别假手术组模型组白藜芦醇组n 6 6 6 P38 0.23±0.08 0.25±0.06 0.21±0.07 p-P38 0.11±0.03 0.49±0.08△△0.39±0.05*△△JNK 0.33±0.11 0.31±0.09 0.29±0.13 p-JNK 0.30±0.07 0.51±0.09△△0.41±0.06*△
3 讨 论
据估计,中风的终生风险为8%~10%。缺血性卒中占所有卒中的85%,出血性卒中占15%[14]。缺血性脑中风严重影响人类的健康,其发病机制主要是由I/R引起。I/R损伤机制,主要包括能量谷氨酸毒性、Ca2+超载、氧化应激、炎症反应[15]、一氧化氮(NO)合成过度、细胞凋亡等诸多原因[16-17]。丝裂原活化蛋白激酶(MAPKs)在神经细胞的生长和增殖中发挥作用。MAPKs信号通路在神经系统中广泛表达,调控脑I/R损伤后神经细胞的修复或凋亡[18]。MAPKs的主要3个亚家族:细胞外信号调节激酶(ERKs)、c-Jun n端激酶(JNKs)和p38激酶[19]。在脑缺血再灌注过程中,许多凋亡调节信号通路被激活,如ERK1/2、JNK和p38信号通路。这些通路在调控细胞凋亡中起着关键作用[20]。ERK是激活基因表达的信号分子,有研究报道ERK1/2激活通过调节Bcl-2家族表达促进脑细胞增殖,调控缺血诱导的细胞凋亡[21]。JNK通路也通过与线粒体凋亡机制相互作用在细胞凋亡中发挥重要作用。Tournier等[22]发现JNK磷酸化可调节缺血性损伤中与凋亡相关的下游信号通路。p38 MAPK已被证明在局灶性脑缺血后被激活,p38通路通过PARP和Caspase-9介导的机制参与细胞凋亡[23]。这些信号通路调控细胞凋亡,主要涉及Bcl-2家族。
中医学称中风为中风病,属于急症,以口舌歪斜、言语不利、肌肤不仁、半身不遂、甚至昏仆、不省人事为主要临床表现,辨证分型分为中脏腑、中经络。
1940年白藜芦醇首次从白藜芦根中提取出来,1963年白藜芦醇从中药虎杖中提取出来。研究发现,白藜芦醇具有防辐射、抗氧化应激、抗癌、延缓衰老、保护心脏和神经、抗炎、抗微生物、免疫调节等特性。研究报道[24]白藜芦醇能明显改善大鼠神经功能,减少大鼠脑梗死体积,减少神经元损伤,显著降低神经元的凋亡。白藜芦醇显著上调了p-JAK2、p-STAT3、p-AKT、p-mTOR和BCL-2的表达,下调了cleaved Caspase-3和BAX的表达。提示白藜芦醇对大鼠I/R具有神经保护作用,其部分机制可能与激活JAK2/STAT3和PI3K/AKT/mTOR有关。白藜芦醇可能通过激活JAK2/STAT3间接上调PI3K/AKT/mTOR通路。我们前期报道[12]白藜芦醇可以上调Bcl-2,下调Bax的表达,参与凋亡的发生发展。但是白藜芦醇对大鼠脑缺血再灌注后JNK、P38是否有影响尚不明确。在本研究中,我们使用TUNEL法观察白藜芦醇对MCAO大鼠凋亡的影响,结果显示:模型组大鼠脑组织的凋亡细胞明显高于假手术组,白藜芦醇组凋亡细胞低于模型组,差异有统计学意义。说明白藜芦醇可以减轻大鼠神经元的凋亡程度。采用Western blotting法观察I/R后脑组织中JNK、p-JNK、P38、p-P38的表达,结果显示:JNK和p38在各组脑组织中的表达无明显差异,脑缺血再灌注后明显上调了p-JNK、p-P38的表达,与假手术组比较差异有统计学意义,这与文献报道结果一致[25]。白藜芦醇组下调了p-JNK、p-P38的表达,与模型组相比,差异有统计学意义。
综上所述,本研究结果提示白藜芦醇对大鼠脑缺血再灌注损伤的保护作用,可能是通过下调p-JNK、pp38的水平,减少大鼠神经元的凋亡起作用的。
