电针足三里对牛磺胆酸钠诱导的重症急性胰腺炎大鼠炎症反应及小肠SIgA表达的影响*
2022-03-06胡航绮
栗 浩 文 谦 胡航绮 潘 慧 徐 旭 李 宁△
(1.四川大学华西医院,四川 成都 610041;2.四川大学华西第四医院,四川 成都 610041;3.四川省南充市身心医院,四川 南充 637700)
重症急性胰腺炎(SAP)是临床常见急腹症,是多种病因导致胰酶在胰腺内被激活后引起自身组织消化、水肿、出血、坏死的炎症反应,其发病急骤,可引起严重的局部和全身并发症,病死率高达36%~50%[1]。肠道是SAP病理生理过程中最早也是最易受损的器官之一,SAP并发肠道动力障碍造成肠道内细菌和内毒素排泄障碍,导致细菌过度生长、肠道黏膜屏障受损,细菌入血或迁移到腹腔,从而引发全身炎症反应综合征和多器官功能障碍,是导致SAP患者病死的重要原因[2-4]。因此,恢复肠道黏膜屏障的免疫功能,减少肠道细菌过度生长和移位,从而控制炎症反应,是改善SAP预后的关键。近年来,更有学者提出SAP治疗关键应“从肠论治”的新观点[5]。
电针足三里穴对SAP患者具有改善肠道动力障碍及减轻炎症反应的双重疗效,为临床上治疗重症急性胰腺炎使用频次最高的穴位[6]。目前已有较多研究证实电针足三里穴在改善肠道动力方面的疗效及作用机制,但在减轻炎症反应方面的作用机制尚待进一步研究。本团队前期实验研究已发现电针足三里穴可动态调整血清中促炎因子与抗炎因子含量的平衡,减轻胰腺炎症反应[7],其作用机制可能与电针足三里穴调节肠道免疫功能有关。因此本研究拟在既往研究的基础上,从SAP大鼠小肠分泌型IgA(SIgA)的表达及其影响因素入手,进一步探讨电针足三里穴对SAP大鼠肠道免疫功能的影响[1]。
1 材料与方法
1.1 实验动物 72只SD雄性大鼠,10~12周龄,体质量180~220 g,购于成都达硕实验动物有限公司,许可证号:SCXK(川)2020-030。动物饲养于四川大学华西科技园动物中心SPF级动物房中,室内温度维持在(23±2)℃,相对湿度维持在40%~60%,照明控制为12 h白天/黑夜循环,每笼5只,实验前适应性饲养1周。本实验获得四川大学华西医院动物保护伦理委员会批准(伦理号:2020002A),所有操作均按相关标准执行。
1.2 试药与仪器 牛磺胆酸钠购自美国Sigma公司,戊巴比妥钠购自美国Merk公司,0.9%氯化钠注射液购自成都青山利康药业,血清白细胞介素-4(IL-4)、白细胞介素-10(IL-10)、干扰素-γ(IFN-γ)、转化生长因子-β1(TGF-β1)ELISA试剂盒购自美国eBioscience公司,SIgA抗体购自北京博奥森生物技术有限公司,二抗及通用型S-P免疫组化试剂盒购自北京中山生物技术有限公司。Synergy Mx多功能酶标仪由香港基因有限公司研制;电针仪采用华佗电针治疗仪,SDZ-V型,由苏州医疗用品厂有限公司研制;一次性无菌针灸针(0.23 mm×13 mm)由无锡佳健医疗器械有限公司生产。
1.3 分组与造模 将大鼠随机分为假手术组、模型组、电针组,每组24只。参照Aho等[8]的造模方法并加以改进,大鼠术前12 h禁食不禁水,采用胰胆管内逆行注射3.5%牛磺胆酸钠制备SAP大鼠模型。取3%戊巴比妥钠(30 mg/kg)腹腔内注射麻醉后固定于手术台,由腹壁正中入腹切口约2 cm,提起十二指肠,在胆胰管十二指肠开口处对侧肠壁,用24号静脉留置针穿刺后针尖稍向上抬经乳头探入胆总管,拔出针芯,用外套管继续沿胆总管方向推入1~2 cm,固定以防止脱出。用微型血管钳夹住近肝端,将3.5%牛磺胆酸钠溶液按0.1 mL/100 g微量泵5 min内泵完,留置针和微血管夹保留5 min。观察到大鼠胰腺出现水肿、出血、坏死等改变,即为造模成功。假手术组手术操作相同,但不注射药物。
1.4 干预方法 各组均在造模成功后给予基础治疗:分别于第0、2、4小时用0.9%氯化钠注射液2 mL/100 g灌胃,此后每隔4小时背部皮下注射0.9%氯化钠注射液1 mL/100 g为大鼠提供补液支持)[2]。电针组:分别在造模成功后和处死前于双侧“足三里”穴(位于大鼠后肢膝关节外下方腓骨小头下约5 mm处[9])进行电针刺激。操作:将大鼠放入固定器中,取0.23 mm×13 mm毫针直刺进针7 mm左右,轻微提插捻转至有紧滞感后将针柄连接电针治疗仪(型号:SDZ-V),电针参数:疏密波2 Hz,连续刺激30 min。假手术组及模型组大鼠在相同时间点仅固定30 min,不予电针治疗。
1.5 标本采集与检测 1)各组大鼠分别于术后3、6、12 h各处死8只于心脏左心室取血处死,留取血液、胰腺及小肠组织标本,采用酶联免疫吸附法检测各组血清中IL-4、IL-10、TGF-β、IFN-γ的含量。2)制作胰腺及小肠组织的石蜡切片,切片苏木精和伊红染色后用无水乙醇进行梯度脱水,二甲苯透明,中性树胶封片,于镜下观察各组胰腺组织及小肠组织病理变化并进行评分。3)免疫组化法测定小肠组织中SIgA的表达。石蜡切片置于二甲苯后用无水乙醇至水,将切片浸泡在3% H2O2中氧化,阻断内源性过氧化物酶;PBS清洗后将浸泡于EDTA溶液中,微波炉修复8 min重复2次;PBS洗2 min重复3次;滴加一抗,4℃孵育过夜;PBS洗2 min重复3次;滴加二抗,37℃孵育1 h;PBS洗2min重复3次;加DAB显色液显色,苏木素复染细胞核1 min后流水冲洗,无水乙醇脱水;二甲苯透明后用中性树胶封片。
1.6 统计学处理 应用SPSS22.00统计软件。计量资料以()表示,方差齐者同一指标比较采用方差分析,对方差不齐者采用秩和检验,组间比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠血清IL-4、IL-10含量比较 见表1。模型组血清IL-4、IL-10含量明显高于假手术组(P<0.05);电针组各时间点血清IL-4、IL-10含量明显低于模型组(P<0.05)。
表1 各组大鼠各时间点血清IL-4、IL-10含量比较(pg/mL,±s)
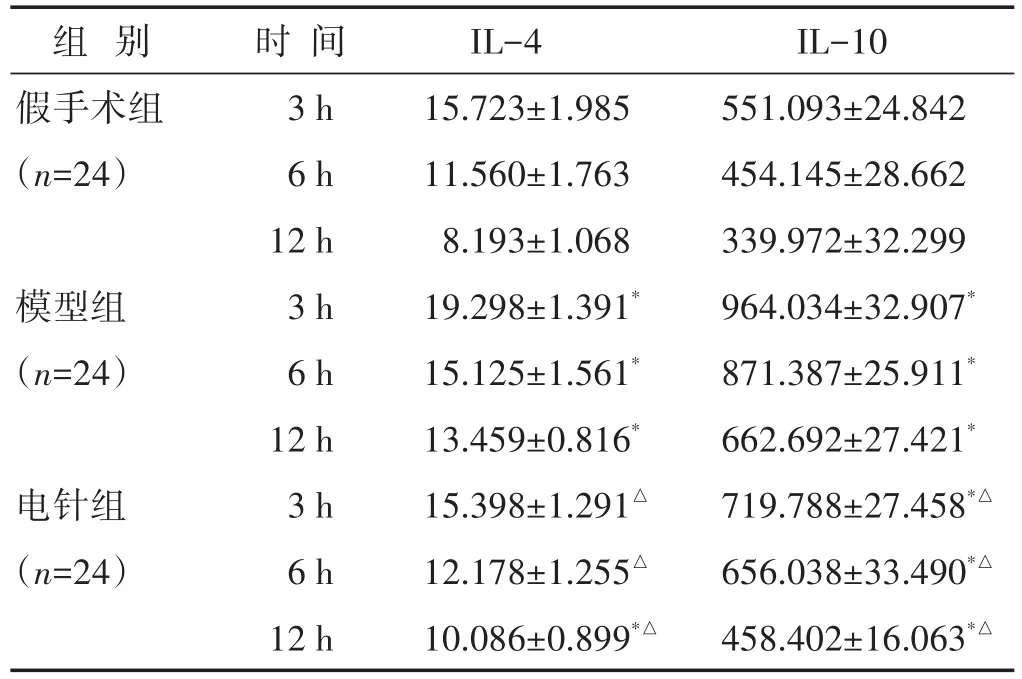
表1 各组大鼠各时间点血清IL-4、IL-10含量比较(pg/mL,±s)
注:与假手术组同期比较,*P<0.05;与模型组同期比较,△P<0.05。下同。
组别假手术组(n=24)模型组(n=24)电针组(n=24)时间3 h 6 h 12 h 3 h 6 h 12 h 3 h 6 h 12 h IL-4 15.723±1.985 11.560±1.763 8.193±1.068 19.298±1.391*15.125±1.561*13.459±0.816*15.398±1.291△12.178±1.255△10.086±0.899*△IL-10 551.093±24.842 454.145±28.662 339.972±32.299 964.034±32.907*871.387±25.911*662.692±27.421*719.788±27.458*△656.038±33.490*△458.402±16.063*△
2.2 各组大鼠血清TGF-β1、IFN-γ含量比较 见表2。模型组血清TGF-β1含量明显低于假手术组(P<0.05);电针组各时间点血清TGF-β1含量明显高于模型组(P<0.05)。模型组血清IFN-γ含量明显高于假手术组(P<0.05);电针组各时间点血清IFN-γ含量明显低于模型组(P<0.05)。
表2 各组大鼠各时间点血清TGF-β1、IFN-γ水平及小肠SIgA蛋白表达比较(pg/mL,±s)

表2 各组大鼠各时间点血清TGF-β1、IFN-γ水平及小肠SIgA蛋白表达比较(pg/mL,±s)
组别假手术组(n=24)模型组(n=24)电针组(n=24)时间3 h 6 h 12 h 3 h 6 h 12 h 3 h 6 h 12 h TGF-β1 3 240.978±29.660 3 449.565±33.414 3 593.551±24.314 2 606.231±18.541*2 747.312±28.006*2 823.101±33.581*2 696.597±37.690*△2 830.025±35.279*△3 298.280±31.254*△IFN-γ 213.105±17.322 156.787±24.943 102.613±11.902 421.900±29.077*330.056±26.889*212.865±22.473*308.593±32.902*△253.673±33.466*△113.883±33.159*△SIgA 4.250±1.669 4.875±1.246 6.250±1.282 1.625±1.061*1.875±1.356*2.375±1.061*3.125±1.458*△3.750±1.670*△4.250±1.669*△
2.3 各组大鼠胰腺病理评分的比较 见图1。假手术组胰腺腺泡细胞正常,结构完整,无出血及坏死;模型组大鼠胰腺组织水肿明显,可见多处出血及坏死灶,胰腺间质、导管及其周围可见大量中性粒细胞浸润;电针组大鼠胰腺组织水肿、出血、坏死及中性粒细胞浸润均较模型组减轻。
根据Schmidt's标准[10]对胰腺病理切片进行病理评分,各时点假手术组胰腺病理评分明显低于模型组(P<0.05)。电针组胰腺病理评分亦低于模型组,差异有统计学意义(P<0.05),见表3。
表3 各组大鼠各时间点胰腺病理评分及小肠病理评分比较(分,±s)

表3 各组大鼠各时间点胰腺病理评分及小肠病理评分比较(分,±s)
组别假手术组(n=24)模型组(n=24)电针组(n=24)时间3 h 6 h 12 h 3 h 6 h 12 h 3 h 6 h 12 h胰腺病理评分5.454±0.308 5.852±0.091 4.292±0.177 13.666±0.327*14.182±0.575*12.776±1.020*11.816±0.160*△10.480±0.392*△8.502±0.176*△小肠病理评分5.454±0.308 0.875±0.641 1.188±0.372 1.375±0.518*2.063±0.623*2.875±0.744*1.250±0.378*1.438±0.496△1.375±0.443△
2.4 各组大鼠小肠病理评分的比较 见图2。对取样的小肠组织进行包埋切片,苏木精-伊红染色后光镜观察,假手术组可见小肠黏膜上皮结构完整,小肠绒毛排列整齐,未见脱落,及炎性浸润等情况。而模型组小肠黏膜下层出现明显的炎性细胞浸润,小肠绒毛出现损伤,排列紊乱,上皮脱落,绒毛肿胀等。电针组治疗后,小肠黏膜绒毛排列较整齐,未见明显脱落、肿胀等情况。
根据Chiu's标准[11]对小肠病理切片进行病理评分,各时点假手术组小肠病理评分明显低于模型组(P<0.05)。电针组小肠病理评分在3 h时与模型组差异无统计学意义外,在其余各时间点均低于模型组,且差异具有统计学意义(P<0.05),见表3。
2.5 各组大鼠小肠SIgA蛋白表达比较 见图3。大鼠小肠SIgA蛋白在假手术组中有较强阳性表达,阳性细胞染色主要集中在细胞核,呈棕黄色或棕褐色;SIgA蛋白在模型组中仅有少量表达;电针组在同时间点的SIgA蛋白表达均较模型组增强。模型组及电针组造模后各时间点与假手术组相比,差异有统计学意义(P<0.05),电针组在各时间点与模型组相比,也均具有统计学意义(P<0.05),见表2。
3 讨 论
中医学认为急性胰腺炎多属于“脾心痛”“脾热病”“结胸病”等范畴。病位涉及脾胃、肝胆、肠腑,病势危重时累及多脏器。多种病因导致气郁、湿热、实热、血瘀之实邪结聚于脾胃肝胆,致腹痛、呕吐、腹胀、肠腑不通等症候,以“少阳阳明合病”为主要特点,治疗上普遍以通里攻下法为主,辅以疏肝理气、清热除湿、活血化瘀等治法[12]。根据“肚腹三里留”这一经典针灸选穴规律,足三里穴治疗脾胃及肠道病症最具优势,是临床治疗重症急性胰腺炎肠道功能障碍最常用的穴位。同时,足三里穴还是足阳明胃经的合穴,根据《灵枢·邪气脏腑病形》中“合治内腑”以及胃肠相连、气机相通,《灵枢·本输》中“大肠、小肠皆属于胃”的原则,凡胃肠的疾患皆可选之,故足三里穴向来被作为首选穴广泛应用于现代临床的腹部疾病中[13]。已有临床研究[14-15]表明电针足三里等穴位可有效改善急性胰腺炎患者肠黏膜的通透性,缓解患者腹痛、腹胀等症状,促进急性胰腺炎病情恢复,但具体作用机制还需进一步研究。
目前认为SAP肠黏膜损伤引起的肠黏膜屏障功能障碍、肠内细菌微生态失衡和免疫功能下降,是引发胰腺及其周围感染、全身炎性反应和多器官功能障碍综合征的重要因素[16]。当SAP发生时肠黏膜通透性明显增高,肠内细菌易位,引起内皮细胞活化,导致白细胞过度活化、促炎因子过度表达。而炎症递质和细胞因子的释放又能进一步增加肠黏膜通透性,促使肠道中的细菌和内毒素不断侵入体内形成恶性循环[17-18]。SIgA作为肠道黏膜表面的第一道免疫防线,抵抗各种内源及外源性病原体。其主要由肠黏膜中的IgA浆细胞分泌,能抑制肠道内的细菌黏附在肠黏膜表面,中和肠道内的毒素、酶和病毒。TGF-β1是重要的IgA转化生长因子,可通过刺激CD5+B细胞和IgA+细胞间接促进SIgA的产生[19];而细胞因子中的IFN-γ对SIgA的分泌有下调作用。血清中的IL-4和IL-10不仅能反映SAP的炎症程度,同时还与免疫调节有明显关系[20-21]。研究表明[22]IL-4与IL-10是一种重要的抗炎和免疫抑制细胞因子,主要由Th2淋巴细胞产生,其通过抑制活化单核细胞和T淋巴细胞,抑制巨噬细胞协同炎性因子的表达,还能抑制Th1淋巴细胞释放促炎因子,有效抑制巨噬细胞的表达。
本次研究结果显示,在电针组各时间点大鼠血清中IL-4与IL-10的浓度均明显低于模型组,表明电针组炎症程度低于模型组。IFN-γ水平的高低与人体内的免疫反应具有相关性,IFN-γ是由Th1细胞分泌的一种促炎性因子,可促进Th1与巨噬细胞发生炎性反应。本次研究结果显示模型组及电针组各时间点大鼠血清中的IFN-γ浓度均高于假手术组,说明高浓度IFN-γ与急性胰腺炎的炎症反应具有相关关系,而电针组IFN-γ浓度低于模型组,同样也表明了电针组肠道炎症程度较模型组有所改善;另一方面,IFN-γ对SIgA的分泌有下调作用,其浓度与SIgA的表达成负相关。TGF-β1可间接促进SIgA的产生,本次研究中电针组各时间点血清TGF-β1含量均高于模型组,小肠SIgA表达电针组也均高于模型组,以上数据提示电针“足三里”穴可能在一定程度上通过影响IFN-γ、TGF-β1的浓度从而使SIgA的表达增强。肠道作为机体最大的免疫器官,SIgA在肠道黏膜免疫屏障中发挥着核心作用,因此,增加SIgA的表达是改善SAP肠道免疫功能,进而减轻全身炎症反应的重要环节。
综上所述,电针“足三里”穴可以减轻SAP大鼠模型炎症反应程度,其机制可能是增高TGF-β1、降低IFN-γ浓度,上调小肠SIgA蛋白的表达水平,从而保护肠黏膜屏障,提高大鼠肠道免疫功能,减少细菌过度生长或迁移到腹膜腔中感染已发生坏死的胰腺组织,改善SAP预后。
