基于CRISPR-Cas13a技术的乙型肝炎病毒cccDNA检测方法临床应用评价*
2022-03-05田原万妍徐玲张向颖任锋吴剑
田原,万妍,徐玲,张向颖,任锋,吴剑
(1.首都医科大学附属北京佑安医院北京肝病研究所,北京100069;2.首都体育学院运动科学与健康学院,北京100191)
乙型肝炎病毒(Hepatitis B virus,HBV)感染可引发肝衰竭、肝硬化和原发性肝癌,严重威胁人类的生命健康,给社会造成巨大的经济压力[1]。HBV不能被治愈的关键因素在于共价闭合环状DNA(cccDNA),它是病毒复制转录的模板[2]。目前HBV cccDNA的检测方法主要有Southern blot、滚环扩增(rolling circle amplification, RCA)、荧光定量PCR(Real-time PCR, qPCR)和巢式PCR等,均存在灵敏度低、操作繁琐和成本较高等缺点[3-4]。因此,需要建立一种更有效的HBV cccDNA检测方法。
近年来,规律成簇的间隔短回文重复序列及其相关蛋白(clusteredregularly interspaced short palindromic repeats/CRISPR-associated proteins,CRISPR/Cas)被应用于分子诊断[5]。如Cas13a蛋白具有“附带切割”活性,不仅能在CRISPR RNA(crRNA)的引导下切割靶标核酸,还能切割附近的非靶标核酸[6]。研究人员利用此特性开发了SHERLOCK(specific high sensitivity enzymatic reporter unLOCKing)等检测方法,具有较高的灵敏度[7]。通过本课题组前期的实验研究,笔者利用RCA、PCR和CRISPR/Cas13a技术建立了具有高灵敏度检测HBV cccDNA的方法(命名为CRISPR-HBV cccDNA方法)。本研究拟利用CRISPR-HBV cccDNA、数字PCR(ddPCR)和荧光定量PCR法对HBV cccDNA质粒及临床样本进行检测及对比,进而评价CRISPR-HBV cccDNA方法的临床应用价值。
1 资料与方法
1.1研究对象 收集2017年6月至2020年10月在首都医科大学附属北京佑安医院就诊的25例HBV感染患者以及5例非HBV感染患者的肝组织样本。纳入标准:血液中检测出HBV DNA。排除标准:无HBV感染史,且血液中未检测出HBV DNA。所有患者均未经过治疗。其中HBV感染患者年龄为(45±15)岁,非HBV感染患者年龄为(39±11)岁。本研究经首都医科大学附属北京佑安医院医学伦理委员会审批[批准文号:京佑科伦字(2020)132号],患者均签署知情同意书。
1.2试剂与仪器 质粒为本实验室构建的pUC57-HBV质粒。LwCas13a蛋白(杭州众测公司),RNase抑制剂、T7 RNA聚合酶、rNTP Mix、phi29 DNA聚合酶和HindⅢ内切酶(美国NEB 公司),质粒保护性ATP依赖的DNA酶Plasmid-safe ATP-dependent DNase(美国Lucigen公司),DNA产物纯化试剂盒、质粒提取试剂盒和DNA提取试剂盒(北京天根生化科技公司),TaqMan Fast Advanced Master Mix(美国Applied Biosystems公司)。 ViiATM7 Real-Time PCR System荧光定量PCR(美国Applied Biosystems公司),新羿TD-1微滴式数字PCR仪(北京新羿公司),NanoDropTMOne/OneC微量 UV-Vis分光光度计(美国赛默飞公司)。
1.3引物和探针设计 根据HBV cccDNA与HBV松弛环状DNA(relaxed circular DNA,rcDNA)基因结构上的差异,在跨越HBV DNA负链缺口处的相对保守位置设计引物和探针(表1),其GenBank序列号为:OM688318.1。RCA引物R1~R8均来自相关文献[8]。所有引物和探针序列均由生工生物工程(上海)股份有限公司合成。

表1 引物及探针序列
1.4HBV cccDNA阳性质粒的构建 利用HBV cccDNA引物对pUC57-HBV质粒进行扩增,然后对扩增产物进行琼脂糖凝胶电泳检测,使用DNA产物纯化试剂盒对目的片段的凝胶进行回收,利用回收的目的片段与T载体连接,转入JM109大肠埃希菌中,再将大肠埃希菌置于LB培养基中,在37 ℃孵箱中过夜并进行扩增,最后利用质粒提取试剂盒进行质粒提取。
1.5肝组织HBV cccDNA的制备 先按照DNA提取试剂盒说明书从肝组织中提取总DNA,然后用HindⅢ内切酶对总DNA进行酶切。HindⅢ酶切体系总体积为50 μL,包括:HindⅢ内切酶1 μL,10× NEB Buffer 5 μL,总DNA 10 μL,DEPC水34 μL。反应条件:37 ℃水浴60 min。用PSAD酶进行消化。PSAD酶切体系总体积为11.7 μL,包括:25 mmol/L ATP 0.8 μL,PSAD(10 U/L)0.4 μL,10× Buffer 2 μL,肝组织DNA产物 8.5 μL。反应条件:37 ℃水浴12 h过夜,70 ℃水浴30 min。收集并得到HBV cccDNA产物。
1.6RCA扩增 第一步扩增体系总体积为10 μL,包括:10× Phi29 DNA聚合酶 Buffer 1 μL,引物(R1~R8)4 μL(每个引物0.5 μL),HBV cccDNA<5 μL(适量),DEPC水补足至10 μL。PCR反应条件:95 ℃ 3 min;50 ℃ 15 s;30 ℃ 15 s;20 ℃ 10 min。第二步扩增体系总体积为20 μL,包括:上一步扩增产物10 μL,Phi29 DNA聚合酶1 μL,10× Phi29 DNA聚合酶 Buffer 1 μL,引物(R1~R8)4 μL(每个引物0.5 μL),Phi29 BSA 1 μL,4× dNTP mix 3 μL。反应条件:30 ℃水浴16 h过夜, 65 ℃水浴10 min。
1.7逆转录反应及荧光定量PCR检测 逆转录反应体系总体积为20 μL,包括:TaqMan Fast Advanced Master Mix 10 μL,上游引物0.5 μL,下游引物0.5 μL,探针0.5 μL,模板2 μL,ddH2O 6.5 μL。反应条件:50 ℃ 30 min;94 ℃ 3 min;94 ℃ 30 s,58 ℃ 45 s,共40个循环。根据Ct值判断结果:Ct值≤35为阳性,35
1.8数字PCR检测 根据新羿TD-1微滴式数字PCR仪操作,配置反应体系,总体积为30 μL,包括:2×SuperMix 15 μL,上游引物(10 μmol/L)0.6 μL,下游引物(10 μmol/L)0.6 μL,探针(10 μmol/L)0.6 μL,模板3 μL,ddH2O 10.2 μL。反应条件:95℃ 10 min;94 ℃ 30 s,60 ℃ 1 min,40个循环;12 ℃ 5 min。根据拷贝数判断结果:拷贝数≥1为阳性,拷贝数<1为阴性。
1.9CRISPR-Cas13a检测 配置检测体系,总体积为25 μL,包括:NTP Mix(2.5 mmol/L)2 μL,RNA酶抑制剂1 μL,LwCas13a蛋白(25 nmol/L)1 μL,T7 RNA聚合酶0.5 μL,MgCl2溶液(10 mmol/L)0.25 μL,HEPES缓冲液(20 mmol/L)0.5 μL,crRNA(2 μmol/L)1.5 μL,荧光报告RNA(2 nmol/L)2.5 μL,无菌/无酶ddH2O 10.75 μL,扩增产物5 μL。其中,crRNA靶位点序列为:GGGGAUUUAGACUACCCCAAAAACGAAGGGGACUAAAACAACUUUUUCACCUCUGCCUAAUCAUCUC。检测条件:37 ℃ 60 min。检测并判读60 min时的荧光值。
1.10灵敏度比对试验 利用微量 UV-Vis 分光光度计对构建的HBV cccDNA阳性质粒以及1例HBV阳性临床肝组织样本制备的HBV cccDNA进行浓度测量,根据拷贝数计算公式得到拷贝数,然后按照浓度梯度稀释为104、103、102、101、100copies/μL。再利用数字PCR、荧光定量PCR和CRISPR-HBV cccDNA方法进行灵敏度检测比对及结果判读,试验重复3次。
1.11临床样本检出率的对比试验 提取25例HBV感染患者和5例非HBV感染患者肝组织样本的总DNA,按照HBV cccDNA的制备方法进行检测。再利用数字PCR、荧光定量PCR和CRISPR-HBV cccDNA方法进行检出率的比对及结果判读。试验重复3次。
1.12统计学分析 应用SPSS 25.0软件进行统计学分析。HBV cccDNA阳性质粒和阳性样本的灵敏度比对数据使用t检验,计数资料以例数(n)或百分率(%)表示,不同方法阳性率比较采用配对χ2检验。以P<0.05为差异具有统计学意义。
2 结果
2.1CRISPR-HBV cccDNA检测方法的构建流程 如图1所示,从样本中提取总DNA后,经过HindⅢ内切酶和PSAD酶消化,先利用RCA引物进行扩增,然后通过带有T7启动子的PCR引物进行转录扩增,使双链DNA转录为单链RNA,再使用CRISPR-Cas13a体系对其进行检测,当特异性的crRNA识别到HBV cccDNA靶序列时,便会激发Cas13a蛋白活性,剪切荧光报告探针,从而发出荧光信号。
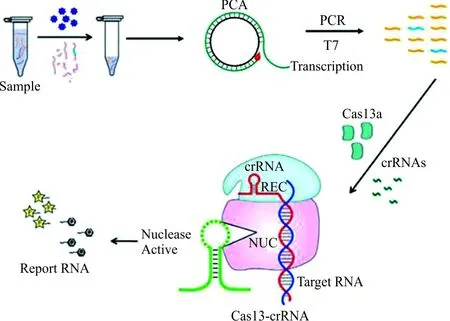
图1 CRISPR-HBV cccDNA检测方法示意图
2.2HBV cccDNA阳性质粒灵敏度对比试验 本研究建立的CRISPR-HBV cccDNA方法检测100copies/μL的荧光值(242 402.67±46 084.99)与阴性对照(NC)的荧光值(71 738.63±11 030.72)差异有统计学意义(t=5.093,P<0.01),确定最低检测限为1 copies/μL。荧光定量PCR检测101copies/μL的Ct值(38.4±0.4)与NC(41.1±0.5),差异有统计学意义(t=5.051,P<0.01),确定最低检测限为101copies/μL。数字PCR检测101copies/μL的拷贝数(15.28+3.85)与NC(2.30±1.24)差异有统计学意义(t=3.170,P<0.01),确定最低检测限为101copies/μL。结果见表2。

表2 3种方法检测HBV cccDNA阳性质粒的结果
2.3阳性样本灵敏度对比试验 本研究建立的CRISPR-HBV cccDNA方法检测100copies/μL的荧光值(39 033.70±446.53)与NC(3 600.32±161.34)的差异有统计学意义(t=105.5,P<0.0001),确定最低检测限为1 copies/μL。qPCR检测101copies/μL的Ct值(34.78±0.65)与NC(40.35±0.59)差异有统计学意义(t=8.853,P<0.001),确定最低检测限为10 copies/μL。ddPCR检测100copies/μL的拷贝数(6.50±0.81)与NC(3.70±0.72)差异有统计学意义(t=3.674,P<0.05),确定最低检测限为1 copies/μL。结果见表3。

表3 3种方法检测HBV cccDNA阳性样本灵敏度的对比
2.4阳性样本特异性验证 标记了地高辛的HBV cccDNA探针和HBV rcDNA探针以及其对应的地高辛标记的对照组DNA均可以被检出,见图2A和B。当检测3个HBV cccDNA阳性细胞样本时,HBV cccDNA被检出,而HBV rcDNA未被检出,见图2C。
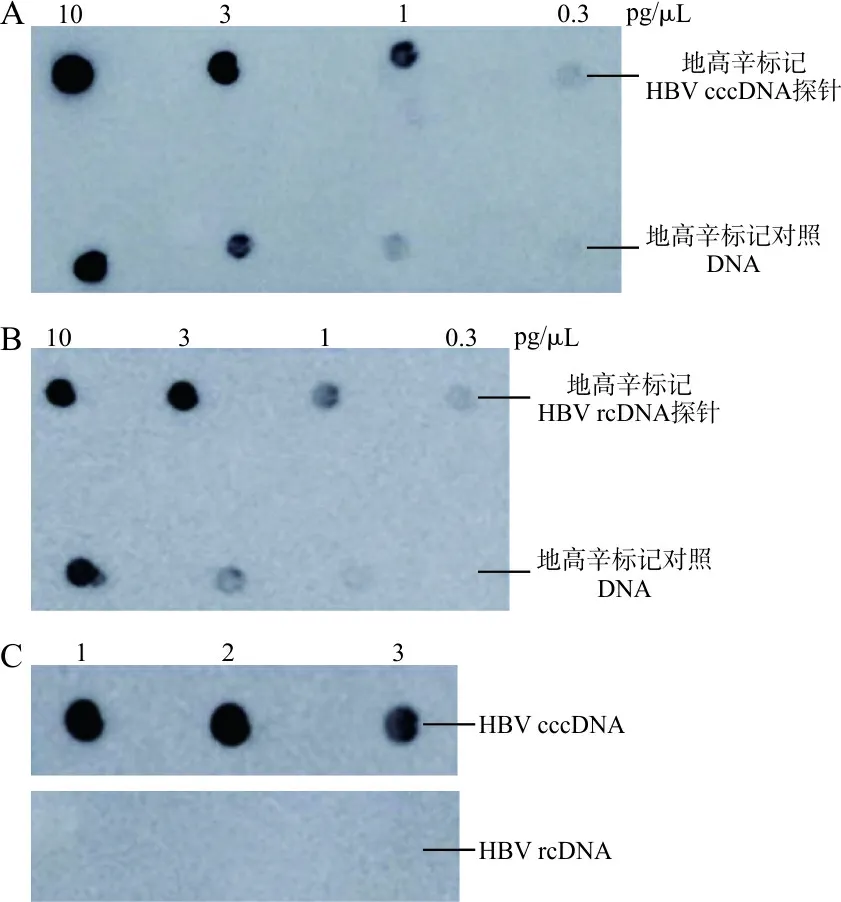
图2 Southern blot检测阳性样本的特异性
2.5临床样本检出率对比试验 25例HBV感染患者中,ddPCR法检测出16例,阳性率为64%(16/25),qPCR方法检测出12例,阳性率为48%(12/25),CRISPR-HBV cccDNA方法检测出20例,阳性率为80%(20/25)。ddPCR法与CRISPR-HBV cccDNA方法的阳性率差异有统计学意义(P=0.012 7)。5例非HBV感染患者中,ddPCR、qPCR和CRISPR-HBV cccDNA方法均未检出。见表4。
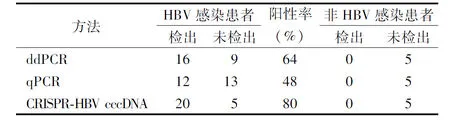
表4 3种方法检测临床样本的结果比较
3 讨论
在前期的研究中,笔者利用HindⅢ内切酶和PSAD酶分别对肝脏提取的DNA进行消化,然后依据rcDNA和cccDNA的结构差异,设计特异性扩增HBV cccDNA的引物,对酶切后的产物进行滚环扩增(RCA)和PCR扩增,并通过筛选靶向HBV cccDNA基因的crRNA序列,建立了基于CRISPR-Cas13a技术的HBV cccDNA检测新方法(命名为CRISPR-HBV cccDNA方法)。
Zhong等[9]利用RCA方法与qPCR方法相结合,显著提高了HBV cccDNA检测的灵敏度。另有学者利用CRISPR-Cas13a技术对新冠病毒、埃博拉病毒和流感病毒等进行了高灵敏度和高特异性地检测[10-11]。 本研究利用RCA方法和qPCR方法与CRISPR-Cas13a技术相结合,建立的CRISPR-HBV cccDNA检测方法对HBV cccDNA阳性质粒的检测灵敏度为1 copies/μL,显著高于ddPCR(101copies/μL)和qPCR(101copies/μL)方法;对阳性样本检测的检测灵敏度也为1 copies/μL,与ddPCR方法相同,亦高于qPCR(101copies/μL)方法。此外,本研究对于25例HBV感染的临床肝组织样本的检测结果表明,建立的CRISPR-HBV cccDNA方法检出阳性率为80%,均明显高于ddPCR(64%)和qPCR(48%)方法。
综上所述,本研究建立的CRISPR-HBV cccDNA方法,能对HBV感染患者肝组织的HBV cccDNA进行高灵敏度的检测,为评价HBV治疗效果,更好地指导临床用药提供了新的方法。
致谢:田原、万妍负责收集资料,开展实验;徐玲、张向颖负责分析数据,撰写文章;任锋、吴剑负责提供写作思路、指导并最终定稿。
