二至丸改善D-gal 致衰老小鼠学习记忆障碍的海马代谢组学研究
2022-03-05徐艳明孙慧峰
杨 娜,薛 傲,徐艳明,王 岩,薛 慧,杨 波,孙慧峰*,张 宁,*
(1.黑龙江中医药大学 药学院,黑龙江 哈尔滨 150040;2.黑龙江中医药大学 佳木斯学院,黑龙江 佳木斯 154007)
二至丸出自《扶寿精方》,由女贞子和墨旱莲两味药组成,有补益肝肾、滋阴止血之功,是滋阴补肾的经典方剂。二至丸中含有萜类、香豆草醚类、黄酮类、苯乙醇醚类等化学成分[1],其中,红景天苷具有很强的清除自由基能力和抗氧化效应,可延缓D-gal 诱导的衰老。课题组早期已在整体疗效水平证明二至丸对D-gal 致衰老小鼠的神经保护作用。
代谢组学可用于监测生物体内内源性小分子代谢物的动态变化,丰富的代谢物信息可为了解药物治疗疾病过程中发生的代谢变化提供线索[2]。代谢组学界普遍认为GC-MS 是代谢组学研究中最高效、可重复和使用良好的分析平台之一,因其特有的相对标准的代谢物数据库,能获得更大的色谱分辨率[3-4],可用于识别低分子量化合物糖、脂肪酸、氨基酸、长链醇、胺、有机酸和甾醇等初级代谢物。大脑海马是中枢神经系统中参与学习记忆贮存以及空间定位的关键脑区,阿尔兹海默病(Alzheimer’s disease,AD)在其病因、病理生理过程以及治疗方面与海马结构有着密切的联系[5-6]。在AD 的病程早期,海马最先受到损害,其代谢物与生物液体样本相比可以提供更强的生物标记物[7]。已有研究表明二至丸对AD治疗有较好作用[8],但目前对二至丸改善D-gal 小鼠学习记忆障碍的代谢组学的研究较少。为更加全面系统的阐明二至丸抗AD 的作用,本实验对二至丸干预AD 模型小鼠的海马组织代谢组学进行研究,利用GC-MS 寻找各组小鼠共同调节的内源性差异代谢产物,以探讨二至丸干预AD 的代谢通路和作用机制。
1 材料
1.1 实验动物
雄性KM 小鼠24 只,3 月龄,清洁级,体质量为(20±5)g,购自辽宁省长生生物技术股份有限公司[合格证号:SCXK(辽)2015-0001]。
1.2 试剂与药物
墨旱莲、女贞子(酒)药材购自北京同仁堂哈尔滨店,经黑龙江中医药大学张宁教授鉴定,符合2020 年版《中国药典》要求。色谱级甲醇购自美国Dikama 公司,MSTFA(含1%TMCs)、甲氧胺盐酸盐、吡啶、正庚烷、D-gal 均购自上海麦克林生化科技有限公司。
1.3 仪器
6890N-5975B 型气质联用仪(美国安捷伦科技公司)配备DB-5MS 弹性石英毛细管柱(30 m×0.25 mm,0.25μm);Bionoon-VAC1 型真空浓缩仪(上海般诺生物科技有限公司);ZH-Morris 型水迷宫设备(正华生物仪器设备有限公司)。
2 方法
2.1 二至丸药液的制备
将女贞子(酒)、墨旱莲按1 ∶1 处方比例混合,加入十倍量的水,煎煮2 h,收集滤液,残渣加等量水继续煎煮1 h,过滤后合并滤液,浓缩成1 g/mL(以生药量计)的药液,备用。
2.2 D-gal 诱导衰老复制AD 模型
将小鼠按体质量随机分为3 组。空白组、模型组灌胃给予双蒸水;二至丸组灌胃给予二至丸药液[2.43 g/(kg·d),参照2020 年版《中国药典》给药剂量以生药量换算],相当于临床用量的9.1 倍。空白组皮下注射生理盐水,其余各组皮下注射D-gal 125 mg/(kg·d),均边给药边造模,连续8 周。
2.3 行为学实验
在第8 周,采用Morris 水迷宫(MWM)试验,研究不同组小鼠的空间学习和记忆能力。将浸没在水面下2 cm 处的平台放置在第四象限,与池壁保持20 cm 距离。在定向导航实验中,将小鼠于其它象限面向池壁放入水中,连续4 d 寻找平台,90 s 内找到平台并停留30 s,未找到平台的小鼠人为引导,使其停留30 s,记录逃避潜伏期,即小鼠找平台的时间。第5 天进行空间探索测试。撤去第四象限平台,于其它象限入水点将小鼠放入水中,90 s 内记录其第四象限的停留时间。记录平台位置、有效区域(2 倍平台直径区域)穿过的次数。
2.4 样本收集
在行为学测试结束24 h 及眼眶取血后,每组取6只小鼠在冰盘上快速断头剥离大脑,取海马组织,然后称重,再迅速放入液氮罐中,-80℃冰箱保存至分析;另外2 只小鼠,4%多聚甲醛进行心脏灌流,在冰盘上迅速取脑,4%多聚甲醛固定48 h,用于HE染色。
2.5 HE 染色
行为学结束后,取脑组织进行石蜡包埋切片。脱水透明,经缓水流冲洗一晚,不同浓度的乙醇、正丁醇各1 h;二甲苯I、二甲苯Ⅱ各30 min。浸蜡,过夜。包埋后切片;脱蜡,二甲苯Ⅰ、二甲苯Ⅱ。脱水后染色;苏木素染色 5 ~ 7 min;水洗,氨水,水洗;盐酸乙醇,水洗;伊红染色,水洗。脱水后晾干,中性树胶封片,置于光镜下观察。
2.6 样品的处理及衍生化
-80 ℃取出海马组织加入预冷的1 mL甲醇和50μL正庚烷,匀浆,匀浆液在4°C 下14 000 rpm 离心10 min,取上清,在低温的条件下用真空浓缩仪中干燥。随后,向试管中加入80 μL 甲氧胺盐酸盐(15 mg/mL,吡啶溶液配制),在70°C 水浴中孵育1.5 h,再加入100 μL MSTFA + 1% TMCs,在70°C 下孵育1 h,形成衍生化溶液。将溶液涡旋,在4°C 下以14 000 rpm离心2 min,0.22 μm 滤膜过滤,进行GC-MS 分析。质控样本由每个海马样本待测液中取5 μL混合而成。
2.7 GC-MS 分析
为了确定二至丸对海马组织代谢谱的影响,采用基于 GC-MS 的非靶向代谢组学方法对小鼠海马组织差异代谢产物进行分析。GC-MS 采用配备5975B 质谱仪的6890N 气相系统,DB-5MS 弹性石英毛细管柱分离样品。进样口温度280℃,1μL 样本以分流方式(50 ∶1)进样,载气为氦气,流量为1 mL/min。程序升温:以60 ℃运行4 min,8 ℃/min 升至300 ℃,最后在300 ℃保持5 min。四级杆温度为150 ℃,离子源温度为230 ℃。正离子模式,全波长扫描,扫描范围为50 ~ 800 m/z,溶剂延迟设定4 min。
2.8 数据处理与统计分析
将GC-MS 采集到的图谱信息比对到 MSDAL4.80软 件 与MoNA 数 据 库(https://massbank.us/)中 的GC-MS 谱图数据库。得到的化合物数据在SIMCA 14.1 软件中进行多变量统计分析,采用无监督方法进行PCA,以获得代谢数据、一般聚类、趋势或异常值的概述;OPLS-DA 用于统计分析,以确定可比组之间的整体代谢变化。模型有效性通过模型参数R2和Q2进行评估,这两个参数分别为模型的可解释性和可预测性提供了信息,避免了过度拟合的风险。用GraphPad Prism 8.0 软件分析数据和绘制图形,两组间比较采用t检验,多组间比较采用方差分析。以P<0.05 为差异具有统计学意义。
3 结果
3.1 行为学实验
Morris 水迷宫结果显示,随着追踪时间的增加,所有小鼠的逃避潜伏期均逐渐缩短,但模型组大鼠所需的时间仍明显多于其它组小鼠(P<0.01)。与模型组比较,二至丸组的逃避潜伏期明显降低(P<0.01),平台穿越次数及靶象限停留时间明显升高(P<0.01),更接近于空白组,说明二至丸可以在一定程度上预防AD 小鼠学习和记忆缺陷,见表1、表2。
表1 二至丸对 AD 小鼠Morris 水迷宫定位航行潜伏期的影响(s,±s,n = 8)Tab. 1 Effect of Erzhi pill on the navigation latency of AD mice in Morris water maze(s,±s,n = 8)
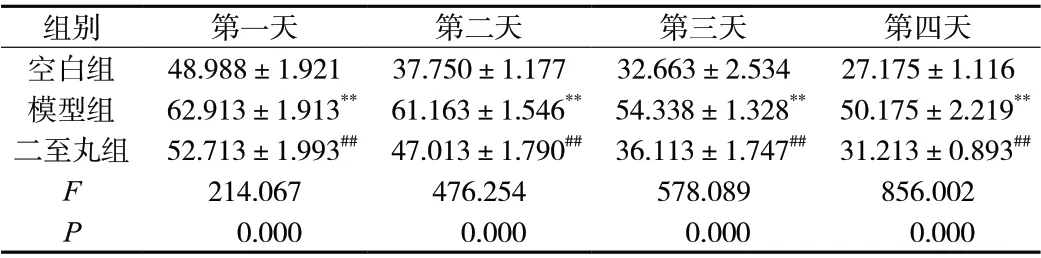
表1 二至丸对 AD 小鼠Morris 水迷宫定位航行潜伏期的影响(s,±s,n = 8)Tab. 1 Effect of Erzhi pill on the navigation latency of AD mice in Morris water maze(s,±s,n = 8)
注:与空白组相比,**P <0.01;与模型组相比,##P <0.01。
组别 第一天 第二天 第三天 第四天空白组 48.988±1.921 37.750±1.177 32.663±2.534 27.175±1.116模型组 62.913±1.913** 61.163±1.546** 54.338±1.328** 50.175±2.219**二至丸组 52.713±1.993## 47.013±1.790## 36.113±1.747## 31.213±0.893##F 214.067 476.254 578.089 856.002 P 0.000 0.000 0.000 0.000
表2 二至丸对 AD 小鼠空间探索的影响(±s,n = 8)Tab. 2 Effect of Erzhi pill on spatial exploration of AD mice(±s,n = 8)

表2 二至丸对 AD 小鼠空间探索的影响(±s,n = 8)Tab. 2 Effect of Erzhi pill on spatial exploration of AD mice(±s,n = 8)
注:与空白组相比,**P <0.01;与模型组相比,##P <0.01。
组别 穿越平台次数/次 靶象限停留时间/s空白组 3.125±0.696 36.225±1.471模型组 0.875±0.411** 15.513±1.173**二至丸组 2.375±0.554## 27.763±1.869##F 18.978 544.465 P 0.000 0.000
3.2 小鼠海马病理学观察
空白组海马区神经元排列规整,数量较多,细胞体饱满,核仁清晰。模型组海马区神经元紊乱,形状不规则,神经细胞数量明显减少,核膜边界模糊,核固缩现象明显。与模型组相比,二至丸干预后海马区神经元更多,排列较为规整,细胞核较清晰,没有明显核固缩现象,说明二至丸减缓了建模引起的海马区神经元细胞萎缩,见图1。

图1 二至丸对AD 模型小鼠海马组织病理改变影响(HE,×100)Fig. 1 Effect of Erzhi pill on pathological changes of hippocampus in AD model mice(HE,×100)
3.3 代谢轮廓分析
从宏观PCA 的角度来看,可以看出空白组和模型组之间存在明显的差异代谢变化。经二至丸干预后,发现二至丸组小鼠代谢谱有明显的回调趋势,证明二至丸对D-gal 模型小鼠有一定的神经保护作用。质控样本数据各点集中,表明使用时仪器稳定,实验结果准确可靠,见图2。
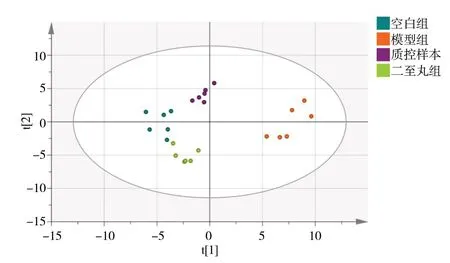
图2 各组小鼠海马组织代谢主成分分析图Fig. 2 PCA of brain metabolism in mice
通过对空白组与模型组、模型组与二至丸组的海马组织数据分别进行OPLS-DA 分析,发现两组的样品数据点较显著地分开(图3A、C),之后进行了置换检验(图3B、D)。空白组与模型组主要模型评价参数为R2Y= 0.972、Q2= 0.938,模型组与二至丸组主要模型评价参数为R2Y= 0.974、Q2= 0.945,表明模型稳定可靠,具有较好的预测能力,反映造模成功。
3.4 差异性代谢物的筛选
通过OPLS-DA 建立的模型查找差异代谢物,设置变量权重值VIP >1 作为选择的参考指标;为了得到有显著性变化的差异代谢产物,结合t检验分析方法,筛选出二至丸干预后的有显著调节趋势的差异的代谢物。得到了7 种潜在的生物标志物(表3、图4),二至丸给药后下调L-半胱氨酸亚磺酸和N-乙酰丝氨酸的表达;上调D-谷氨酰胺、N-乙酰氨基葡萄糖、L-酪氨酸、甘油-3-磷酸、DL-丝氨酸的表达。这些差异代谢性物主要涉及通路牛磺酸和亚牛磺酸代谢、D-谷氨酰胺和D-谷氨酸代谢以及苯丙氨酸、酪氨酸和色氨酸生物合成,相互关联图见图5。

图5 二至丸治疗AD 模型小鼠的差异代谢物关联图Fig. 5 Association map of differential metabolites in AD model mice treated with Erzhi pill
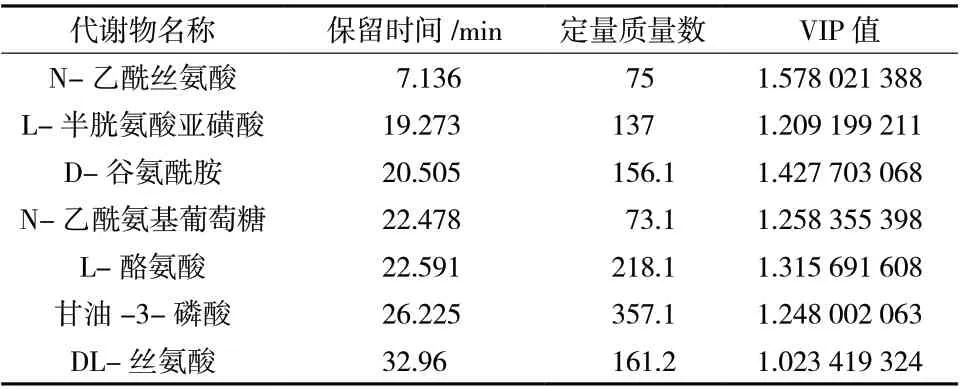
表3 基于GC-MS 确定的共同代谢差异物及变化趋势Tab. 3 Common metabolic differences and trends based on GC-MS
4 讨论
本研究选用小鼠D-gal 诱导衰老建立AD 模型,该模型既能表现出接近自然老化的生理特点,又能够显示大脑氧化应激和认知功能障碍,并伴有一些年龄神经变性的特征,多角度模拟AD 的情况[9-10]。之后,采用GC-MS 结合多变量统计分析对二至丸干预D-gal致衰老小鼠的海马代谢组学进行研究,获得潜在的生物标记物,分析二至丸治疗AD 可能的作用机制。
代谢物发生变化的表现之一是氨基酸水平的变化。氨基酸代谢紊乱,可影响脑能量供应,进一步影响学习和记忆。糖酵解和TCA 循环是能量代谢的主要途径。丝氨酸是一种非必需氨基酸。酪氨酸作为TCA 循环中的反应底物,参与能量供应。此外,二至丸给药后,丝氨酸、络氨酸和谷氨酰胺含量回调至正常水平,说明二至丸改善学习记忆的作用部分是通过影响氨基酸代谢,进而调节神经系统能量代谢紊乱来发挥的。
甘油-3-磷酸是参与糖酵解途径的重要代谢产物,可以转化为葡萄糖,影响信号转导和大脑发育[11]。除底物葡萄糖以外的糖及其衍生物水平的变化,如葡萄糖的衍生物N-乙酰氨基葡萄糖,可能也与能量缺陷的代偿机制相关[12]。本实验中给予二至丸治疗后,能上调甘油-3-磷酸和GlcNAc 的水平以补偿机体利用底物葡萄糖的作用,提示二至丸能通过影响糖代谢进而调节能量代谢发挥抗AD 的作用。研究发现,二至丸中的有效成分红景天苷可能通过激活mTOR 通路,从而提高ATP 含量,改善细胞能量代谢障碍[13]。但mTOR 在体内具有复杂的多通路调控网络,其具体作用机制仍需进一步阐明,本研究中糖代谢和氨基酸水平的变化可为红景天苷调节能量代谢的深入机制研究提供方向。
谷氨酰胺和丝氨酸参与谷胱甘肽的合成过程,谷胱甘肽作为内源性抗氧化剂和自由基清除剂,对维持氧化防御系统的平衡有重要作用。海马中谷氨酰胺水平的下降可能会导致谷胱甘肽合成受阻,加剧氧化应激对脑部的损伤。而牛磺酸生物合成途径中L-半胱氨酸亚磺酸可转化为牛磺酸,维持细胞内抗氧化基团,调节氧化应激,改善大鼠的认知功能障碍[14]。本实验给予二至丸后,谷氨酰胺和L-CSA 含量回调至正常水平,说明二至丸的神经保护作用部分是通过抗氧化应激来实现的。二至丸中的橄榄苦苷具有极强的抗氧化能力,可提高谷胱甘肽,增加超氧化物歧化酶的水平[15-16],但目前橄榄苦苷对AD 小鼠抗氧化的作用机制报道较少,本研究中的谷氨酰胺和L-CSA水平的变化可以为其深入机制研究提供新方向。此外,L-CSA 可以激活位于大脑突触的代谢型谷氨酸受体(mGluR)[17],诱导神经元内产生 Aβ 片段以及海马CA1 区锥体神经元的退化,但过度激活会发生突触障碍。丝氨酸可诱导长期突触增强预防AD 小鼠的突触和行为缺陷[18-19]。突触可塑性的功能障碍出现在Aβ 斑块形成之前,并对AD 发病机制有显著影响,提示二至丸可能通过改善海马区神经元状态和突触障碍来提高学习记忆能力。
5 结论
本研究发现二至丸对AD 小鼠的学习记忆障碍有显著的改善,其机制可能是通过抗氧化应激、改善大脑能量代谢障碍、调节神经突触可塑性等多方面实现神经保护作用。本实验结果为二至丸治疗AD 的生物标志物研究打下基础,然而,所有的代谢物仅通过GC-MS 技术检测具有局限性,后期要结合多种技术完善二至丸治疗AD 生物标志物方面的研究,为二至丸治疗AD 神经生物学机制的深入研究奠定基础。
