基于SSR标记技术对3种国产绵羊肉的品种鉴别分析
2022-03-05宋亚倩罗瑞明马小梅
宋亚倩,杨 波,罗瑞明,马小梅
(宁夏大学食品与葡萄酒学院,宁夏 银川 750021)
绵羊品种的遗传资源是人类生存的宝贵基因库之一,也是绵羊繁殖不可或缺的重要遗传物质[1]。中国有42种以上的地方绵羊品种,地方绵羊品种是长期进化和劳动人民精心选育的结果,具有适应性好、抗逆性强、多态性丰富等特点,它们是中国现在和未来不可缺少的宝贵遗传资源[2]。藏绵羊性喜冷凉干旱,耐高寒、耐干旱性能好[3],饲养经济效益高,因此饲养数量大、分布广,以藏西北、藏东南干旱、半干旱地区为集中,是具有青藏高原特色的品种资源[4]。新疆细毛羊是伊犁草原上的明珠,是新中国成立后命名的第1个细毛羊新品种[5]。它的育成,不仅填补了我国养羊业的一个空白,而且对推进细毛羊的品种改良具有重要影响。宁夏滩羊是中国宁夏优势特色畜种[6],滩羊肉质细嫩多汁,不膻不腥,是公认的优质羊肉,滩羊在宁夏养殖比例较高,经济效益显著,素有“宁夏五宝之一”的美称[7]。
简单重复序列(simple sequence repeats,SSR)又称微卫星DNA、短串联重复序列,由1~6个碱基串联重复序列形成,是一种基于DNA长度多态性的分子标记技术[8-9]。SSR位点广泛分布于所有原核生物和真核生物基因组中,具有分布丰富性、遗传共显性和技术简单性等特点[10]。基于DNA序列侧翼序列设计引物,可以对SSR位点进行聚合酶链式反应(polymerase chain reaction,PCR)扩增鉴定,形成富有极高进化信息的分子标记。微卫星DNA以多拷贝方式广泛分布在各类真核生物的基因组中,通过对SSR位点进行开发并设计特异性引物,分析目的片段多态性,能够建立绵羊品种特异性检测方法[11]。赵杰[12]根据性状相关基因挑选了等位基因频率在普通肉牛群体中为0.546~0.833、在牦牛群体中为0.009~0.075的10个SSR位点,样本经PCR扩增,毛细管电泳分离后,根据出峰数目进行肉源判定。岳远瑞等[13]分析新疆北疆地区主要绵羊品种的遗传多样性和系统发生关系,利用SSR Hunter软件寻找5个微卫星标记,采用PCR扩增、1%琼脂糖凝胶电泳,对新疆7个品种绵羊群体遗传多样性进行检测分析,结果显示,新疆7个绵羊群体共发现28个等位基因,实验证明在5个微卫星位点的平均多态信息含量为0.556 9~0.733 5,均属于高度多态性位点。隋宥珍等[14]分析柔鱼、阿根廷滑柔鱼、茎柔鱼3种柔鱼类多态性微卫星标记在种间的通用性,结果表明,茎柔鱼类多态性SSR标记在柔鱼中具有较高的通用性。Yin等[15]根据线粒体12S rRNA基因序列,提出了一种基于多重PCR的方法,利用设计的3个引物对牦牛肉和牛肉进行快速鉴定,通过3个引物与单一反应集的组合使用,从牛肉DNA中扩增出290 bp和159 bp的2个片段,用该方法为牦牛肉及肉制品的质量控制提供了有效手段。
本研究提取纯种宁夏滩羊、藏绵羊与新疆细毛羊的肝脏DNA并进行文库构建,根据文库测序结果,从3种绵羊肉基因组SSR标记入手,确定不同的候选特异DNA序列,据此设计SSR引物,采用PCR技术,用特异性SSR引物对宁夏滩羊肉、藏绵羊肉和新疆细毛羊肉进行物种鉴别。从基因水平研究宁夏滩羊、藏绵羊与新疆细毛羊之间科学准确的鉴定方法是西部地区绵羊肉产业发展亟需解决的技术问题。这不仅能保护消费者权益,而且对于绵羊肉产业的稳定、健康发展以及科学开发利用均具有重要的指导意义。
1 材料与方法
1.1 材料与试剂
实验所用纯种宁夏滩羊的肝脏来自大夏牧场(宁夏盐池县),纯种藏绵羊和纯种新疆细毛羊的肝脏来自天祝藏族自治县鑫荣盛生态养殖有限公司(甘肃省武威市)。
TaqPlus DNA聚合酶、10×PCR Buffer(含Mg2+)、dNTP(10 mmol/L)、引物、Rapid Animal Genomic DNA Isolation Kit、QubitTMdsDNA HS Assay Kit、NEB Next®UltraTMDNA Library Prep Kit for Illumina®试剂盒 生工生物工程(上海)有限公司;6×DNA Loading Dye、DNA Ladder Mix(100~3 000 bp)、POP-7TMPolymer、Applied BiosystemsTMHiDiFormamide 美国Thermo Fisher公司。
1.2 仪器与设备
PCR仪、测序仪 美国ABI公司;凝胶成像仪 上海复日科技有限公司;台式高速离心机 湖南湘仪实验仪器开发有限公司;微型旋涡混合仪 上海沪西分析仪器厂有限公司;BP系列精密单道可调移液器 加拿大BBI公司;紫外-可见分光光度计 美林恒通(北京)仪器有限公司;Qubit 4.0荧光定量仪 美国Thermo公司。
1.3 方法
1.3.1 样品制备
宁夏滩羊、藏绵羊和新疆细毛羊各20 只,分别多点取其肝脏不同部分,每只绵羊肝脏样本25 g,采样完成后将每只绵羊肝脏分装,共计60个样本。采样过程中注意避免外源性污染。
1.3.2 DNA提取
参照DNA提取试剂盒说明书提取3个品种绵羊的肝脏DNA[16],通过1%琼脂糖凝胶(电压200 V、电泳时间30 min)检测DNA完整性,DNA提取后保存于-20 ℃备用。
1.3.3 基因组文库构建、扩增、纯化和质控
利用dsDNA HS Assay Kit对基因组浓度精确定量确定文库构建所加入的DNA总量[17]。以NEB Next®UltraTMDNA Library Prep Kit for Illumina®试剂盒进行文库构建。于无菌PCR管中(200 μL)配制反应体系,对纯化后的接头连接产物进行PCR扩增富集。通过2%琼脂糖凝胶电泳检测文库大小,使用荧光定量仪进行文库浓度测定,得到均匀的长簇效果和高质量的测序数据。
1.3.4 SSR位点开发
在获取拼接基因组序列后,使用MISA软件对序列中的SSR位点进行检测,SSR最小间距为200 bp,SSR选取标准分别为单核苷酸、二核苷酸、三核苷酸、四核苷酸、五核苷酸、六核苷酸和复合重复序列[18]。最小数量分别为10、6、5、5、5、5和5。在获得SSR序列信息后,使用Primer 3.0对SSR序列进行引物设计,获得绵羊引物库。随机挑选100 对引物,此100 对引物扩增完成时片段长度处于100~280 bp之间,平均片段大小为172 bp。用筛选出的100 条SSR引物对分别对3种样品的DNA进行PCR扩增。
1.3.5 SSR扩增和毛细管电泳检测
PCR体系:引物F:10 μmol/L(20~50 ng/μL),1 μL;引物R:10 μmol/L(20~50 ng/μL),1 μL;dNTP(mix):10 μmol/L(20~50 ng/μL),1 μL;TaqBuffer(含MgCl2):10×(20~50 ng/μL),0.2 μL;Taq酶:5 U/μL(20~50 ng/μL),0.5 μL;加入ddH2O 25 μL。
PCR条件:95 ℃预变性3 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,循环以上步骤10 次。94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,循环以上步骤35 次。72 ℃修复延伸5~8 min。
通过6-羧基荧光素和6-羧基四甲基罗丹明荧光标记获得的SSR引物并通过PCR扩增后,使用毛细管电泳检测SSR分型,最后使用Genemapper软件整理并分析SSR数据,导出每对引物的pdf峰图文件,筛选并保留具有多态性且能够产生高度特异性扩增片段的微卫星标记引物。
1.3.6 多态性检测和数据处理
从预实验结果中挑出具有多态性的引物,对宁夏滩羊、新疆细毛羊和藏绵羊(共计60个样本)进行遗传多态性检测。通过GenAIEx软件计算各微卫星位点的平均等位基因数(alleles number,Na)、平均有效等位基因数(effective alleles number,Ne)、平均观测杂合度(observed het-erozygosity,Ho)、平均期望杂合度(expected heterozygosity,He),并使用POPGENE 3.2软件计算各微卫星位点的多态信息含量(polymorphism information content,PIC)[19-20]。Na是反映群体遗传变异大小的一个指标,等位基因数越多,其多态性越高。Ne是基因一致度的倒数,反映等位基因间的相互影响,也可作为群体遗传变异的一个测度[21]。He主要是根据种群内当前优势等位基因的分布频率来推算;Ho是随机抽取两个样本的等位基因不相同的概率。杂合度能够反映基因多样性,群体的杂合度表示某位点为杂合子的 概率[22]。PIC最初用于连锁分析时对标记基因多态性的估计[23],现常用来表示微卫星多态性高低的程度[24-25]。
1.3.7 特异性引物的有效性与适用性检验
将筛选出的特异性引物用于宁夏滩羊、新疆细毛羊和藏绵羊的肌肉和肝脏鉴别中,检验特异性引物的有效性与适用性。纯种宁夏滩羊、藏绵羊和新疆细毛羊分别5 只,分别多点取其肝脏和肌肉的不同部分,每个样本为25 g,采样完成后将样品分装,共计30个样本,品种对应分别标记。宁夏滩羊的肝脏标记为Liver 1~5,肌肉标记为Muscle 1~5;新疆细毛羊的肝脏标记为Liver 6~10,肌肉标记为Muscle 6~10;藏绵羊的肝脏标记Liver 11~15,肌肉标记为Muscle 11~15。分别提取肝脏DNA和肌肉DNA,用特异性引物对不同品种和部位的样本进行SSR扩增和毛细管电泳检测。
2 结果与分析
2.1 DNA质量评估结果
A260nm/A280nm用于评估核酸样品的纯度[26]:纯DNA的A260nm/A280nm为1.8[27],如果比值低于1.8,则表示DNA被蛋白或酚类物质污染,需要纯化DNA样品[28]。凝胶电泳检测条带清晰说明完整性良好,若有拖尾或条带呈弥散状,则表明DNA存在不同程度的降解[29]。由表1可知,样本所提取全基因组DNA质量浓度为 (128.4±0.02)ng/μL,总体积50 μL,样本A260nm/A280nm为1.81±0.03,表明DNA未被蛋白或酚类物质污染。 图1为DNA琼脂糖凝胶电泳检测结果,显示样本主条带清晰,表明DNA分子无降解,完整性好,DNA质量满足后续实验要求。
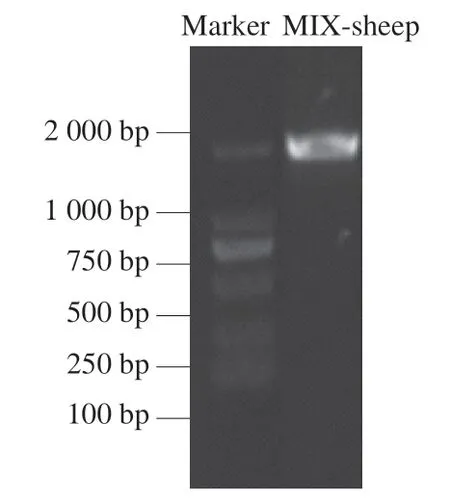
图1 DNA琼脂糖凝胶电泳检测结果Fig. 1 Electrophoresis profile of DNA
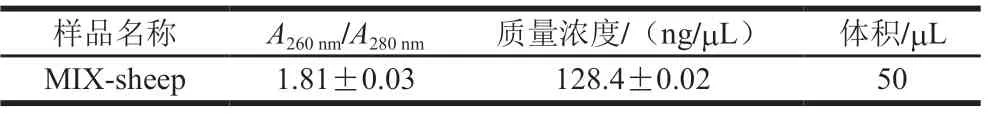
表1 DNA质量结果Table 1 Results of DNA quality
2.2 文库构建结果分析
图2为碱基含量分布折线图,横坐标表示读序内相对位置,纵坐标为读序中该位置碱基组成百分比,不同颜色折线表示不同碱基。依据测序原理[30]可知,在使用随机打断策略制备文库时,如果文库随机性较好,则在读序不同位置碱基组成分布比较均匀,反映到图中为折线无较大波动[31-32]。由图2可知,图中的折线无较大波动,说明文库随机性较好,在读序不同位置的碱基组成分布比较均匀,可以保证后续分析的数据质量。
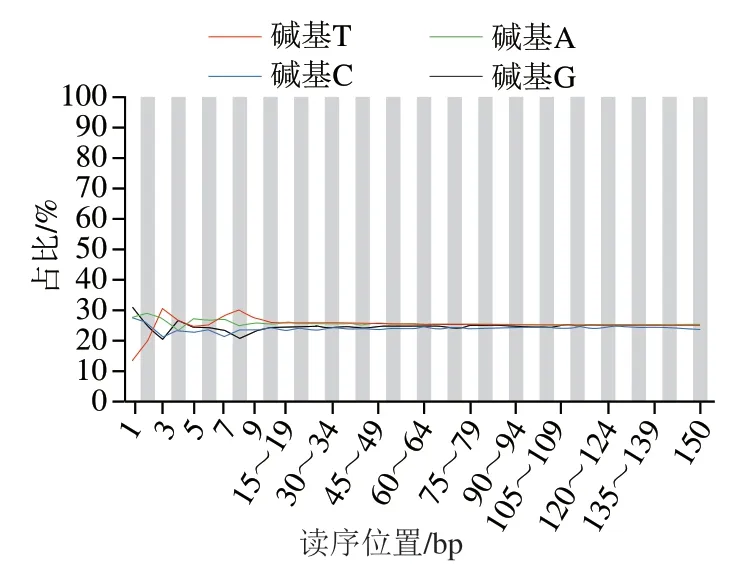
图2 碱基含量分布折线图Fig. 2 Base composition distribution
2.3 SSR位点分布结果
使用MISA检测序列中的SSR位点,Fast QC可视化SSR位点分析结果,共计46 557个有效SSR位点序列。如图3所示,其中单核苷酸、二核苷酸、三核苷酸、四核苷酸、五核苷酸、六核苷酸和复合SSR个数和占比分别为9 318(20.30%)、10 185(21.80%)、8 162(17.50%)、706(1.50%)、687(1.40%)、22(0.10%)和17 478(37.40%)。
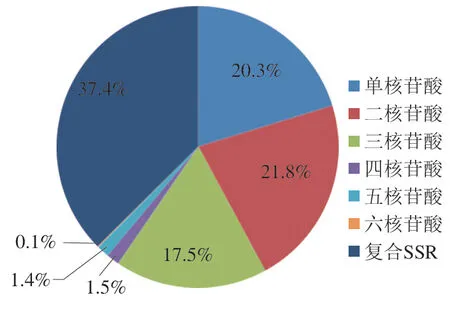
图3 绵羊基因组不同重复类型SSR的分布比例Fig. 3 Proportions of different repeat types of SSRs in ovine genome
由图4气泡图和箱线图可以清晰看出SSR的数目、分布和分布密度情况。发现p1~p6类型即单核苷酸、二核苷酸、三核苷酸、四核苷酸、五核苷酸、六核苷酸的占比普遍较低,而c和c*类型,即复合SSR的占比及分布明显高于其他核苷酸重复类型;复合重复基元种类丰富,要远高于非复合SSR。观察分析基因组中存在的复合重复基元发现,核苷酸重复基元组合差异明显,主要包括(A)13(AA)6*、(A)12(AA)6*、(AA)6(A)13*、(A)14(AA)7*、(A)15(AA)7*(AAA)5*、(AA)7(A)14*等复合重复类型[33]。SSR位点的丰富度分布模式和占比情况与耿多等[34]利用MISA查找拼接序列SSR位点,分析SSR序列特征的结果相同。
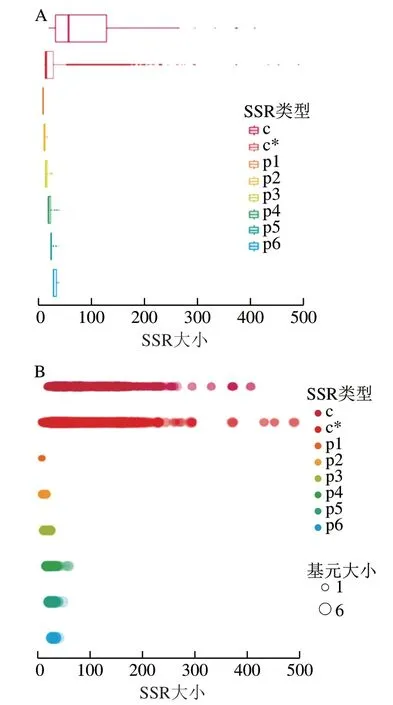
图4 绵羊基因组SSR重复单元分布箱线图(A)和气泡图(B)Fig. 4 Boxplot (A) and bubbleplot (B) of SSR repeat unit distribution in ovine genome
2.4 SSR引物筛选结果
实验选取分别来自宁夏滩羊、新疆细毛羊和藏绵羊3个品种绵羊的DNA为模板,随机挑选100 对引物,合成100 对引物进行扩增检测。如图5所示,在100 对引物中筛选出50 对在3种绵羊中具有不同程度明亮清晰度的引物用于后续实验。引物序号分别为1、2、3、4、5、6、10、11、12、14、15、19、20、21、22、24、36、38、42、45、49、50、51、52、56、61、62、63、65、67、69、70、74、76、77、78、79、84、85、86、88、89、92、93、95、96、97、98、99、100(标注处为挑选的适宜引物)。
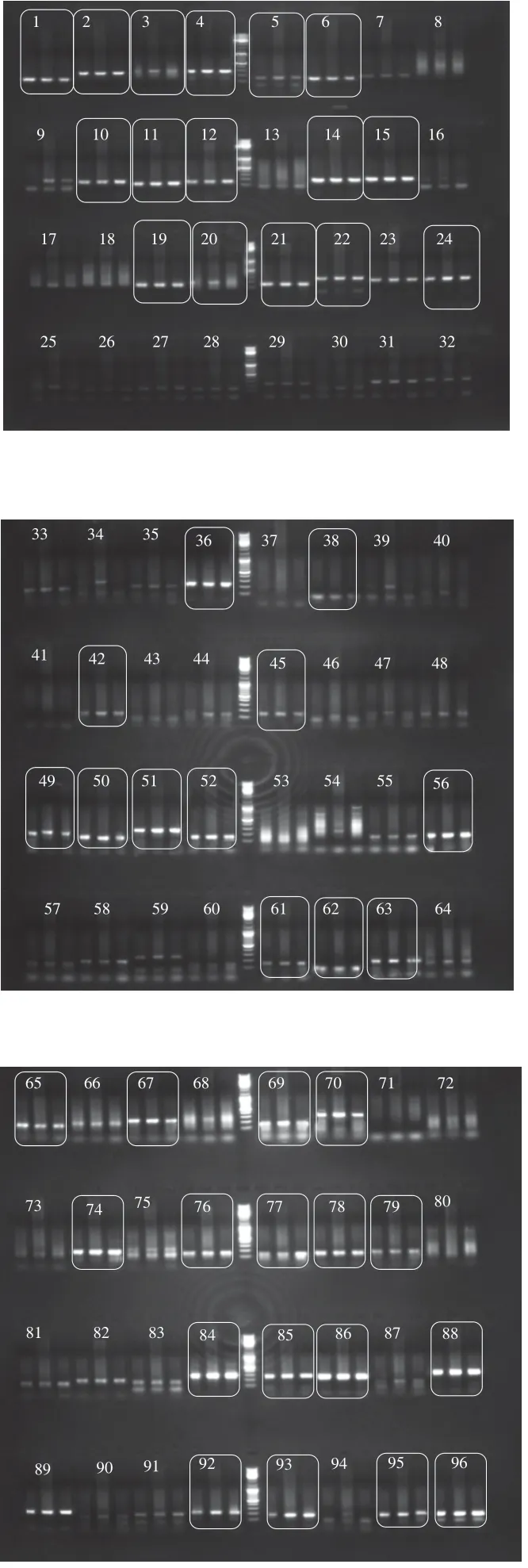
图5 绵羊基因组SSR引物凝胶电泳图Fig. 5 Electrophoresis profiles of PCR amplification productions of ovine genome with SSR primers
2.5 基因组SSR引物的筛选
在初步筛选的50 对引物中,根据扩增结果及毛细管电泳峰图检测结果发现,有10 对SSR引物成功扩增出稳定条带,且具有丰富又稳定的多态性。该10 对引物详细信息见表2,片段大小在102~269 bp之间,退火温度在59~61 ℃之间。其余引物扩增不成功主要是由于出现了明显杂带或扩增产物片段与预期产物片段大小不符的情况[35]。
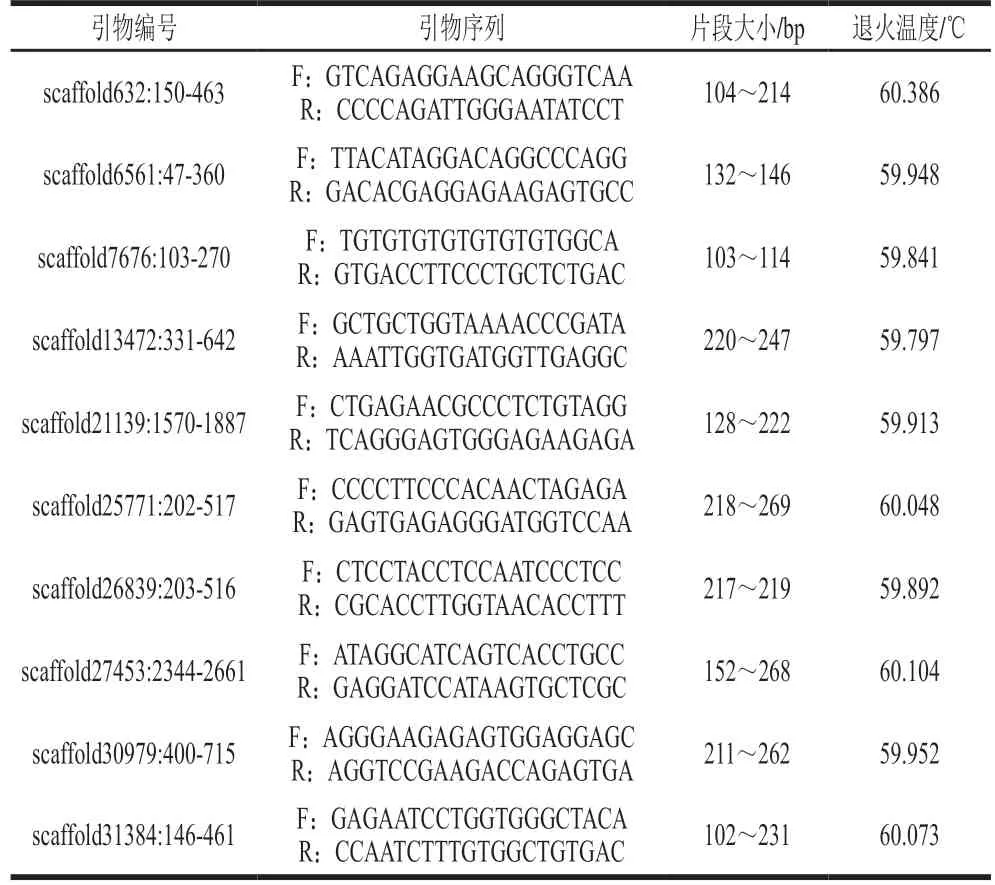
表2 绵羊基因组SSR引物信息Table 2 Information of SSR primers used for amplification of ovine genome
2.6 基因组SSR标记的多态性分析
将筛选的10 对基因组SSR引物,对宁夏滩羊、新疆细毛羊和藏绵羊共计60个样本进行遗传多样性分析,10 对基因组SSR引物在宁夏滩羊、新疆细毛羊和藏绵羊群体中均能检测到多态性,但多态性水平有所不同。 表3为10个微卫星位点的遗传多样性参数,结果显示,宁夏滩羊各参数平均值为Na 4.100、Ne 3.782、Ho 1.007、He 0.704、PIC 0.432,为中等多态性引物。新疆细毛羊各参数平均值为Na 3.100、Ne 2.747、Ho 1.009、He 0.615、PIC 0.414,为中等多态性引物。藏绵羊Na 3.600、Ne 3.193、Ho 0.953、He 0.660、PIC 0.425,为中等多态性引物。当Ne低于Na时,说明在基因组中存在一些高频率的等位基因,以上结果表明,本研究获得的10 对引物存在高频率的等位基因,扩增的SSR位点丰富。10 对引物在3个绵羊群体有较高的遗传多样性水平,其中宁夏滩羊在10个SSR位点的遗传多态程度要高于藏绵羊和新疆细毛羊,表明多态性微卫星标记的选用对群体统计指标具有较大的影响。PIC存在差异可能是有两方面的原因:一方面可能是使用的微卫星标记的种类和具体位点不同;另一方面可能是检测方法所产生的遗传多态性差异。
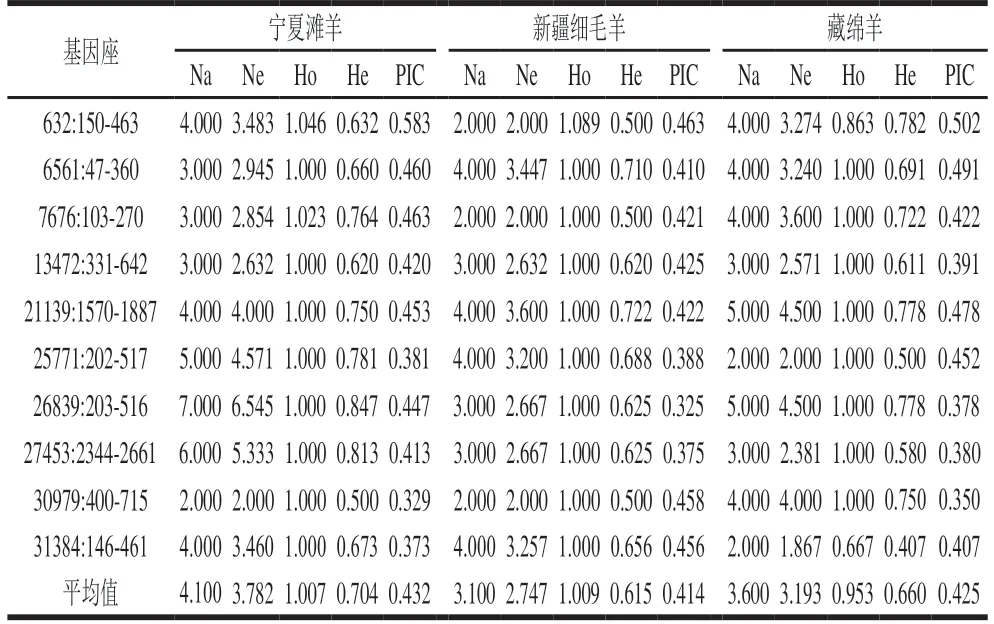
表3 10个微卫星位点的遗传多样性参数Table 3 Genetic diversity parameters of ten microsatellite loci
2.7 绵羊肉基因组SSR引物特异性检测分析
通过对宁夏滩羊、新疆细毛羊和藏绵羊所检测的50个基因组SSR标记位点峰图进行分析,发现其中3 对引物能够显著区分3种绵羊品种。图6~8分别为scaffold632:150-463、scaffold31384:146-461和scaffold7676:103-270对宁夏滩羊、新疆细毛羊和藏绵羊的毛细管电泳图结果。
根据SSR分型峰图,分别建立了宁夏滩羊、新疆细毛羊和藏绵羊的SSR标准分型峰值谱图。由图6可知,scaffold632:150-463引物对滩羊的特征值大小为207.96 bp和210.28 bp,对新疆细毛羊和藏绵羊特征值大小分别是215.17 bp和215.24 bp,表明scaffold632:150-463荧光引物对宁夏滩羊源性肉特异性良好,可以对宁夏滩羊与新疆细毛羊和藏绵羊进行区分。由图7可知,scaffold31384:146-461引物对新疆细毛羊的特征值大小为228.37 bp和231.45 bp,对宁夏滩羊和藏绵羊特征值大小分别是230.39 bp和230.41 bp,表明scaffold31384:146-461荧光引物对新疆细毛羊源性肉特异性良好,能够对新疆细毛羊与宁夏滩羊和藏绵羊进行区分。由图8可知,scaffold7676:103-270引物对藏绵羊的特征值大小为94.83 bp和110.46 bp,对宁夏滩羊和新疆细毛羊特征值大小分别是111.46 bp和111.45 bp,表明scaffold7676:103-270荧光引物对藏绵羊肉特异性良好,能够对藏绵羊与新疆细毛羊和宁夏滩羊进行区分。
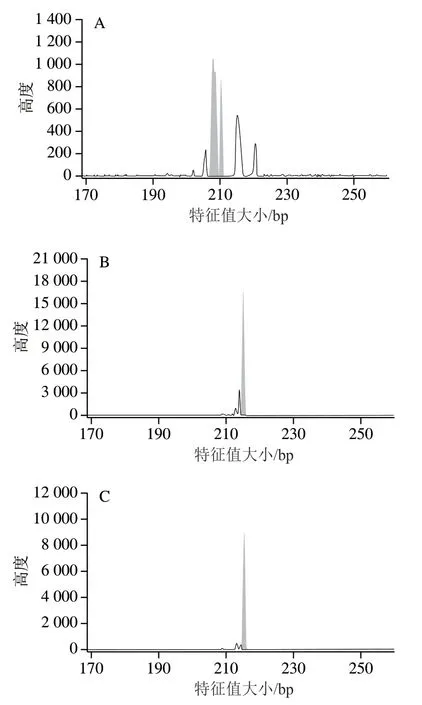
图6 绵羊基因组scaffold632:150-463位点SSR电泳图Fig. 6 Capillary electrophoregrams of ovine genome with primer scaffold632:150-463 genomic
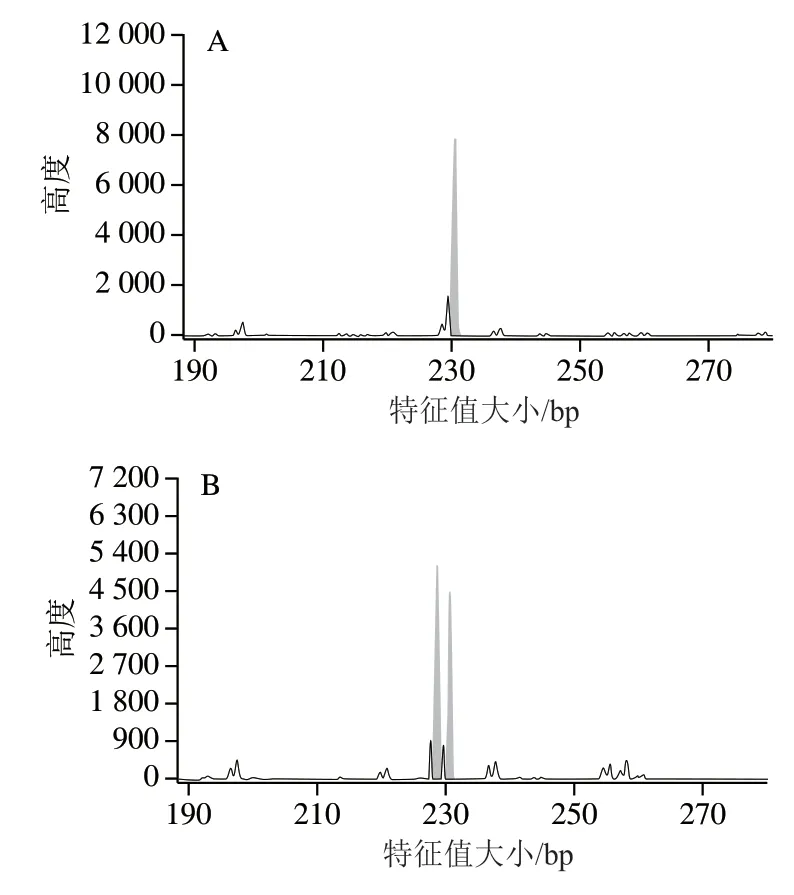
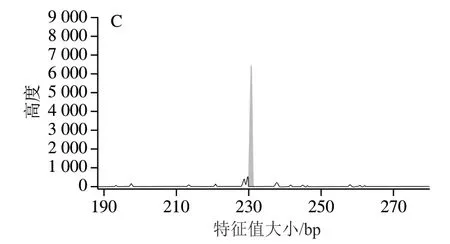
图7 绵羊基因组scaffold31384:146-461位点SSR电泳图Fig. 7 Capillary electrophoregrams of ovine genome with primer scaffold31384:146-461
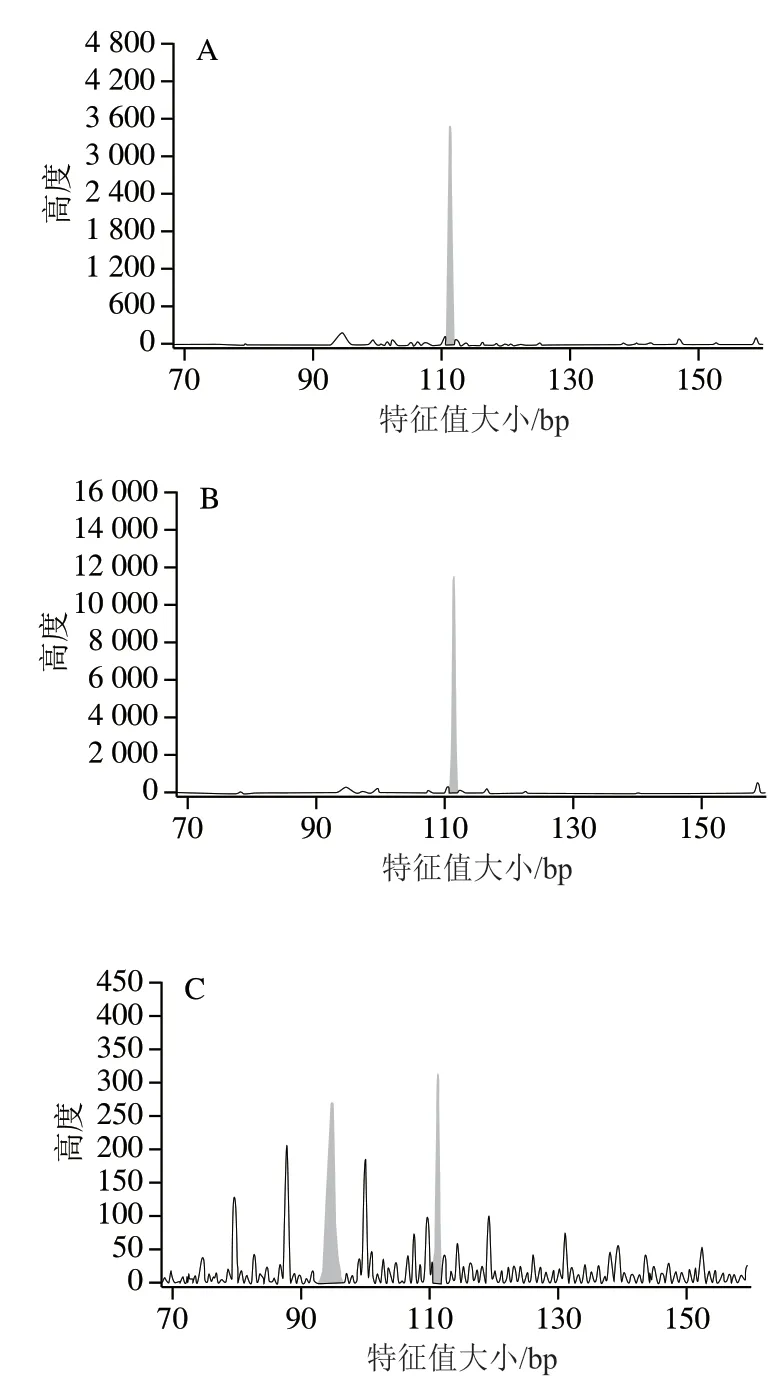
图8 绵羊基因组scaffold7676:103-270位点SSR电泳图Fig. 8 Capillary electrophoregrams of ovine genome with primer scaffold7676:103-270
2.8 特异性引物的有效性与适用性检验结果
2.8.1 DNA提取质量评估
分别对提取得到的3种绵羊肝脏DNA和肌肉DNA进行质量评估,结果见表4。样本所提取肌肉DNA质量浓度为(125.6±0.02)ng/μL,总体积50 μL,样本A260nm/A280nm为1.80±0.04;样本所提取肝脏DNA质量浓度为(128.9±0.01)ng/μL,总体积50 μL,样本A260nm/A280nm为1.82±0.03。表明DNA未被蛋白或酚类物质污染。图9为DNA琼脂糖凝胶电泳检测结果,显示样本主条带清晰,表明DNA完整性好,DNA分子无降解。由实验结果可知,3种绵羊的肝脏DNA和肌肉DNA的提取质量相差不大,且相同体积下,肝脏DNA的质量浓度更高。一般来说,脊椎动物的肌肉、心脏、肝、肾、脾等器官组织都是DNA的良好来源,但肝脏的DNA产量最大。动物DNA的提取多以肝脏为原料,这是由于肝脏是可以不断产生新细胞的器官,很多细胞处在分裂期,此时DNA呈现高度螺旋状态,通过微量采样就可以提取得到大量DNA,能够满足各种涉及PCR的分子生物学实验[36]。李龙飞等[37]通过采集鸡的肝脏、血液、羽髓等不同部位样品,采用不同处理程序提取样品基因组DNA。结果表明,鸡肝脏(50 mg)样品的基因组DNA提取量与鸡微量血液(50 μL)和羽髓样品的基因组DNA提取量相当。蔡振媛等[38]为确定一种方便的野外动物样品保存方法,用不同方法处理高原鼠肌肉和肝脏组织,并提取基因组总DNA,通过琼脂糖凝胶电泳和紫外分光光度计对提取的基因组总DNA质量进行检测,结果显示:通过相同方式处理并提取的肝脏DNA产量比肌肉组织高,说明肝脏是理想的基因组DNA提取样本。

表4 DNA质量结果Table 4 Results of DNA quality
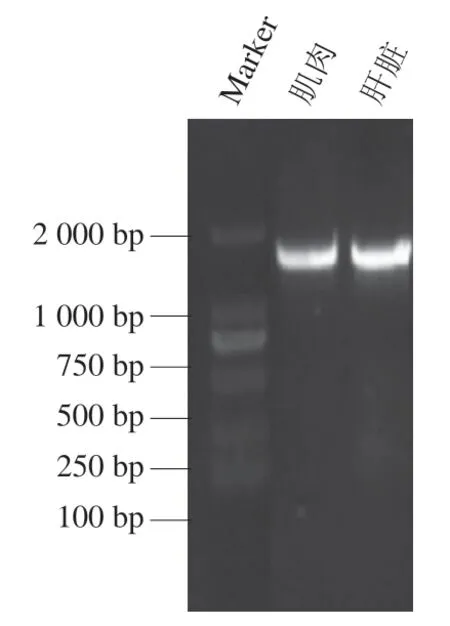
图9 DNA琼脂糖凝胶电泳检测结果Fig. 9 Electrophoresis profile of DNA
2.8.2 3 条特异性引物的毛细管电泳检测结果
将提取的宁夏滩羊、藏绵羊和新疆细毛羊的肝脏和肌肉DNA,采用3 条荧光引物分别扩增后,进行毛细管电泳检测,检测结果见表5。引物scaffold632:150-463的毛细管电泳检测结果表明,Liver 1~5、Muscle 1~5,共5 只绵羊为宁夏滩羊;引物scaffold31384:146-461的毛细管电泳检测结果显示,Liver 6~10、Muscle 6~10,共5 只绵羊为新疆细毛羊;引物scaffold7676:103-270的毛细管电泳检测结果显示,Liver 11~15、Muscle 11~15,共5 只绵羊为藏绵羊。说明通过SSR方法获得的3 条荧光引物对宁夏滩羊、新疆细毛羊和藏绵羊的肌肉和肝脏特异性和适用性均良好,能够对这3种绵羊肉进行有效区分。
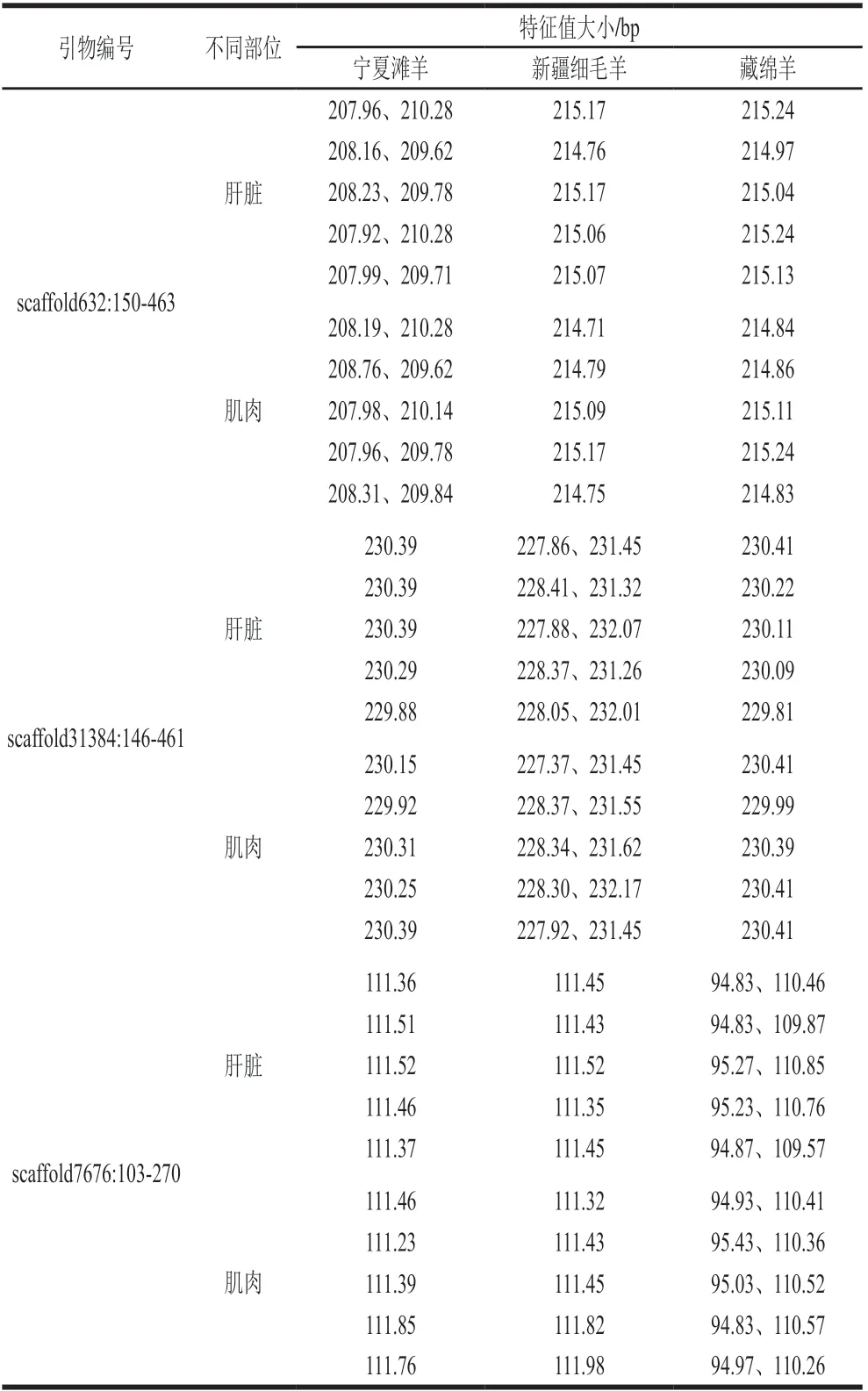
表5 特异性引物验证结果Table 5 Verification of specific primers
3 结 论
本实验提取纯种宁夏滩羊、新疆细毛羊和藏绵羊的肝脏DNA,DNA提取结果表明DNA无污染且完整性好。利用NEB Next®UltraTMDNA Library Prep Kit for Illumina®试剂盒进行文库构建、扩增、纯化和质控,结果表明文库碱基质量良好,随机性较好,碱基组成分布比较均匀,实现绵羊全基因组成功建库。通过50 对SSR引物进行PCR扩增并使用毛细管电泳检测SSR分型后,挑选多态性引物对宁夏滩羊、新疆细毛羊和藏绵羊样本进行遗传多态性检测。结果显示,有10 对SSR引物成功扩增出稳定条带,具有丰富又稳定的多态性。将10 对多态性SSR引物对宁夏滩羊、新疆细毛羊和藏绵羊进行遗传多样性分析。其中,宁夏滩羊、新疆细毛羊和藏绵羊的平均Na分别为4.100、3.100和3.600;平均Ne分别为3.782、2.747和3.193;平均Ho分别为1.007、1.009和0.953;平均He分别为0.704、0.615和0.660;平均PIC分别为0.432、0.414和0.425,说明宁夏滩羊的遗传多态程度要高于藏绵羊和新疆细毛羊。毛细管荧光电泳检测峰图结果表明:scaffold632:150-463荧光引物对宁夏滩羊源性肉特异性良好,scaffold31384:146-461荧光引物对新疆细毛羊源性肉特异性良好,scaffold7676:103-270荧光引物对藏绵羊肉特异性良好;这3 对引物能够实现对宁夏滩羊、新疆细毛羊和藏绵羊的有效区分,且对于不同品种的羊肉检测有很好的适用性。此研究成功建立我国西北地区3个绵羊品种的基因库,科学准确鉴别3个品种纯种绵羊肉,不仅进一步扩大了宁夏纯种滩羊的鉴别范围,保证宁夏纯种滩羊的优势,而且对于西部地区绵羊肉产业发展以及科学开发利用也具有重要的指导意义。
