金黄色葡萄球菌RAA-LFD快速检测方法的建立与应用
2022-03-05后来旺李达容潘迎捷丰东升孙晓红
后来旺,李达容,邓 波,赵 勇,3,4,潘迎捷,3,4,丰东升,孙晓红,3,4,*
(1.上海海洋大学食品学院,上海 201306;2.上海市农产品质量安全中心,上海 201799;3.农业农村部水产品贮藏保鲜质量安全风险评估实验室(上海),上海 201306;4.上海水产品加工及贮藏工程技术研究中心,上海 201306)
随着人们生活水平的提高,食品安全已成为一个引起广泛关注的全球公共卫生问题。金黄色葡萄球菌是一类可引起人类头晕、腹泻、恶心、呕吐等急性肠胃炎的食源性致病微生物[1-2],其污染的食品会给全球食品产业造成巨大的经济损失,并对人类健康造成严重的威胁[3]。在我国每年发生的细菌性食物中毒事件中,金黄色葡萄球菌的检出率高达25%,严重影响食品安全[4]。牛乳中存在金黄色葡萄球菌会破坏牛乳的营养组分,影响乳品质量[5]。同时,饮用由金黄色葡萄球菌污染的牛乳会引起人体不适,进而引发炎症或中毒[6]。因此,开发准确可靠的诊断方法是实现金黄色葡萄球菌动态监测的重要保证。
目前国家标准对金黄色葡萄球菌检测的“金标准”方法为微生物生化鉴定法[7-8],可准确检测出引发食物中毒的病原微生物,该方法具有成本低廉、准确度高等特点,但该方法存在步骤操作繁琐,费时费力,不能检测葡萄球菌肠毒素等问题。聚合酶链式反应(polymerase chain reaction,PCR)因其高灵敏度与特异性、反应迅速等特点广泛应用于病原菌的检测。Saka等[9]根据16S rRNA基因与耐热核酸酶基因(nuc)建立PCR方法检测乳制品中金黄色葡萄球菌,但PCR检测方法需温控设备和专业实验室,这些条件限制了该方法在基层的应用。随着分子生物学的发展,多重交叉置换扩增技术(multiple cross displacement amplification,MCDA)、环介导等温扩增技术(loopmediated isothermal amplification,LAMP)等恒温扩增技术的出现弥补了PCR技术应用的局限性,能在非实验室环境条件下实现快速准确检测。MCDA因其操作简单、产物质量好且稳定而被广泛应用于病原菌的检测。Wang Yi等[10]建立MCDA能特异性鉴别出耐甲氧西林金黄色葡萄球菌,但该方法存在起始模板量低时会引起扩增偏差大等问题。LAMP可在恒温条件下(65 ℃)扩增目的基因,具有操作简单、成本低、对设备要求低等特点被广泛应用。Tian Xiaolan等[11]建立了特异性检测金黄色葡萄球菌的LAMP方法,但引物设计复杂,需要2~3 对引物,而且存在反应时间长等缺点,无法满足现场快速检测和大规模监测的需求。
重组酶等温扩增技术(recombinase aided amplification,RAA)主要是3种核心酶(重组酶、单链DNA结合蛋白和DNA聚合酶)在适宜温度条件发生酶促反应,快速完成解链、配对与延伸实现DNA快速复制的一项分子生物学检测技术[12]。该技术具有灵敏度高、特异性强、反应时间短、稳定性好、对设备要求低等优点,现已广泛应用到病毒、细菌、支原体、寄生虫等的快速检测中[13-18]。侧流层析试纸条(lateral flow dipstick,LFD)是一种可视化观察扩增产物的端点检测技术,RAA扩增的双标记产物通过抗原抗体结合作用,在检测线位置形成“荧光素抗体-双标记核酸扩增产物-胶体金复合体”,5 min后可直接肉眼观察结果。结合RAA扩增与LFD检测技术的RAA-LFD方法具有良好的特异性与灵敏度、结果易读、对设备与实验操作人员要求低,适用于非实验室环境的快速检测,作为一种有力的监测手段已广泛应用于病原微生物的早期监测与排查、出入境快速检疫与食品安全等众多领域[19-22]。
本研究根据金黄色葡萄球菌高度保守的耐热核酸酶基因(nuc)为靶基因,将RAA与LFD相结合,建立一种快速检测牛奶中金黄色葡萄球菌的RAA-LFD方法,并通过模拟样品与实际样品的检测进行可靠性验证,以期为牛奶及其制品中金黄色葡萄球菌的快速筛查提供技 术支撑。
1 材料与方法
1.1 材料与试剂
金黄色葡萄球菌与其他常见致病菌菌株均于-80 ℃超低温甘油管冻存。其中3 株金黄色葡萄球菌、1 株单核细胞性李斯特菌、1 株产酸克雷伯氏菌和1 株肺炎克雷伯氏菌均分离自奶牛养殖场。实验所用的细菌菌株见表1。
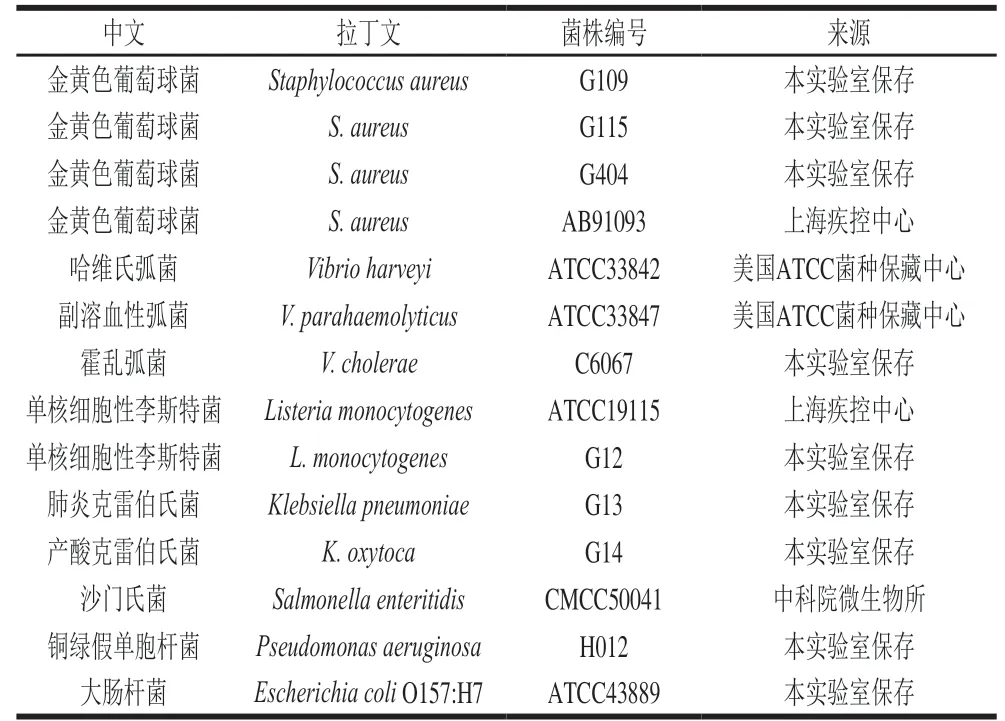
表1 实验所用的细菌菌株Table 1 Bacterial strains used in this study
RAA核酸扩增试剂盒 江苏奇天基因生物科技有限公司;一次性核酸检测试纸条(3号) 杭州优思达生物技术有限公司;细菌基因组DNA提取试剂盒 天根生化科技(北京)有限公司;琼脂糖、核酸染料 生工生物工程(上海)股份有限公司;PremixTaq(ExTaqVersion 2.0 plus dye) 宝日医生物技术(北京) 有限公司;LB琼脂培养基、LB肉汤培养基、胰酪胨大豆琼脂(trypticase soy agar,TSA)培养基、胰蛋白胨大豆肉汤(tryptone soy broth,TSB)培养基 北京陆桥技术有限责任公司。
1.2 仪器与设备
53311型PCR仪 美国Eppendorf公司;HWS-12型电热恒温水浴锅 上海申生科技有限公司;酶标仪 美国伯腾仪器有限公司;凝胶成像分析仪 美国伯乐 公司;ESCO超净工作台 美国Airstream公司。
1.3 方法
1.3.1 引物设计与筛选
从GenBank中下载金黄色葡萄球菌的nuc基因序列(LS483300.1、LR134088.1、EF529607.1、EF529597.1、AJ938182.1),通过DNAMAN比对分析nuc基因序列的同源性并确定保守区域,采用Primer-BLAST和Primer5软件根据保守区域共设计3 对引物 (表2)。通过RAA扩增和琼脂糖凝胶电泳筛选特异性引物。确定最佳引物后在上下引物5′端分别标记荧光素(6-carboxyfluorescein,6-FAM)和生物素(Biotin),用于结合胶体金示踪物进行试纸条检测。引物及引物的标记由生工生物工程(上海)股份有限公司合成。

表2 实验所用引物Table 2 Primers used in this study
1.3.2 细菌基因组DNA的提取
试剂盒提取法:将保存在甘油管中的细菌菌株,划线接种于TSA固体培养基培养后,挑取单菌落接种到TSB营养肉汤中。37 ℃过夜培养,转接2 次后,取1 mL上述经活化培养的细菌培养液至1.5 mL离心管中,根据细菌基因组DNA提取试剂盒说明书进行提取。提取的基因组DNA通过1%琼脂糖凝胶电泳和BioTek酶标仪测定基因组DNA完整性、浓度与纯度,-20 ℃保存备用。
参考Gao Weifang等[24]通过煮沸裂解法提取细菌基因组DNA,略作改动。取1 mL活化培养的细菌菌液至1.5 mL离心管中,12 000 r/min离心2 min,弃上清液后加入1 mL无菌生理盐水重悬,12 000 r/min离心2 min后弃去上清液,加入100 μL ddH2O重悬,95 ℃处理10 min,冰上放置2 min,12 000 r/min离心2 min,取上清液, 于-20 ℃保存备用。
1.3.3 金黄色葡萄球菌RAA-LFD检测方法的建立
RAA反应根据RAA核酸扩增试剂盒说明书进行。反应体系总体积为50 μL:nuc-RAA-LF/LR各1 μL(10 μmol/L),基础缓冲液25 μL,模板DNA 1 μL,ddH2O 19.5 μL充分混匀后加入到含冻干酶粉的反应管中,充分溶解,加入2.5 μL醋酸镁溶液(280 mmol/L),充分混匀后离心,放入水浴锅39 ℃温浴反应30 min后,反应管立即置于冰上5 min。取10 μL RAA核酸扩增产物滴加到样品垫,将LFD样品垫末端垂直插入含有100 μL缓冲液的EP管中,5 min后取出试纸条进行观察并拍照。LFD结果判定[25]:阳性样品试纸条的质控线与检测线均出现清晰可见的红色条带,表明样本中含有待检测的核酸片段;阴性样品则仅有质控线出现清晰可见的红色条带,表明样本中不含目的核酸片段,或其数量低于试纸条的最低检出量。
1.3.4 RAA-LFD扩增反应体系和条件的优化
在保持RAA反应体系中酶、基础缓冲液和醋酸镁等不变的情况下,加入不同浓度的引物(400 、200、100、50、25、12.5 nmol/L),分别在25、31、33、35、37、39、41、43 ℃扩增5、10、15、20、25、30 min。扩增产物采用LFD进行检测,通过裸眼观察试纸条T线颜色深浅与ImageJ软件对T线条带的强度进行量化共同判定结果,获得RAA扩增的最佳反应体系和反应条件。
1.3.5 RAA-LFD方法的特异性评价
分别对4 株金黄色葡萄球菌和10 株非金黄色葡萄球菌基因组DNA进行RAA扩增,LFD检测扩增结果,验证金黄色葡萄球菌特异性引物对与非靶标菌株无交叉反应。
1.3.6 RAA-LFD方法的灵敏度评价
1.3.6.1 基因组DNA的检出限
通过试剂盒提取的金黄色葡萄球菌基因组DNA 10 倍梯度稀释(4 ng/μL、400 pg/μL、40 pg/μL、4 pg/μL、400 fg/μL、40 fg/μL、4 fg/μL),各取1 μL作为模板进行RAA扩增,以ddH2O作为阴性对照,扩增产物通过LFD进行端点检测确定该方法对靶向基因的检出限。
1.3.6.2 纯培养物的检出限
将培养至109CFU/mL的金黄色葡萄球菌纯培养物进行10 倍梯度稀释,取各稀释梯度菌液进行涂布,次日进行平板计数,同时取各稀释梯度的金黄色葡萄球菌菌液,用煮沸法提取基因组DNA,各取1 μL作为模板进行RAA扩增,以ddH2O作为阴性对照,扩增产物通过LFD进行端点检测确定该方法对金黄色葡萄球菌纯培养物的检出限。
1.3.7 模拟牛奶样品检测灵敏度
1.3.7.1 RAA-LFD法检测模拟牛奶样品灵敏度
按照GB 4789.10—2016《食品微生物学检验 金黄色葡萄球菌检验》[26]检测确定金黄色葡萄球菌阴性的市售牛奶样品备用。将37 ℃条件下培养至109CFU/mL金黄色葡萄球菌菌悬液进行10 倍梯度稀释,分别加入到25 mL备用牛奶中,均匀混合后加入225 mL TSB培养基,置于37 ℃条件下分别培养0、2、4、6 h后,各取1 mL采用煮沸法提取基因组DNA,进行RAA扩增,扩增产物通过试纸条观察并拍照记录结果。
1.3.7.2 PCR法检测模拟牛奶样品灵敏度
将1.3.7.1节提取的基因组DNA为模板进行PCR扩增[23],扩增引物见表2。PCR体系为25 μL:PremixTaq12.5 μL,PCR-F/R各1 μL,模板DNA 1 μL,ddH2O 9.5 μL充分混匀后离心,置于PCR仪进行扩增,扩增程序为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃复性45 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。反应结束后于2%琼脂糖凝胶电泳,并用凝胶成像系统拍照保存。
1.3.8 牛奶中金黄色葡萄球菌的检测
从上海郊区奶牛场采集牛奶样本64 份,置于冰中运回实验室。采用微生物生化鉴定法、PCR法与RAA-LFD方法进行检测,验证所建立方法在实际样品中检测金黄色葡萄球菌的应用效果。从灵敏度、特异性和总符合率3个指标评价所建立方法诊断实验真实性[27]。
1.4 数据处理
本研究所有实验重复3 次,实验数据采用GraphPad prism 8.0软件作图,通过IBM SPSS statistics 22.0软件对实验数据进行显著性差异分析,P<0.05,差异显著。
2 结果与分析
2.1 引物筛选
根据RAA引物设计原则共设计3 对引物,通过RAA扩增及琼脂糖凝胶电泳筛选最佳引物。如图1所示,3 对引物均能扩增得到预期目的条带,其中第2对引物扩增目的片段大小为159 bp,扩增条带明亮且无杂带,扩增效率最高(图1A)。随后将第2条扩增产物割胶回收纯化后送至公司测序,测序结果与GenBank基因库相对应的序列进行比对,分析该序列同源性为99.4%~100% (图1B),表明第2对引物具有较高的特异性,因此选用第2对引物nuc-RAA-F2/nuc-RAA-R2用于检测金黄色葡萄球菌的nuc基因。
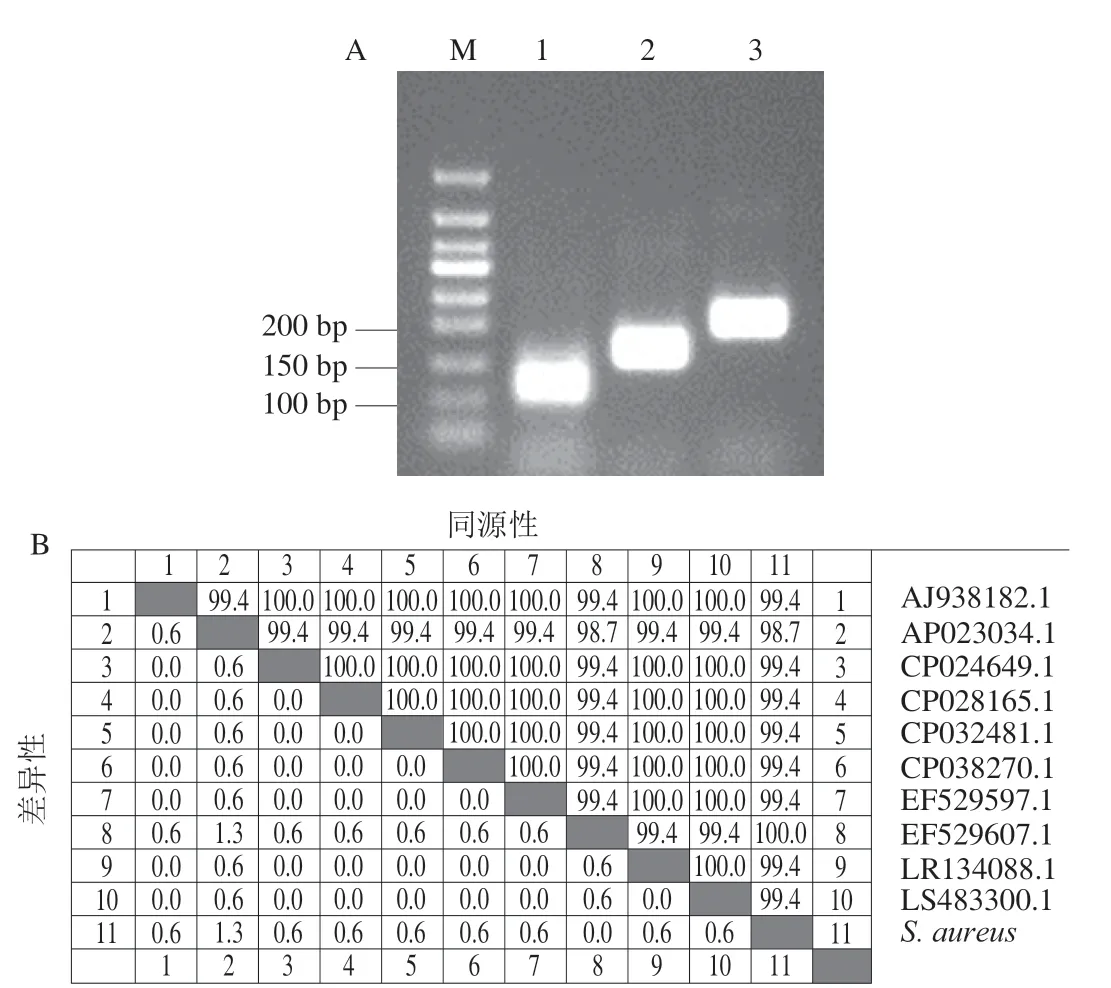
图1 金黄色葡萄球菌RAA引物筛选(A)与序列同源性比对结果图(B)Fig. 1 Screening of RAA primers for S. aureus (A) and sequence homology comparison (B)
2.2 RAA-LFD反应条件优化
分别对RAA反应体系中引物浓度、反应温度与反应时间进行优化确定最佳反应条件。在引物浓度为12.5 nmol/L与25 nmol/L时试纸条T线未有条带,随着引物浓度的增加,LFD试纸条T线颜色加深,显色明显且稳定(图2A)。经ImageJ软件分析发现反应体系中引物浓度大于50 nmol/L时T线灰度值在不同引物浓度间存在显著差异(P<0.05)(图2D)。随着引物浓度的增加有助于显色观察,但会加大引物二聚体产生的可能性,因此选择显色明显的200 nmol/L为最佳引物浓度。在不同反应温度条件下,试纸条T线亮度在较宽的温度范围内呈“拱形”变化(图2B)。在33~37 ℃时,试纸条T线颜色明亮清晰,结合ImageJ软件分析T线灰度值无显著差异(P>0.05)(图2E),表明在33~37 ℃条件下更加有利于RAA反应酶与引物形成复合体,扩增效率更高。为使检测更加接近环境温度,因此选择33 ℃作为反应温度。在引物浓度200 nmol/L、温度33 ℃的基础上优化反应时间,RAA扩增超过20 min后检测线位置条带明亮且趋于稳定,裸眼可见并没有明显变化(图2C)。反应时间为20、25 min和30 min的产物T线灰度值无显著差异 (P>0.05)(图2F),为保证实验的快速性选择20 min为RAA最佳反应时间。通过对RAA反应体系中引物浓度、反应温度与反应时间的优化,最终获得最佳反应条件为50 μL的反应体系中引物浓度为200 nmol/L,33 ℃反应20 min。

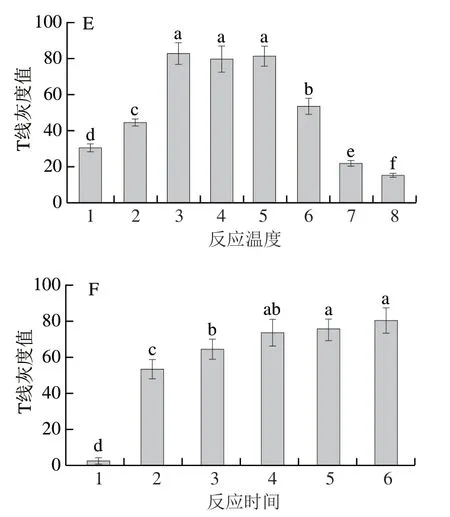
图2 RAA-LFD法检测金黄色葡萄球菌的条件优化Fig. 2 Optimization of the RAA-LFD reaction conditions for S. aureus detection
2.3 RAA-LFD检测特异性分析
以4 株金黄色葡萄球菌和10 株非金黄色葡萄球菌的基因组DNA为模板,对RAA进行特异性分析。如 图3所示,4 株金黄色葡萄球菌在试纸条T线有阳性条带出现,而其他10 株病原菌经扩增后在试纸条T线位置未出现阳性条带,表明基于nuc基因保守序列设计的金黄色葡萄球菌扩增引物具有高度特异性。

图3 RAA-LFD法检测金黄色葡萄球菌特异性实验Fig. 3 Specificity of RAA-LFD for S. aureus detection
2.4 RAA-LFD检测灵敏度分析
2.4.1 基因组DNA的检出限
以不同质量浓度的金黄色葡萄球菌基因组DNA为模板,扩增产物采用LFD进行检测。如图4所示,随着金黄色葡萄球菌基因组DNA浓度的递减,T线条带亮度逐渐变弱,当基因组DNA质量浓度低至4 fg/μL时,仍可观察到T线有阳性条带。因此,RAA-LFD方法检测金黄色葡萄球菌检出限为4 fg/μL DNA。

图4 RAA-LFD法检测金黄色葡萄球菌基因组DNA灵敏度实验Fig. 4 Sensitivity of RAA-LFD for detection of S. aureus genomic DNA
2.4.2 纯培养物的检出限
将1.83×109CFU/mL细菌培养液进行10 倍稀释,分别对稀释的模板进行RAA-LFD检测。如图5所示,随着金黄色葡萄球菌纯菌液浓度的递减,T线条带亮度呈变弱趋势。当浓度为1.83×102CFU/mL 时,T线仍可通过裸眼观察有阳性条带。因此,RAALFD方法检测金黄色葡萄球菌纯培养物检出限为 1.83×102CFU/mL。杨发龙等[28]建立的多重PCR检测金黄色葡萄球菌纯菌液浓度为1.1×102CFU/mL;Tian Xiaolan等[11]建立的金黄色葡萄球菌LAMP技术,检测纯菌液的灵敏度为7.6×102CFU/mL。本研究建立的RAA-LFD法对金黄色葡萄球菌纯菌液的检出限与多重PCR和LAMP法检出限一致,达到102CFU/mL。Ahn等[29]建立了一种基于纸质芯片装置的重组酶聚合酶扩增(recombinase polymerase amplification,RPA)技术能够检测到金黄色葡萄球菌最低纯菌液浓度为102CFU/mL,所需时间为20 min。RAA-LFD相比基于纸质芯片装置的RPA在相同的时间,无需设备的辅助即可达到相同的检出限,更适合在现场和非实验室环境中的快速检测。

图5 RAA-LFD法检测金黄色葡萄球菌纯培养物基因组DNA灵敏度实验Fig. 5 Sensitivity of RAA-LFD for detection of genomic DNA in pure cultures of S. aureus
2.5 模拟牛奶样品检测
通过人工污染牛奶样品验证RAA-LFD方法的可靠性,同时与PCR检测方法进行结果比较。牛奶样品中分别加入103、102、101、100CFU/mL金黄色葡萄球菌时,在未经富集(图6A、E)与富集2 h(图6B、F)的牛奶样品通过PCR与RAA-LFD均检测不到金黄色葡萄球菌;富集4 h后通过RAA-LFD可检测到1.83×102CFU/mL 金黄色葡萄球菌(图6G),而采用PCR方法检测到1.83×103CFU/mL金黄色葡萄球菌(图6C),表明在富集4 h时,RAA-LFD法检测牛奶中金黄色葡萄球菌的灵敏度高于PCR检测方法;在富集6 h后通过PCR与RAALFD检测结果一致,检出限低至1.83×101CFU/mL金黄色葡萄球菌(图6D、H)。Hu Jinqiang等[30]建立的金黄色葡萄球菌RPA检测方法,在富集6 h后可检出牛奶中 38 CFU/mL金黄色葡萄球菌,但需要制胶与电泳去检测。由此可见RAA-LFD检测牛奶中的金黄色葡萄球菌更为灵敏,适合用于现场的快速检测。
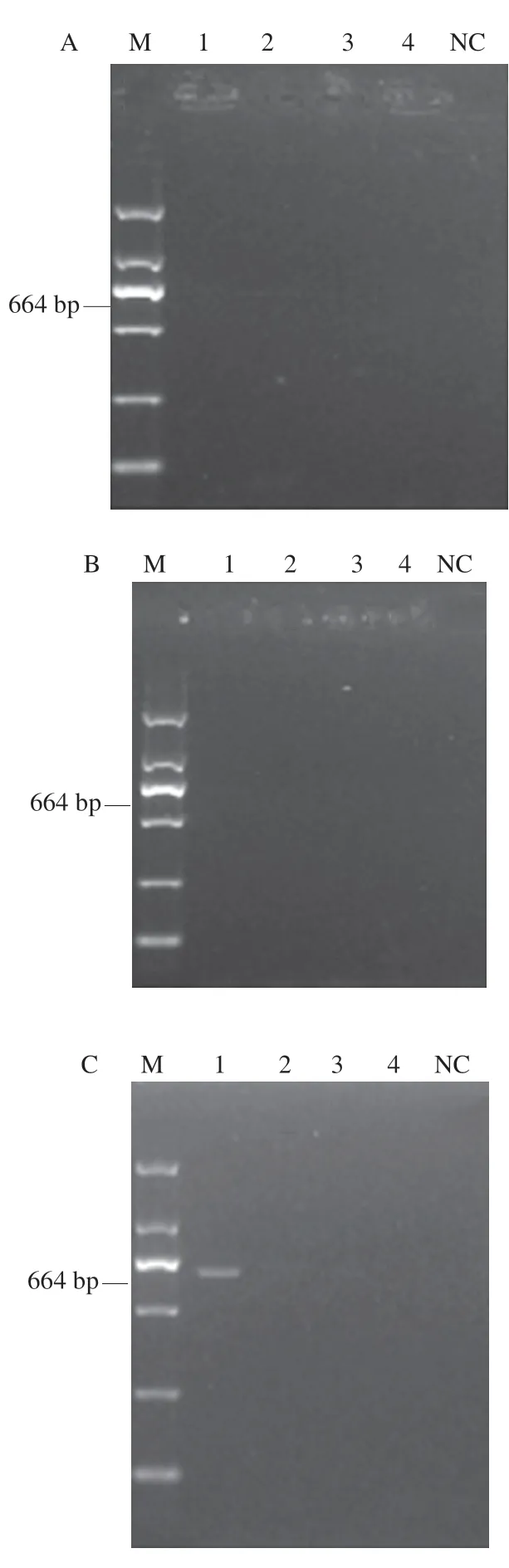

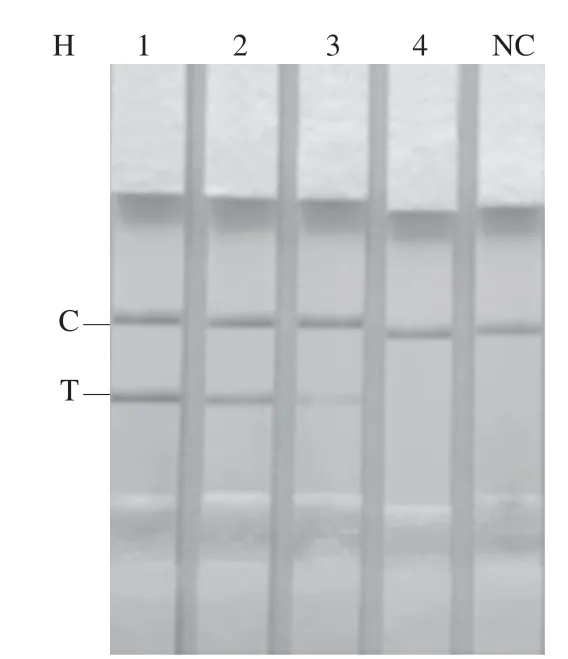
图6 RAA-LFD和PCR方法检测模拟样品中金黄色葡萄球菌Fig. 6 Results of detection of S. aureus in simulated samples by RAA-LFD and PCR
2.6 实际样品检测结果
对采集的64 份牛奶样本分别进行RAA-LFD法、微生物生化鉴定法和PCR法检测,并用κ系数比较RAA-LFD法与其他2种方法结果的一致性,结果如表3所示。RAALFD法检测结果与微生物生化鉴定法或PCR法都具有较高的一致性。RAA-LFD法与微生物生化鉴定法相比,64 份牛奶样本中微生物生化鉴定法检测到了16 份阳性,而RAA-LFD法检测到了19 份阳性,灵敏度达100%;在微生物生化鉴定法检测到的48 份阴性样本中,RAALFD法检测到45 份阴性,特异性达93.8%;RAA-LFD和微生物生化鉴定法的总符合率达到95.3%,κ系数为0.822 (κ>0.75),表明RAA-LFD法与微生物生化鉴定法的检测结果基本一致。RAA-LFD法与PCR法相比,灵敏度为100%,特异性为97.8%,总符合率达到了98.4%,κ系数达到了0.961(κ>0.75),表明RAA-LFD法与PCR有比微生物生化鉴定法更高的一致性。但是RAA-LFD与PCR法相比,仍然有一份假阳性,这可能是因为采集的牛奶样本中金黄色葡萄球菌的浓度较低,达到了RAA-LFD法的检出限但未达到PCR法的检出限,另外,RAA法具有较高的食品基质耐受性,这也可能是RAA-LFD法能检测到更多阳性样本的原因[31-32]。尽管如此,RAA-LFD法与微生物生化鉴定法和PCR法的高符合率说明了RAA-LFD法具有较高的检测准确性。然而,RAA-LFD法既不需要繁琐的操作步骤,也不需要较长的培养鉴定时间或制胶与电泳的时间,这缩短了实际样本中金黄色葡萄球菌的检测时间。另外,利用试纸条检测RAA扩增产物可达到裸眼直接观察检测结果的效果,十分利于在基层环境中的检测。
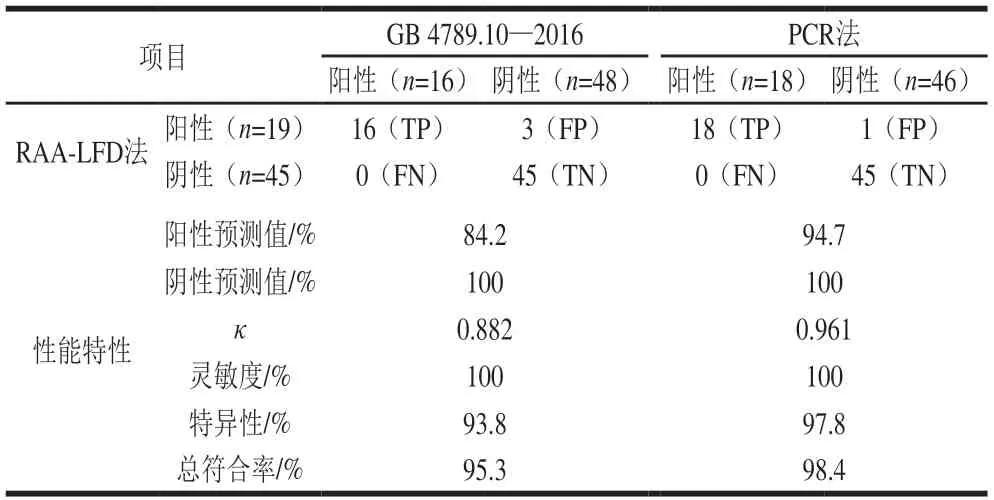
表3 实际样品检测结果Table 3 Results of S. aureus detection in actual samples by RAA-LFD compared with PCR and conventional culture method
3 结 论
本研究以金黄色葡萄球菌高度保守的耐热核酸酶基因(nuc)为靶基因,建立了RAA-LFD快速检测方法,并优化确定最佳反应条件:50 μL的反应体系中引物浓度为200 nmol/L,33 ℃反应20 min。RAA-LFD法检测金黄色葡萄球菌基因组DNA的检出限为4 fg/μL、纯菌液为1.83×102CFU/mL,相比微生物生化鉴定法和PCR方法检测更为快速、灵敏。当人工污染牛奶样品量为1.83×101CFU/mL金黄色葡萄球菌时,RAA-LFD法可在7 h内完成样品处理和检测。对采集的64 份牛奶样品进行检测,RAA-LFD法检测结果与微生物生化鉴定法、PCR法均具有较高的一致性。因此,在实验室资源有限的情况下,RAA-LFD法可作为牛奶及其制品中金黄色葡萄球菌快速筛查的有力手段。
