液相色谱-串联质谱法对牛肉中掺假成分的相对定量分析
2022-03-05康超娣王守伟张颖颖张明悦赵文涛李莹莹
康超娣,王守伟,张颖颖,张明悦,赵文涛,古 瑾,李莹莹
(北京食品科学研究院,中国肉类食品综合研究中心,北京 100068)
动物源性食品是人类膳食结构中的重要组成部分,其丰富的营养物质可满足人们对蛋白质、脂类、碳水化合物和维生素等的需求。随着人们生活水平的提高及消费观念的转变,消费者对肉制品的需求更加趋于高质量、高营养、高安全,但肉制品中原材料标注信息与实际不符的情况越来越多[1],一些不法商贩常在高价肉及肉制品中掺入部分或者全部低价肉以获取利益[2-3],如牛肉中掺入猪肉[4]、鸡肉[5]、马肉[6]等,由于原料肉的形态已经发生了明显的变化,肉眼无法分辨出来[7],并且商品标识与实际商品的组成成分不一致[8],这不仅扰乱了食品市场秩序[9],也侵害了消费者的利益和健康[10],还可能导致消费者感染非肉类过敏原的风险等问题[11-12]。因此,开发肉类种属掺假鉴别及肉制品含肉量溯源技术是肉类市场发展的迫切需求[13]。
近年来,基于质谱技术的掺假鉴别及定性定量分析已成功应用于深加工肉制品中[14-15],特别是利用物种特异性多肽进行掺假鉴别[16-17],这是因为多肽的稳定性比DNA链高,在深加工肉制品的测定方面具有不可比拟的优势[18],既可保证结果的准确性,还可以避免假阳性及复杂基质干扰等问题[19]。Montowska等[20]利用该技术对蒸煮火腿、法兰克福香肠和热狗等加工肉制品进行鉴别,共筛选出25 条特异性多肽,这些特异性多肽不仅可用于识别肉制品中物种掺假,而且还可以溯源食品原料成分。Sarah等[21]同样利用该方法筛选了熟肉中猪肉的特异性多肽标志物,筛选出EVTEFAK、LVVITAGAR、FVIEIR和TVLGNFAAFVQK这4 条热稳定性多肽。Sentandreu等[22]也利用该方法成功鉴别了熟肉制品中鸡肉和火鸡肉。当前这些方法还是集中于对肉制品中掺假成分进行定性分析,但由于食品掺假不仅是物种掺假,还有食品原料成分含量欺诈[23],因此,准确定量肉制品中的含肉量是目前肉类食品行业的重点之一。
针对多物种混合的肉制品,利用物种特异性多肽对肉制品中含肉量进行探究的优势更为显著[24-25]。Montowska等[26]建立了一种检测肉制品混合物中特异性多肽的绝对定量方法,以肉类(鸡、鸭、鹅、猪、牛)和常见的蛋白质过敏添加剂(大豆、牛奶和蛋清)为特定肽标记物,并用稳定同位素(13C和15N)作为内标,能够对特异性肽和蛋白质进行鉴定和定量。Li Yingying等[27]建立了一种基于液相色谱-串联质谱(liquid chromatographytandem mass spectrometry,LC-MS/MS)测定肉制品中猪肉含量的内标法,通过以纯猪肉多肽溶液构建标准曲线,从而计算样品中猪肉的准确含量,该方法回收率为80%~130%。Pan Xiaodong等[28]提出了一种用于检测混合肉样(鸡肉、绵羊和牛肉)中猪肉含量的方法,采用纯猪肉(0.5、1、2、3 g和5 g)获得多肽,通过多肽峰面积和猪肉质量构建标准曲线,其相关系数均大于0.9,检出限可达0.5%。Zhang Yingying等[29]建立了一种不同动物品种血豆腐的定性和绝对定量方法,以猪、牛、羊、鸡、鸭源为研究对象,通过高分辨率质谱进行数据分析并筛选物种特异性多肽,采用定性和定量分析的方法对特异性多肽进行了鉴定,该方法可以直接定量血豆腐中准确的动物血含量。而当前的肉制品定量掺假多集中于利用单一物种的百分含量和特异性多肽峰面积构建标准曲线进行定量分析,相比较而言,本实验采用的相对定量方法,利用不同物种之间的相对含量与多肽峰面积比值进行定量分析,不仅可获得食品成分中多物种间的相对含量,还可避免蛋白质提取效率、酶活性、仪器状态、加工工艺等不确定性因素的变化而造成与真实值之间的差异。
猪肉和鸡肉是人们广泛食用的两大肉类,市场供应较为充足,经加工后肉眼很难鉴别,且价格低于牛肉。唐穗平等[30]的调查研究发现,猪肉和鸡肉易成为牛肉制品中常见的混合或掺假源。本研究以掺入猪肉、鸡肉的牛肉制品为对象,针对牛-猪体系和牛-鸡体系的掺假样品进行相对定量分析,在前期研究的基础上[27,31],通过比较和分析寻找混合体系的相对定量标准曲线的构建方法,并应用于实际样品检测,拟构建一套用于牛肉制品中相对定量分析方法。
1 材料与方法
1.1 材料与试剂
生鲜牛肉、猪肉和鸡肉及市售牛肉制品 市购。
胰蛋白酶(测序级)、二硫苏糖醇(dithiothreitol,DTT)(生化级) 美国Promega公司;碘乙酰胺(iodoacetamide,IAA)、三氟乙酸(生化级) 美国Sigma公司;甲酸、乙酸、乙腈(均为色谱纯) 德国Merck公司;HLB固相萃取柱(60 mg,3 mL) 美国Waters公司;尿素、硫脲、盐酸等均为国产分析纯。
1.2 仪器与设备
LYNX 4000高速落地离心机、TSQ超高效液相色谱-串联质谱仪(配有电喷雾离子源、TraceFinder4.1数据处理系统) 美国Thermo公司;OMNI TIP均质器 美国Omni公司;THZ-82B气浴恒温振荡器 江苏金怡仪器科技有限公司。
1.3 方法
1.3.1 样品制备
生肉模拟混合体系:制备两种模拟掺假体系,即牛/猪体系和牛/鸡体系。将纯牛肉分别和猪肉、鸡肉进行低、中、高3种比例的混合,确保混合比例为10%、50%、80%。
肉制品模拟混合体系:参照熏煮香肠肉制品加工配方,通过加入肉、糖、盐、油、磷酸盐、玉米淀粉、大豆蛋白等辅料及添加剂,制备两种肉制品模拟掺假体系,即牛肉-猪肉、牛肉-鸡肉的混合体系,牛肉分别与猪肉、鸡肉的添加比例如表1所示,其中,猪肉与牛肉、鸡肉与牛肉相对含量实际比值均分别为0.250、0.667、1.000、1.500、4.000。
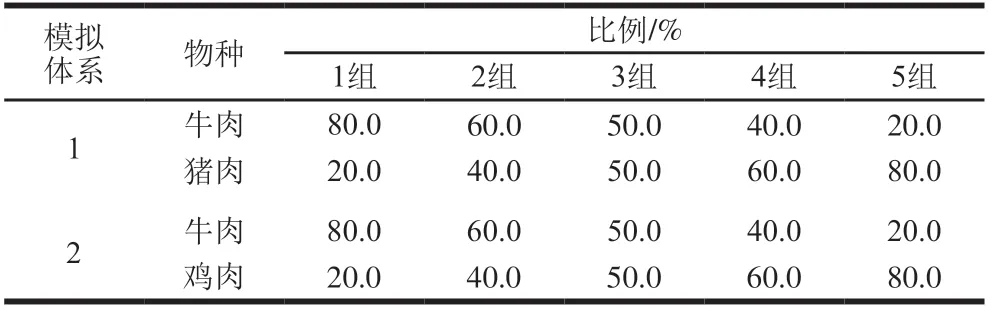
表1 模拟牛肉制品中牛肉和猪肉、鸡肉的混合比例Table 1 Beef, pork and chicken contents in simulated steak
1.3.2 样品前处理
根据前期研究工作[32],将样品的前处理过程分为蛋白提取、酶解和除盐3个步骤,其工作流程图见图1。具体操作如下:分别称取上述肉样2 g,加入20 mL提取液(Tris-HCl 0.05 mol/L、尿素7 mol/L、硫脲2 mol/L, pH 8.0),冰水浴均质,于4 ℃、12 000 r/min离心20 min;吸取200 μL上清液,加入30 μL 0.05 mol/L DTT溶液,60 ℃振荡反应45 min;取出并恢复室温,加入30 μL 0.1 mol/L IAA溶液,暗处反应30 min;取出并恢复室温,先加入1.5 mL缓冲溶液(25 mmol/L Tris-HCl,pH 8.0),再加入60 μg胰蛋白酶置于37 ℃反应过夜;取出放置室温,用0.5%三氟乙酸调节pH值小于2以终止反应。依次用乙腈、50%乙腈溶液、0.1%三氟乙酸活化HLB固相萃取柱,上样,依次用0.1%三氟乙酸、0.5%乙酸洗脱,最后用2 mL 60%乙腈+0.5%乙酸洗脱,过0.22 μm滤膜,待测。
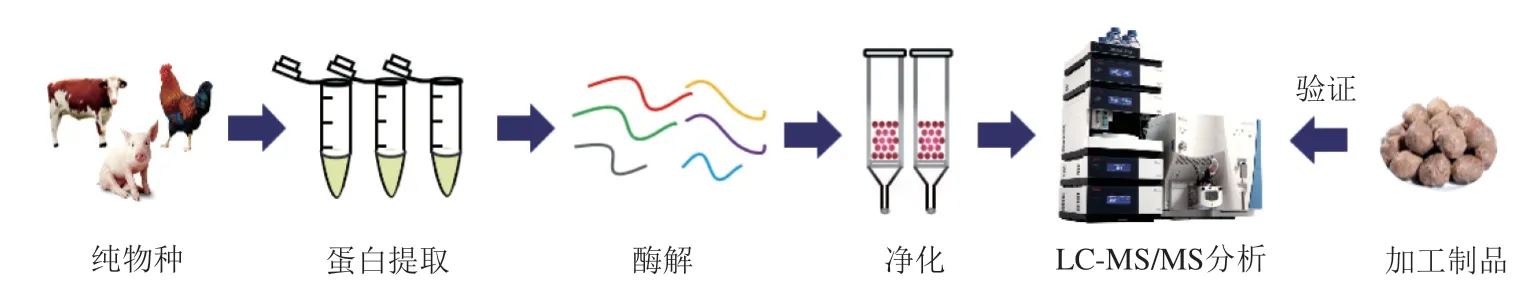
图1 样品制备及物种真实性鉴别流程图Fig. 1 Flow chart for sample preparation and authentication
标准曲线的制备:在离心后吸取样品时,将提取的纯猪肉和鸡肉的上清液分别和纯牛肉上清液进行不同比例的混合制作标准曲线,后续操作一致,质量浓度范围可根据实际情况进行调整。
1.3.3 LC-MS/MS分析
色谱条件:C18色谱柱(2.1 mm×100 mm,1.9 μm),流速为0.2 mL/min,柱温40 ℃,进样量10 μL,流动相:A为0.1%甲酸-水,B为0.1%甲酸-乙腈;梯度洗脱程序:0~0.2 min,97%~90% A、3%~10% B;0.2~16 min,90%~60% A、10%~40% B;16~17 min,60%~20% A、40%~80% B;17~19.5 min,20% A、80% B;19.5~19.6 min,20%~97% A、80%~3% B;19.6~25 min,97% A、3% B。
质谱条件:喷雾电压3 500 V;鞘气压力35 arb;辅气压力15 arb;离子传输管温度275 ℃;离子源雾化温度380 ℃;碰撞气压力1.5 mTorr,Q1和Q3分辨率均0.7。
1.3.4 多肽的LC-MS/MS分析
在本实验室前期多肽筛选工作研究的基础上[27,33-34], 将高分辨筛选的物种独有的多肽信息转换为离子对信息,并应用至LC-MS/MS,通过考察每组特异性离子对的保留时间、子离子的峰形、响应强度等参数,最终各个物种筛选出来的特异性多肽信息见表2。利用TraceFinder软件进行数据分析,对各个样品进行多重反应监测(multiple reaction monitoring,MRM)模式扫描,通过对比牛、猪、鸡的保留时间、响应强度等,从而筛选了各物种的特异性离子对信息(表2)。图2展示了牛、猪、鸡的提取离子流图。
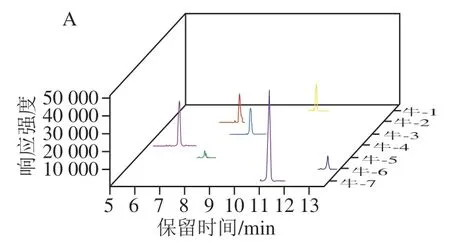
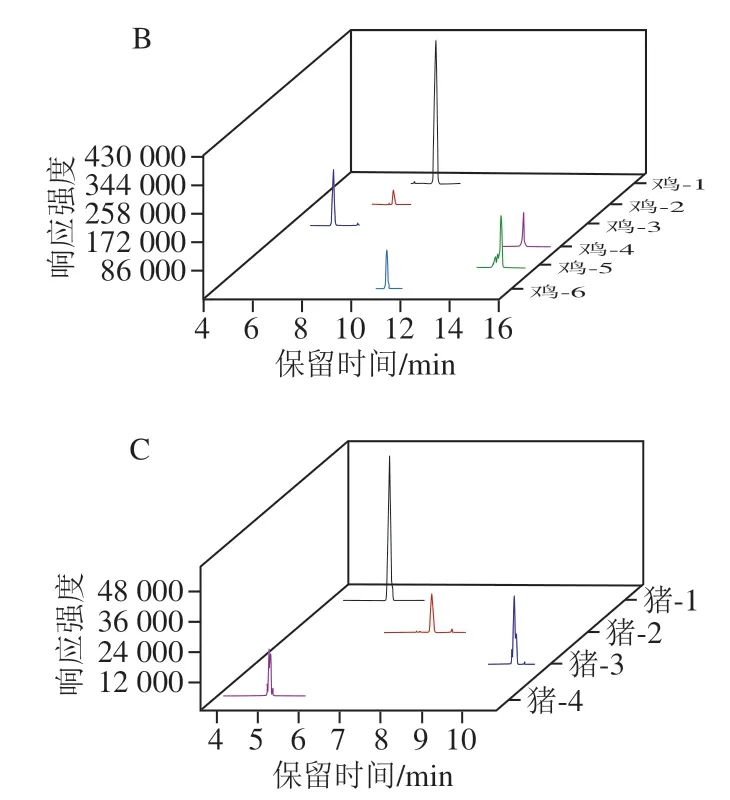
图2 各物种的提取离子色谱图Fig. 2 Extracted ion chromatograms of peptides derived from different animal species
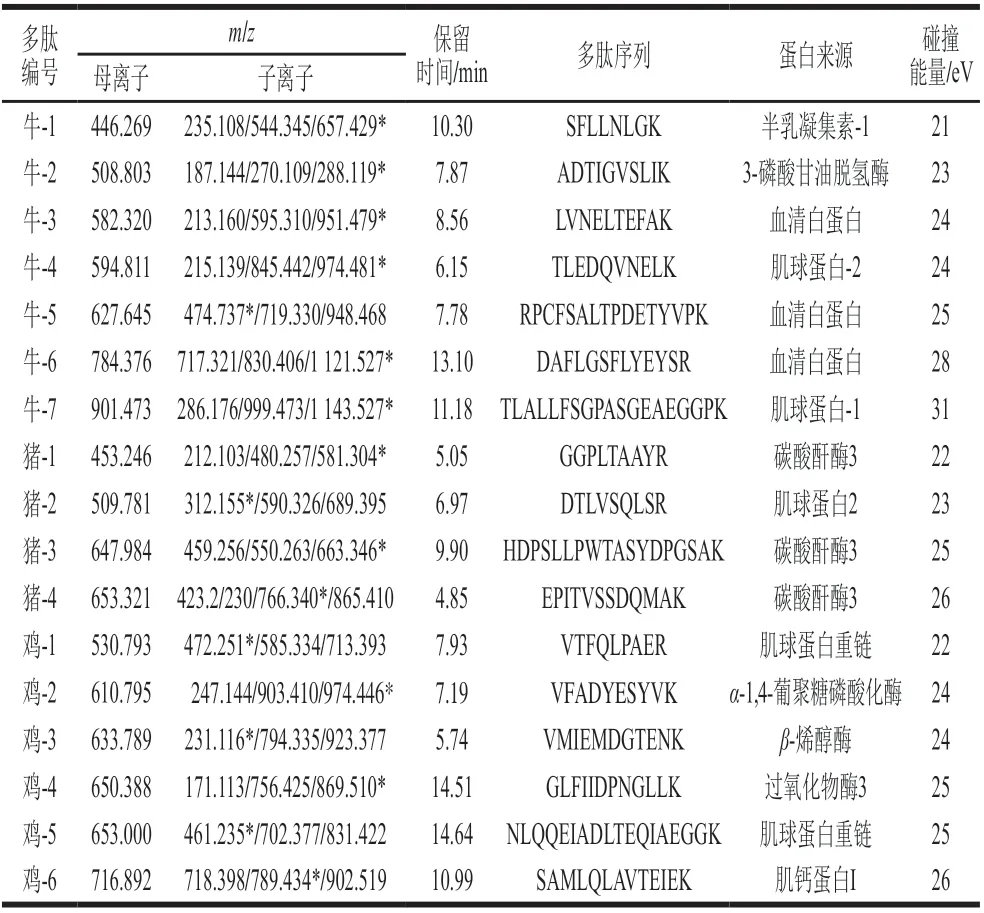
表2 牛、猪、鸡的多肽信息及MRM采集参数Table 2 Information and MRM parameters of peptides derived from beef, pork and chicken
1.4 数据处理
相对定量分析法是将不同物种的特异性多肽峰面积的比值进行数据处理,通过多肽峰面积比值(y)和肉含量比值(x)构建标准曲线。以牛-猪体系为例,猪/牛质量比值为横坐标,以猪/牛多肽选择离子峰面积比值为纵坐标,构建标准曲线,将待测样本峰面积比值带入标准曲线进行计算,从而得出牛肉与猪肉的相对含量并计算回收率,每个样品平行分析测定3 次,数据均以平均值计算。
2 结果与分析
2.1 标准曲线的选择
本研究构建了两种方式的标准曲线,分别为标准曲线1和标准曲线2,以牛-猪体系为例,具体过程如下:
标准曲线1:按照1.3.2节前处理方法,离心后,将提取的纯猪肉上清液(30、80、100、120、170 μL)分别和纯牛肉上清液(170、120、100、80、30 μL)进行不同比例的混合,即猪肉与牛肉质量比约为0.176、0.667、1.000、1.500、5.667,制作标准曲线,质量浓度范围可根据实际情况进行调整。
标准曲线2:按照1.3.2节前处理方法,经0.22 μm滤膜后,将提取的纯猪肉待测多肽溶液分别和牛肉提取待测溶液进行不同比例的混合,确保猪肉与牛肉质量比约为0.176、0.667、1.000、1.500、5.667,制作标准曲线,质量浓度范围可根据实际情况进行调整。
其筛选需要满足两方面的特征,一方面是构建的标准曲线线性关系不应低于0.99,另一方面是满足构建方法所需的回收率。以牛-猪体系为例,通过对猪/牛体系多肽回收率结果的考察,经分析发现标准曲线1和标准曲线2无明显差别,但由于标准曲线1的前处理过程与待测样品一致,且该前处理过程可以避免实验操作、基质干扰等因素引起的影响,因此,采用标准曲线1更符合实际过程。
2.2 生肉模拟混合体系测定结果
本研究的工作流程见图1。按照1.3.1节生肉模拟混合体系制备过程,纯物种(牛、猪、鸡)样品经蛋白提取、酶解、净化后得到多肽,通过LC-MS/MS获得各个多肽所对应的峰面积,各物种多肽详细信息见表2。将牛的各条多肽分别与猪、鸡的多肽进行两两组合,以多肽峰面积比值作为纵坐标,肉含量比值作为横坐标,绘制标准曲线并计算回收率,以线性相关系数和回收率作为定量多肽的筛选依据,从而筛选出各物种的定量多肽。
基于对牛与猪、鸡的多肽分别进行两两比较的考察,研究其测定值与真实值的回收率结果,纯牛肉分别和猪肉进行10%、50%、80%比例混合的平均回收率结果见图3,结果发现,混合比例50%和80%的回收率结果集中分布于60%~120%,而混合比例10%的回收率结果变化幅度较大,可能是低含量比例更易受到基质影响。由图3可知,不同混合比例对相对定量结果具有不同程度影响,其中,中、高混合比例的结果明显高于低混合比例;纯牛肉分别和鸡肉进行10%、50%、80%比例混合的平均回收率结果见图4。结果发现,混合比例50%和80%的回收率结果变化幅度较小,其回收率结果也相对集中分布于60%~120%,混合比例10%的回收率结果同样变化幅度较大。由图4可知,不同混合比例对相对定量结果是有差异影响的,其中,中、高混合比例的结果同样明显高于低混合比例。
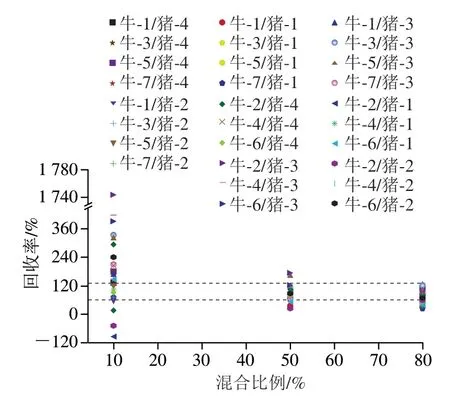
图3 牛肉与猪肉不同混合比例的平均回收率结果Fig. 3 Average recoveries of beef and pork mixtures in different proportions
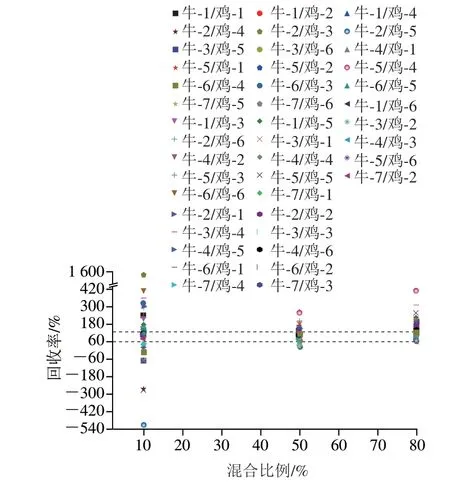
图4 牛肉与鸡肉不同混合比例的平均回收率结果Fig. 4 Average recoveries of beef and chicken mixtures in different proportions
总体而言,通过对牛与猪、鸡的多肽分别进行两两比较的考察,中、高混合比例的相对定量多肽的回收率均相对集中于60%~130%,但针对于以上牛、猪和鸡的多肽,还需进一步验证适合于牛肉制品中的物种特异性定量多肽。
2.3 肉制品模拟混合体系测定结果
为验证方法的准确性和抗干扰性,即真实值与测定值之间的差异。按照1.3.1节肉制品模拟混合体系制备过程,通过自制含有牛肉-猪肉、牛肉-鸡肉的混合肉样,使用构建的方法体系测定混合肉样中牛肉分别与猪肉、鸡肉的相对含量,从而检测该方法的准确度及灵敏度,并验证适合用于肉制品中的特异性定量多肽。
通过考察该方法的线性关系及回收率结果,对自制含有牛肉-猪肉、牛肉-鸡肉的肉制品模拟混合肉样进行验证,依据所呈现的线性关系及回收率,共筛选出相对较好的定量多肽分别为猪-4/牛-1、猪-1/牛-1、猪-3/牛-1及鸡-6/牛-1、鸡-5/牛-4、鸡-4/牛-1、鸡-5/牛-1,定量分析筛选的离子对信息及线性关系如表3所示,所选择的定量多肽均呈良好的线性关系,且线性相关系数达0.99以上。肉制品模拟混合肉样中猪/牛含量测定结果如表4所示,回收率均集中于76.1%~127.3%;肉制品模拟混合肉样中鸡/牛含量测定结果如表5所示,其回收率也均集中于75.0%~115.8%。

表3 定量分析选择的离子对信息以及线性关系Table 3 Ion-pair information for quantitative analysis and linear relationships
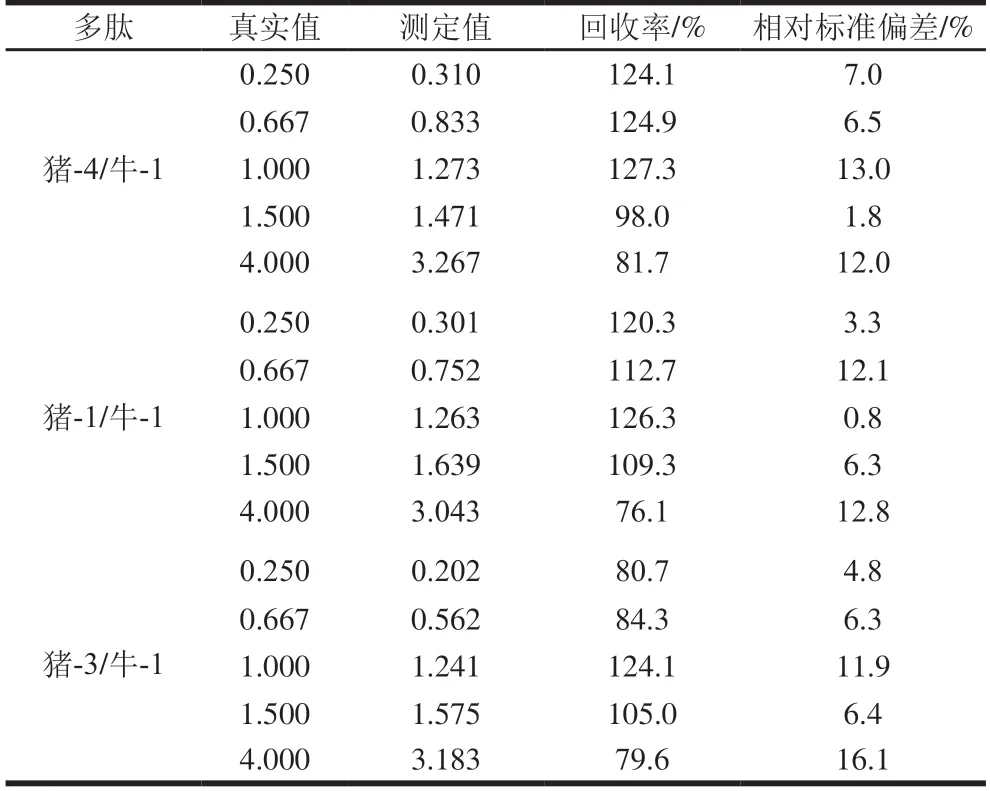
表4 混合肉样中猪/牛含量测定结果(n=3)Table 4 Percentages of pig/bovine in meat mixtures (n = 3)
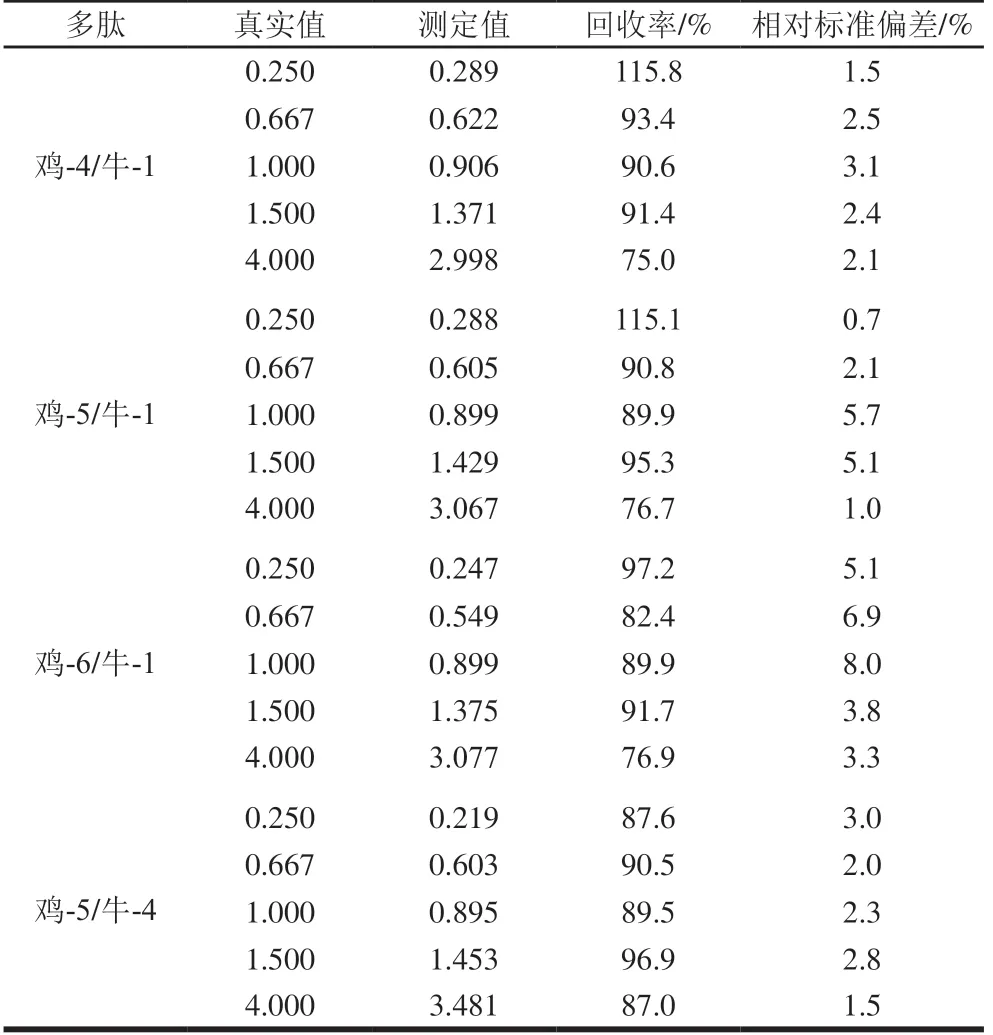
表5 混合肉样中鸡/牛含量测定结果(n=3)Table 5 Comparison of real and measured percentages of chicken and beef in meat mixtures (n = 3)
按照1.3.2节前处理方法,将牛肉、猪肉和鸡肉按照不同的比例添加混合,考察该方法的灵敏度,最低可以分别检测0.5%比例的牛肉、猪肉和鸡肉掺假,灵敏度较高。如图5所示,该方法的灵敏度可满足食品掺假检测要求。
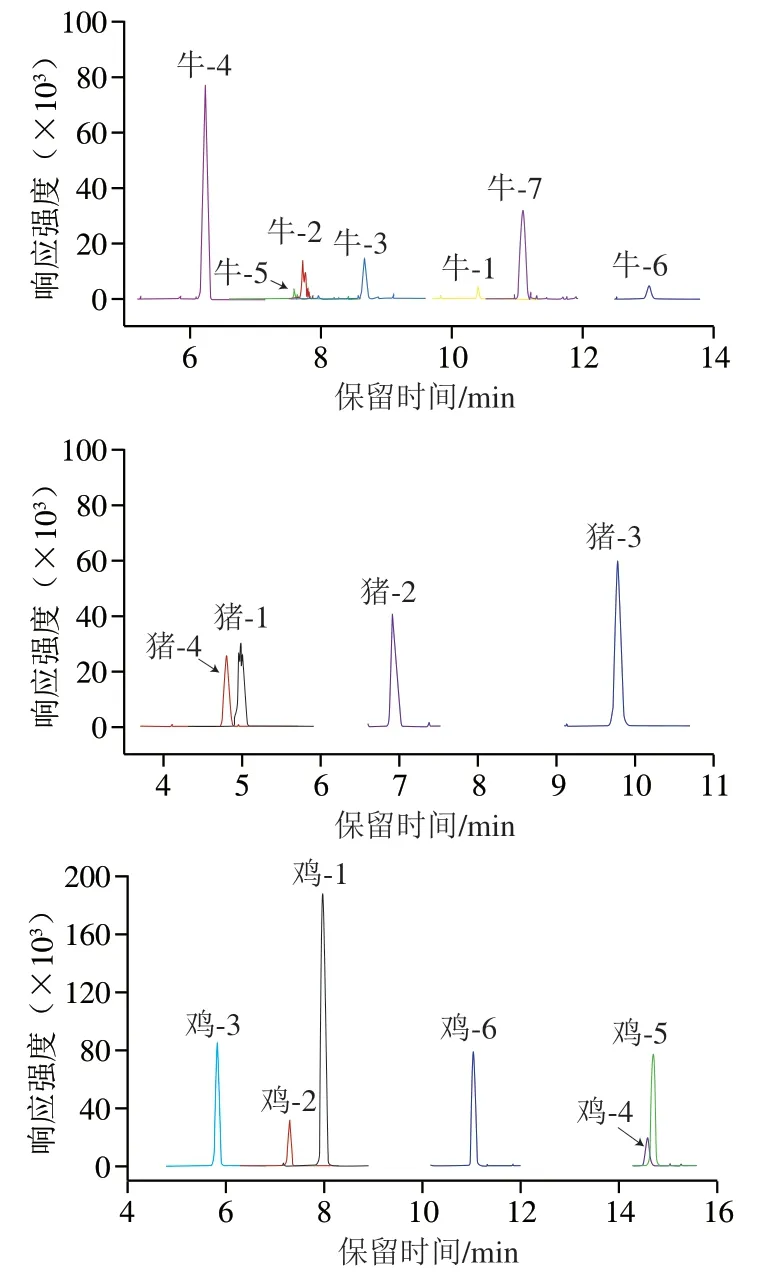
图5 物种掺假量为0.5%时各物种特异性多肽离子流图Fig. 5 Extracted ion chromatograms of species-specific peptides with 0.5% adulteration
基于以上结果分析,总体来看,该方法测定结果与真实值较为接近,因此利用所筛选的定量多肽,通过线性拟合的方式,可以计算出样品中牛肉与猪肉、鸡肉的相对含量。本研究结果发现,多肽猪-4/牛-1、猪-1/牛-1、猪-3/牛-1及鸡-6/牛-1、鸡-5/牛-4、鸡-4/牛-1、鸡-5/牛-1得到的测定结果相对较好,且稳定性强,其中,多肽猪-4、猪-1、猪-3和鸡-6均与牛-1得到的测定值与真实值较为接近,说明多肽牛-1受物种、加工工艺等干扰因素较小,相对较稳定。
2.4 实际样品测定结果
将本研究方法应用至实际样品的测定,主要采购了含有牛肉成分且不同品牌的商品化肉制品进行样品分析,如牛肉丸、牛肉比萨粒和小牛肠。利用本方法对样品进行检测,结果显示,样品1标签为牛肉丸,检测出猪肉的专属性多肽,未检测出牛肉成分,可判定该样品为掺假商品;样品3、5、9标签标示均无鸡源成分,但检测出鸡肉的专属性多肽,可判定该商品中均掺入了鸡肉;样品6标签为牛肉丸,未检测出牛源成分,但检测出鸡肉的专属性多肽,可判定该样品为掺假商品;而其他样品未检测出其配料表之外的其他成分。其中样品4的标签标示相对详细,牛肉和猪肉≥50%,牛肉≥30%,通过该方法构建的线性测定猪肉/牛肉平均相对含量约为0.454;从样品2结果可以看出,测定物种成分与标签标示一致,且可以明显发现鸡肉含量高于猪肉(表6),以上结果说明该方法能够快速且高效地鉴别牛肉制品中的牛源、猪源和鸡源成分及含肉量。
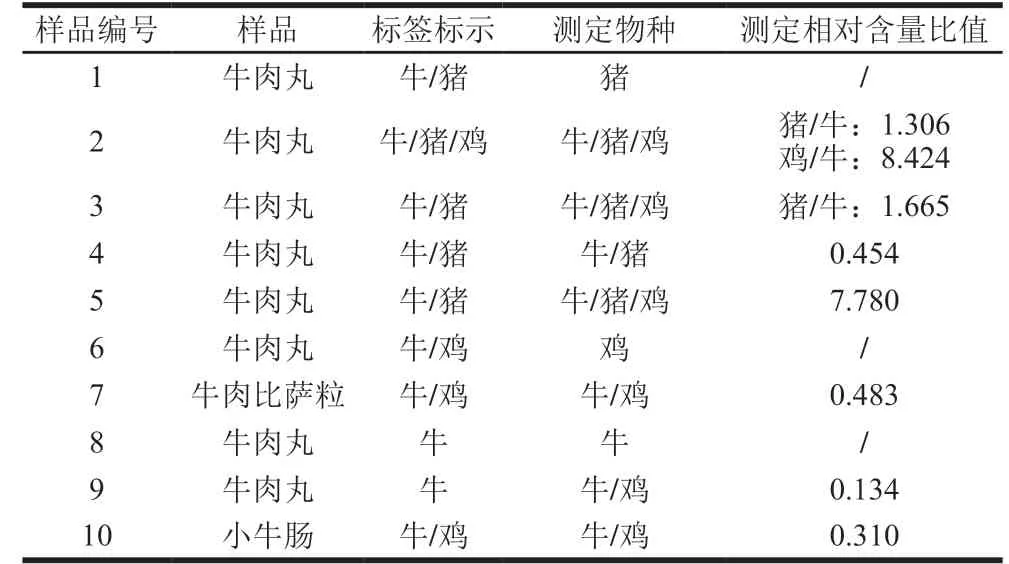
表6 市售样品的测定结果(n=3)Table 6 Results of detection of commercial samples (n = 3)
3 结 论
本研究构建了基于LC-MS/MS对牛肉制品中牛肉与猪肉、鸡肉的相对定量分析方法,为快速且高效鉴定牛肉制品中的牛源、猪源和鸡源成分及含肉量的测定提供了有效途径。本研究筛选出猪/牛的定量多肽为猪-4/牛-1、猪-1/牛-1、猪-3/牛-1,鸡/牛的定量多肽为鸡-6/牛-1、鸡-5/牛-4、鸡-4/牛-1、鸡-5/牛-1,其中多肽牛-1相对较稳定,可与猪、鸡两物种同时进行相对含量计算,且构建的定量多肽线性关系良好,均达0.99以上,最低可以分别检测0.5%比例的牛肉、猪肉和鸡肉掺假。本研究所构建的相对定量分析方法可快速、高效地获得牛肉制品中牛肉与猪肉、鸡肉的相对含量,具有较高的可行性,对于肉制品中真伪鉴别及其含肉量成分的测定具有一定的实际意义,同时也为其他物种混合肉制品提供参考依据。
