有机磷农药适配体-磁分离荧光检测方法的建立及应用
2022-03-05胡超琼王力均陈祥贵黄玉坤
胡超琼,王力均,2,陶 璇,3,朱 云,梁 煜,杨 潇,陈祥贵,2,黄玉坤,2,*
(1.西华大学食品与生物工程学院,四川 成都 610039;2.宜宾西华大学研究院,食品非热加工重点实验室, 食品非热加工工程技术研究中心,四川 宜宾 644004;3.成都倍特药业股份有限公司,四川 成都 610041)
有机磷农药多为磷酸酯类和硫代磷酸酯类化合物[1], 具有高效、广谱、易降解、易氧化、品种多、用途多样、害虫对其抗性发展缓慢等特点,在农业生产上得以广泛使用。虽然有机磷农药易分解,但在某些环境下,也存在较长的残存周期,且多次小剂量接触,会在生物体内发生蓄积,从而产生一系列神经中毒症状[2]。2007年我国已禁止甲胺磷、对硫磷、甲基对硫磷、久效磷、磷胺5种高毒有机磷农药在国内的生产、销售及农业上使用[3]。 由于人们使用不当、不遵循安全间隔期、环保意识淡薄等,导致有机磷农药在环境和食品中残留超标,对人体健康造成威胁。我国国家标准[4]规定了甲拌磷、氧化乐果、丙溴磷在柑橘类水果中的最大残留限量分别为0.01、0.02、0.2 mg/kg。
目前,有机磷农药的检测方法多为传统仪器检测法,包括高效液相色谱法[5]、气相色谱法[6]、高效液相色谱-串联质谱法[7]、气相色谱-串联质谱法[8]、超高效液相色谱-串联质谱法[9]等。传统仪器检测法精确度高、灵敏度高、检测范围广,但是存在操作过程繁杂、耗时、对仪器及工作人员要求较高等缺点,不适用于快速检测大量样品。还有一些快速检测方法,如酶抑制法[10]、酶联免疫吸附法[11]、生物传感器法[12]等,但这些快速检测方法的灵敏度有限、体系稳定性有待增强,且对甲拌磷、氧化乐果、丙溴磷等有机磷农药敏感性较差,应用范围较窄。因此,建立高效、快速同时多种有机磷农药残留检测方法对于食品安全具有重要意义。
核酸适配体是单链的DNA或RNA,由数十个碱基构成,通过卷曲折叠形成复杂的三维结构,具有类似于抗体的性质,能识别特定的分子,因此也被称为“化学抗体”[13]。适配体具有特异性好、能够体外合成、成本低、易修饰、可重复利用等特点[14],在农药检测领域已有所涉及。刘媛媛等[15]在信号转导元件纳米金粒子表面修饰有机磷适配体,构建出用于检测中药材中甲拌磷、氧化乐果、丙溴磷、水胺硫磷4种有机磷农药的适配体传感器,当4种有机磷残留总量超过1 000 μg/L时,溶液体系产生肉眼可识别的颜色变化。陆婷婷等[16]基于利用核酸适配体调控荧光碳量子点荧光强度的原理构建了一种适配体荧光传感器用于检测农产品中的乐果。
纳米磁珠是目前结合适配体构建传感器的重要材料之一,具有低毒性、磁性好、易修饰等优点,在表面修饰聚吡咯材料具有更好的吸附能力[17]、催化性[18]及光感性能[19]等。Zhu Wanying等[20]在磁珠表面包覆聚吡咯(Fe3O4@PPy NPs)合成了核壳结构,利用其磁分离性能及对荧光猝灭能力构建传感器检测腺苷,该方法在0.5~500 nmol/L具有良好的线性关系,检出限达0.15 nmol/L。因此,本实验基于AptS4-29,在适配体5′端修饰荧光基团,采用溶剂热法合成磁珠,并包裹聚吡咯形成纳米材料,建立磁分离辅助荧光分析法检测砂糖橘中甲拌磷、氧化乐果、丙溴磷3种有机磷农药,旨在为食用农产品中有机磷农药的快速筛查提供技术支持。
1 材料与方法
1.1 材料与试剂
六水合氯化铁(FeCl3·6H2O,分析纯) 上海源叶生物有限公司;聚(4-苯乙烯磺酸-共聚-马来酸)钠盐(poly(4-styrenesulfonic acid-co-maleic acid) sodium salt,PSSMA,生化级) 成都化夏化学试剂有限公司;戊二醛(分析纯) 上海麦克林公司;聚吡咯(99%,色谱纯)、敌瘟磷标准品(≥97.0%)、异稻瘟净标准品(≥99.5%)(均为分析纯) 阿拉丁试剂(上海)有限公司;无水醋酸钠(NaAc,分析纯)、过硫酸铵 (分析纯) 成都市科隆化学品有限公司;乙二醇(分析纯) 国药集团化学试剂有限公司;马拉硫磷标准 品(≥98.0%)、甲拌磷标准品、丙溴磷标准品(均为分析纯) 美国Sigma公司;氧化乐果标准品(96.6%,分析纯) 德国Ehrenstorfer公司;灭多威标准品、抗蚜威标准品、克百威标准品(均为分析纯) 沈阳国家农药产品质量检测中心。
6-羧基荧光素标记适配体S4-29 (6-carboxyfluorescein-labeled aptamer S4-29,FAM-AptS4-29)由生工生物工程(上海)股份有限公司合成,碱基序列为:5′-6-FAM- AAGCTTTTTTGACTGCAGGTGAAAAAGAG-3′(来自本课题组的前期研究)。
1.2 仪器与设备
集热式恒温加热磁力搅拌器 郑州长城科工贸有限公司;UV2800紫外-可见分光光度计 上海天美天平仪器有限公司;真空干燥箱 上海博讯实业有限公司;spectraMax i3x多功能酶标仪 美国Molecular Devices 公司;Fluoromax-4荧光光谱仪 美国HORIBA集团 公司;透射电子显微镜 日本JE-OL公司;傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 德国布鲁克公司。
1.3 方法
1.3.1 Fe3O4纳米粒子(nanoparticles,NPs)的合成
采用溶剂热法制备纳米磁珠Fe3O4,参考Dong Yixiao等[21]的方法。向100 mL圆底烧瓶中依次加入40 mL乙二醇、1.08 g FeCl3·6H2O、3.0 g NaAc和1.0 g PSSMA。将烧瓶置于50 ℃搅拌均匀,加入0.6 g NaOH继续搅拌至溶液变成暗黑透明状。将溶液转移到干燥的聚四氟乙烯反应釜中,190 ℃加热9 h后自然冷却至室温。将产物转移至烧杯中,弃去上层液体,用乙醇-水(1∶1,V/V)溶液和去离子水交替清洗固体产物3 次,50 ℃真空干燥过夜。固体颗粒研磨后于室温封闭保存。
1.3.2 Fe3O4@PPy NPs合成
参考Zhu Wanying等[20]的方法制备Fe3O4@PPy NPs。将20 mg Fe3O4NPs分散于12 mL水中,接着加入30 μL吡咯搅拌30 min。加入3 mL 0.14 mol/L过硫酸铵溶液混合均匀后,4 ℃孵育4 h。用外加磁场分离获得Fe3O4@PPy NPs,按乙醇、去离子水的顺序清洗,50 ℃真空干燥,固体颗粒研磨后室温封闭保存。
1.3.3 磁分离辅助荧光分析法的建立
将50 μL 0.2 mg/mL Fe3O4@PPy NPs加入至50 μL 100 nmol/L的FAM-AptS4-29溶液中,室温孵育20 min,使荧光猝灭,3 次洗涤后磁分离去除游离适配体,将FAM-AptS4-29与Fe3O4@PPy NPs复合物复溶于结合缓冲液(50 mmol/L Tris、50 mmol/L NaCl、10 mmol/L KCl、10 mmol/L MgCl2,pH 8.0)中。加入50 μL浓度为0.001、0.01、0.1、1、10、100 nmol/L的丙溴磷、甲拌磷、氧化乐果,室温振荡孵育120 min。最后,通过磁分离得到上清液。通过计算相对荧光强度((F2-F1)/F1)评估输出信号,其中F2和F1分别表示在有和无靶标磁分离后所测定的荧光强度。用酶标仪在激发波长485 nm,发射波长535 nm条件下测定荧光强度。
1.3.4 磁分离辅助荧光分析法的选择性评价
选择6种常见的农药作为干扰物质,其中包括3种有机磷农药(马拉硫磷、敌瘟磷、异稻瘟净)和3种氨基甲酸酯类农药(灭多威、抗蚜威、克百威),浓度均为1 nmol/L。采用上述检测方法进行选择性评价分析。
1.3.5 样品回收率和精密度实验
将去皮后的砂糖橘样品在匀浆机中高速匀浆2 min,准确量取5 g于离心管中,加入10 mL丙酮混匀后振荡30 min,10 000 r/min离心10 min,保留上清液并定容至15 mL,混匀后,采用0.45 μm滤头过滤,滤液作为待测样品溶液。同时,将不同浓度的丙溴磷、甲拌磷、氧化乐果标准溶液分别添加到5 mL匀浆中,采用上述前处理步骤制成样品液。对每个样品进行3个不同水平添加,每个水平重复3 次进行回收实验,并计算回收率,采用相对标准偏差考察精密度。
1.4 数据统计与图表绘制
采用Origin 2019软件进行数据统计及作图,每组实验重复测定3 次,数据取平均值。
2 结果与分析
2.1 磁分离辅助荧光分析法的设计原理
采用溶剂热法合成纳米磁珠Fe3O4,再以PPy和过硫酸铵对制备的Fe3O4纳米磁珠进行表面修饰后得到PPy包覆的核壳型Fe3O4@PPy NPs。原理如图1所示,将 Fe3O4@PPy NPs与FAM-AptS4-29孵育,适配体与Fe3O4@PPy NPs通过π-π堆积作用吸附至Fe3O4@PPy NPs表面[22],FAM荧光被猝灭,通过磁分离过程去除游离适配体,此时荧光强度最低。加入有机磷农药之后,Fe3O4@PPy NPs表面的适配体优先与有机磷农药结合,并被触发打开结构,形成有机磷农药-适配体复合物,抑制PPy吸附适配体。这种作用使Fe3O4@PPy NPs释放FAM-AptS4-29, FAM-AptS4-29的荧光强度得到恢复。
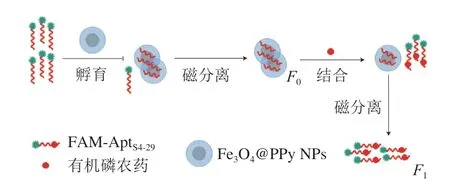
图1 磁分离辅助荧光分析法原理示意图Fig. 1 Schematic illustration of magnetic separation assisted fluorescence analysis
2.2 Fe3O4@PPy NPs的表征
2.2.1 FTIR表征
由图2可知,577 cm-1处为铁氧键(Fe—O)的振动吸收峰[23]。在Fe3O4@PPy NPs的FTIR中,1 557 cm-1为吡咯环的拉伸振动峰[24],1 189、1 046 cm-1和928 cm-1处的其他峰是由面内和面外的C—H和N—H弯曲振动引起[25]。所有这些峰都表明PPy在Fe3O4@PPy NPs中的存在。磁珠表面包裹聚吡咯后,铁氧键(Fe—O)的振动吸收峰发生偏移,从577 cm-1变为621 cm-1,也证实了Fe3O4NPs的存在以及Fe3O4NPs与PPy的强烈结合,而不是2种组分的混合,进一步表明了在Fe3O4NPs表面成功包被PPy,成功制备出了核壳型Fe3O4@PPy NPs。
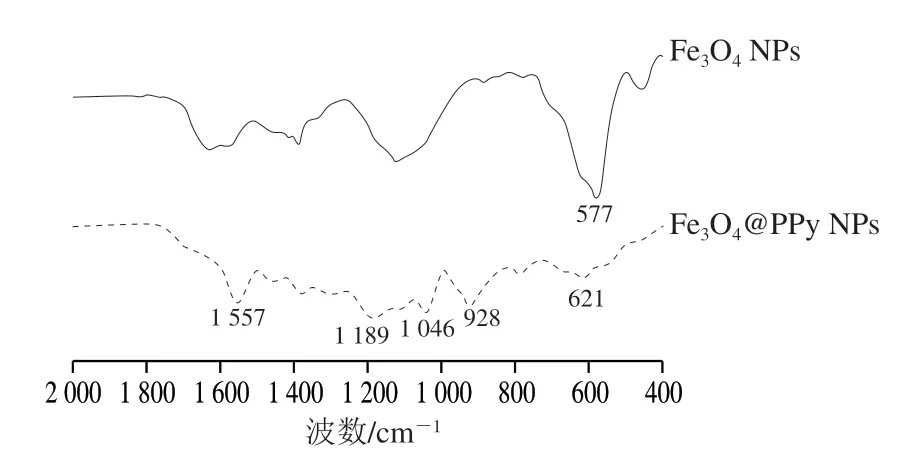
图2 Fe3O4@PPy NPs的FTIR图Fig. 2 FTIR spectrum of Fe3O4@PPy NPs
2.2.2 透射电镜表征
采用透射电子显微镜对制备的Fe3O4@PPy NPs的形貌进行了表征。由图3可知,Fe3O4@PPy NPs的粒径约为100 nm以内,形状类似球形,且具有明显的核壳结构。说明纳米磁珠表面成功包被聚吡咯,Fe3O4@PPy NPs制备成功。

图3 Fe3O4@PPy NPs的透射电镜图Fig. 3 Transmission electron microscopic images of Fe3O4@PPy NPs
2.2.3 分散性及磁性能表征
由图4可知,Fe3O4@PPy NPs在水中能够均一稳定地分散,当有外加磁场存在时,Fe3O4@PPy NPs能够快速响应并向磁铁方向聚集,表明Fe3O4NPs表面包覆聚吡咯后依然保持较强的磁性能。

图4 Fe3O4@PPy NPs在去离子水中的分散稳定性(A)和 与在外加磁场下的磁响应(B)直观图Fig. 4 Dispersion stability of Fe3O4@PPy NPs in deionized water (A) and magnetic response to applied magnetic field (B)
2.2.4 紫外-可见吸收光谱表征
FAM在485 nm波长处受到激发后在535 nm左右具有最高的荧光发射强度。从图5可以看出,Fe3O4@PPy NPs在该波长扫描范围内都具有光吸收特性,能够与FAM基团发生荧光共振能量转移,进而引起荧光猝灭。因此,Fe3O4@PPy NPs可用作本实验的荧光猝灭分子。

图5 Fe3O4@PPy NPs的紫外-可见吸收光谱图Fig. 5 UV-visible spectrum of Fe3O4@PPy NPs
2.3 磁分离辅助荧光分析法条件优化
2.3.1 Fe3O4@PPy NPs合成质量比的优化
由于PPy与FAM-AptS4-29相互作用强,荧光猝灭能力强,稳定性及水溶性好,磁选方便,因此选择Fe3O4@PPy NPs作为猝灭剂。PPy具有一定的吸附作用,含量过多会导致靶标加入后荧光强度不易恢复。因此,Fe3O4NPs与PPy在合成时的质量比在荧光猝灭与恢复过程中有重要影响,需要优化Fe3O4@PPy NPs合成时的质量比。Fe3O4NPs和PPy质量比分别为1∶0.5、1∶1、1∶1.5、1∶2、1∶2.5,优化结果如图6B所示,当PPy质量占比增大时,相对荧光强度先增大后减小,且甲拌磷、氧化乐果、丙溴磷3 组之间的变化趋势无显著差异。由图6B可知,Fe3O4@PPy NPs在不同合成比时,均具有较好的猝灭效果。因此,当相对荧光强度((F2-F1)/F1)达到最大值时,选择Fe3O4NPs和PPy的最佳质量比1∶1.5。
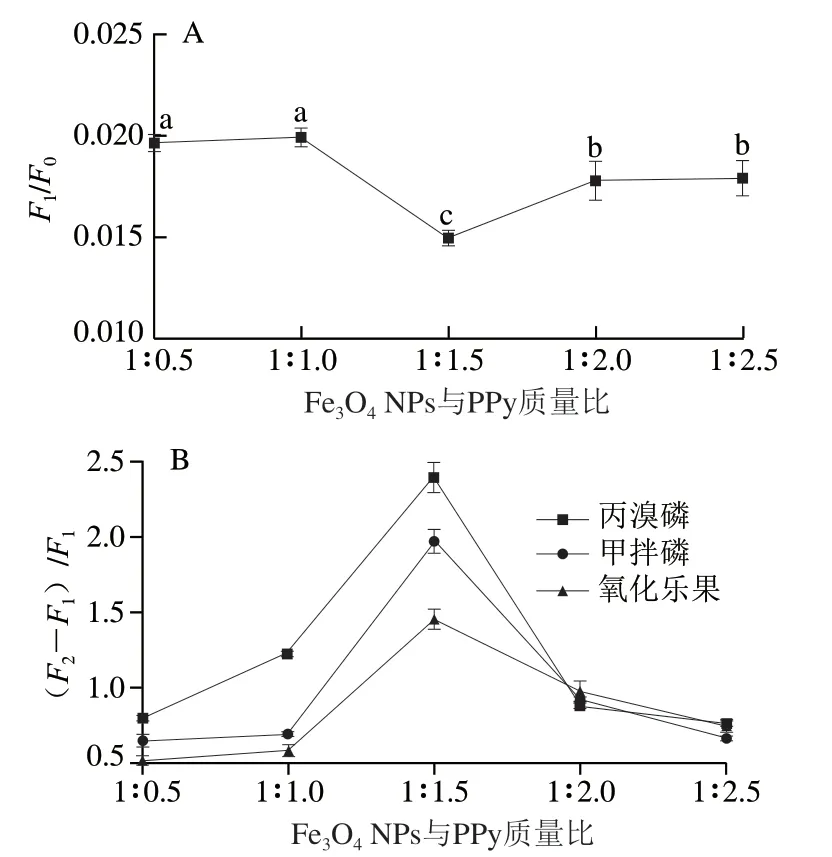
图6 Fe3O4 NPs与PPy质量比对荧光猝灭信号(A)和 荧光信号(B)的影响Fig. 6 Effect of Fe3O4 NPs/PPy mass ratio on fluorescence quenching signal (A) and fluorescence signal (B)
2.3.2 猝灭剂Fe3O4@PPy NPs浓度的优化
Fe3O4@PPy NPs不仅作为荧光FAM基团的猝灭剂,而且还具有磁分离作用,2 次磁分离有效降低了背景荧光的干扰,提高了检测体系的灵敏度。采用优化条件相同的荧光生物探针的浓度,控制不同Fe3O4@PPy NPs质量浓度,测定猝灭前后的荧光强度F0与F1。由图7可知,随着Fe3O4@PPy NPs质量浓度不断增大,荧光猝灭现象越明显。当质量浓度增大至0.2 mg/mL后,荧光猝灭现象变化不明显,说明荧光猝灭效率已经达到较高水平,所以实验选择0.2 mg/mL作为Fe3O4@PPy NPs的最佳质量浓度。
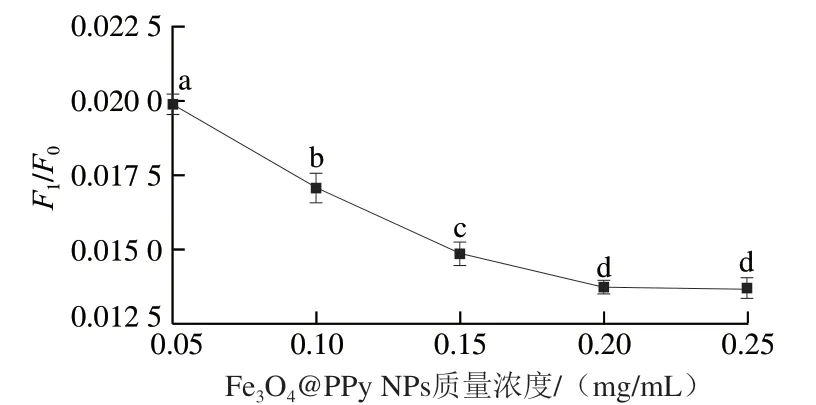
图7 Fe3O4@PPy NPs质量浓度对荧光信号的影响Fig. 7 Effect of Fe3O4@PPy NPs concentration on fluorescence signal
2.3.3 加入靶标后孵育时间的优化
为考察孵育时间对荧光信号的影响,调整孵育时间为30、60、90、120、150、180 min。每组平行测定3 次。如图8所示,甲拌磷和氧化乐果在90~150 min范围内,荧光信号随孵育时间的延长显著增强,丙溴磷的荧光信号在第90分钟最强,随后减弱。因此,为保证3种靶标物质的反应液的荧光信号都维持在较高水平,选择孵育时间为120 min。
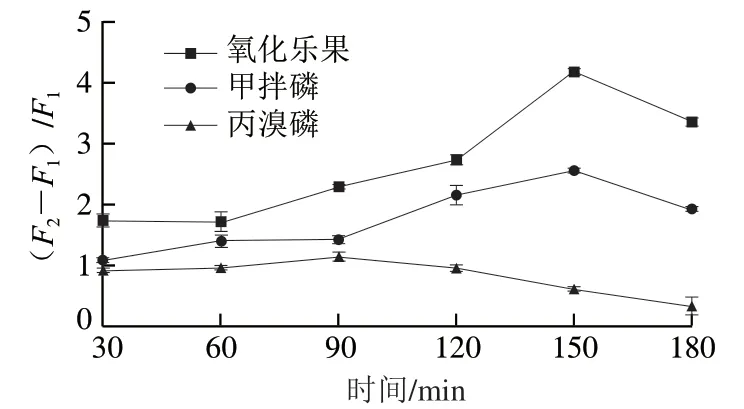
图8 孵育时间对荧光信号的影响Fig. 8 Effect of incubation time on fluorescence signal
2.4 磁分离辅助荧光分析法的标准曲线
甲拌磷、氧化乐果、丙溴磷的浓度与(F2-F1)/F1在1.00×10-4~1.00×102μg/kg范围内呈良好的线性关系,线性回归方程分别为y=0.076 34x+0.399 24,y=0.043 91x+0.390 27,y=0.050 02x+0.298 98,相关系数R2分别为0.994 4、0.988 8和0.981 8;检出限分别为4.17×10-4、2.77×10-4、4.67×10-4μg/kg(RSN=3)。如表1所示,与现有7种有机磷农药的检测方法相比较,本实验具有较宽的线性范围及较高的灵敏度,表明该检测方法具有优越性。
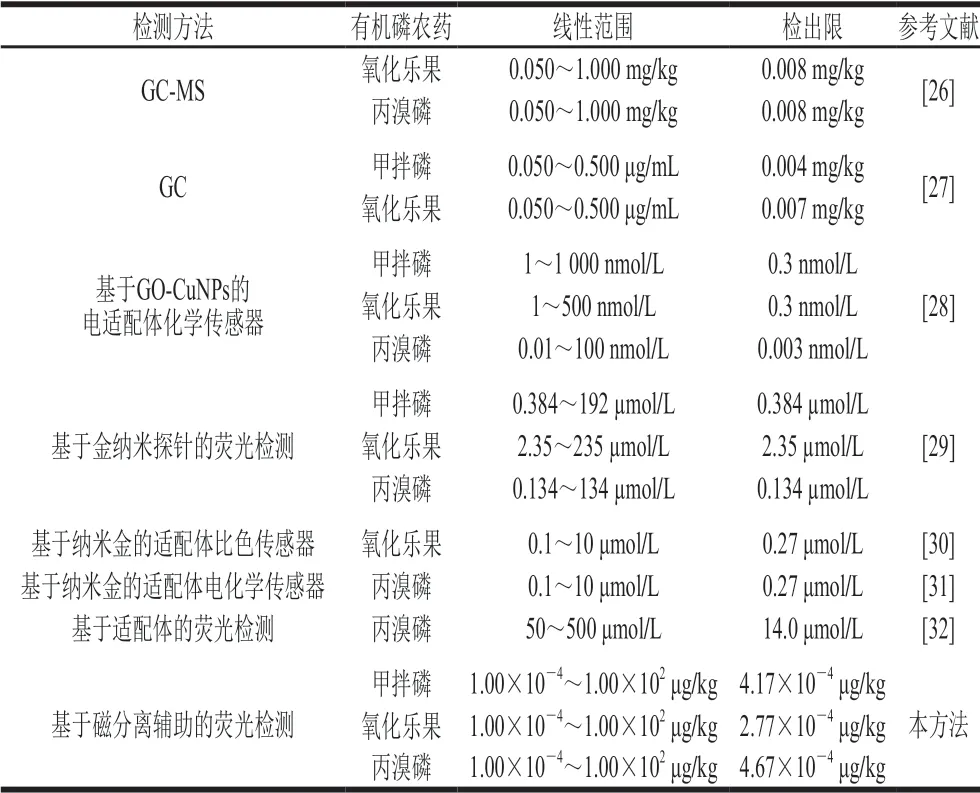
表1 有机磷农药检测方法的比较Table 1 Comparison of different detection methods for OPPs
2.5 选择性分析
由图9可知,该检测方法与其他3种有机磷农药和3种氨基甲酸酯类农药之间差异显著(P<0.05),无明显交叉反应,表明该方法选择性强。
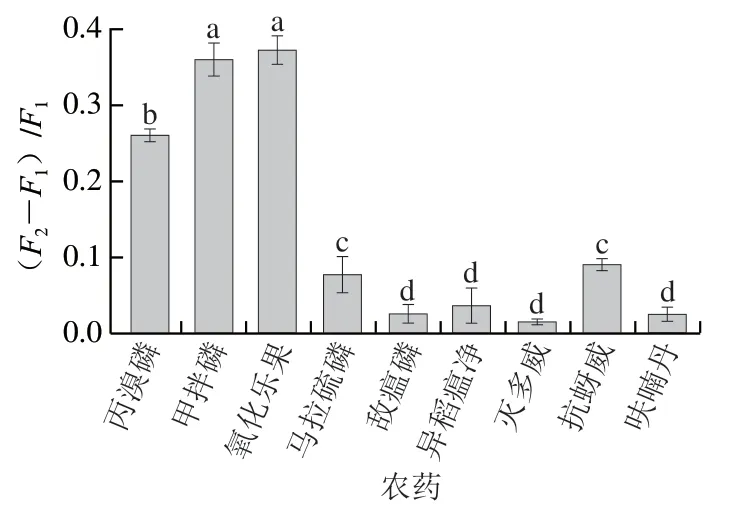
图9 磁分离辅助荧光分析法的选择性评价Fig. 9 Selectivity evaluation of magnetic separation assisted fluorescence analysis
2.6 样品回收率和精密度实验结果
通过向砂糖橘样品中分别加入甲拌磷、氧化乐果、丙溴磷的标准溶液,使得甲拌磷添加量为2.60×10-3、 0.260、9.113 μg/kg,氧化乐果添加量为2.13×10-3、0.213、14.937 μg/kg,丙溴磷添加量为3.74×10-3、0.374、37.363 μg/kg,采用本实验方法进行检测,平行测定3 次,计算样品的加标回收率。如表2所示,本方法的加标回收率在79.94%~108.00%之间,相对标准偏差在3.05%~7.39%之间,表明该方法具有良好的准确度。
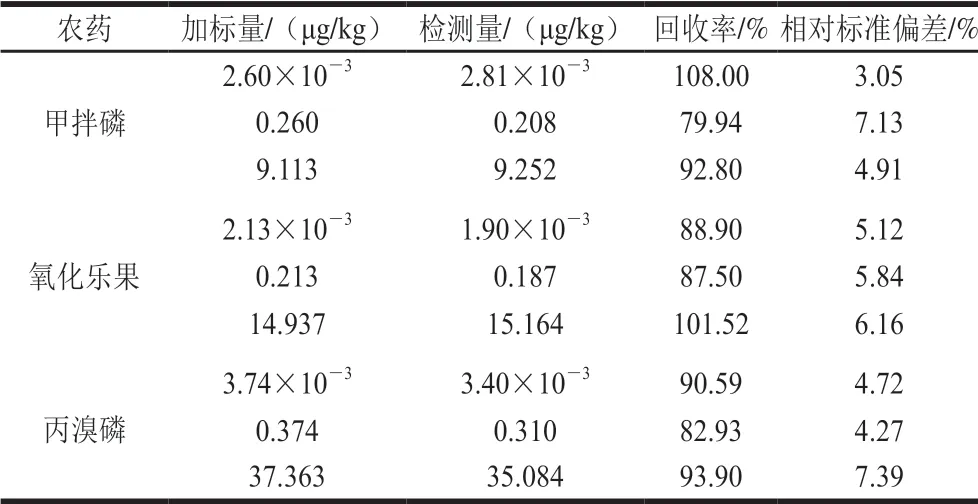
表2 加标回收率(n=3)Table 2 Recoveries of OPPs in spiked samples (n = 3)
3 结 论
本实验建立了甲拌磷、氧化乐果、丙溴磷3种有机磷农药的磁分离辅助荧光分析方法。通过实验优化参数,得到优化实验条件为Fe3O4NPs与PPy质量比1∶1.5、猝灭剂Fe3O4@PPy NPs最佳质量浓度0.2 mg/mL、孵育时间120 min,甲拌磷、氧化乐果、丙溴磷3种农药的检出限分别为4.17×10-4、2.77×10-4、4.67×10-4μg/kg,在1.00×10-4~1.00×102μg/kg范围内具有良好的线性关系,在砂糖橘中的添加回收率在79.94%~108.00%之间,具有较好的灵敏度和精密度。该法采用的适配体是AptS4-29, 在5′端修饰荧光基团FAM,Fe3O4@PPy NPs作为荧光猝灭剂,同时利用其磁性进行了2 次磁分离过程,提高了灵敏度,为食品中有机磷农药分析提供了有效手段。
