工夫红茶加工过程中类胡萝卜素成分的动态变化
2022-03-05李春华唐晓波王小萍
刘 飞,叶 阳,李春华,汪 闵,唐晓波,张 厅,王小萍,王 云,*
(1.四川省农业科学院茶叶研究所,四川 成都 610066;2.中国农业科学院茶叶研究所,浙江 杭州 310008)
香气是茶叶品质评定和影响消费需求的重要评价指标,已有研究表明成品茶中大部分香气物质主要由类胡萝卜素、脂质、糖苷类化合物、氨基酸/碳水化合物等香气前体物质转化而来[1-2],其中由类胡萝卜素类降解产生的香气物质占成品茶香气总量的4.3%~46.5%[3],是茶叶香气的重要组成部分。
类胡萝卜素是一类由植物和某些光合微生物合成的不溶于水的亲脂性次生代谢产物,主要由8个异戊二烯单元形成的C40骨架构成,其聚烯链由共轭双键组成并呈现不同颜色(黄色、橙色和红色),对蓝绿光有较强吸收能力(最大吸收波长400~500 nm)[4-5]。由于其含有3~15个共轭双键而表现出高度不饱和性[6],进而具有较强抗氧化能力表现出细胞膜抗氧化保护剂[7-8]、光吸收和光保护[9]、降低心血管疾病发病率[10-11]、预防和治疗糖尿病[12]、保护视力和抗癌[13-15]、抑制脂肪合成[16]及抗炎健脑[17-18]等生理功效。通常,茶叶中的类胡萝卜素存于叶 绿体和有色体中[19],其含量受品种[20-21]、栽培环境[22]、鲜叶嫩度[23]、采摘季节[24]、加工工艺[25]等因素影响。其中,加工是类胡萝卜素转化形成茶叶香气、叶底和外观色泽的重要因素,而类胡萝卜素双加氧酶参与的酶促氧化[26]和光氧化、自氧化、热裂解等构成的非酶促氧化是茶叶中类胡萝卜素介导的香气形成的主要来源。红茶属于全发酵茶,较长时间的萎凋及后续揉捻、发酵、干燥工序,使茶叶中类胡萝卜素遭受酶促氧化和光氧化、热裂解等反应而发生降解,同时多酚氧化生成的黄烷醌协同催化类胡萝卜素氧化,使得红茶具有更高含量的二氢海葵内酯、茶螺烯酮等香气物质[27-29],进而表现出更加丰富的香气组成和呈味特征。因此,明确红茶加工过程中类胡萝卜素的动态变化,对红茶香气形成以及内在变化机理研究显得尤为重要,但之前的研究多集中在类胡萝卜素形成的香气产物上[30-31],对其本身变化的研究鲜有报道。
鉴于此,本研究采用液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)法分析工夫红茶加工中各工序制品的类胡萝卜素含量,旨在阐明类胡萝卜素在工夫红茶加工过程中的动态变化,以期为红茶香气和色泽形成机理提供数据支持。
1 材料与方法
1.1 材料与试剂
鲜叶于2020年8月购买于文君茶业有限公司邛崃茶场,品种为福鼎大白,鲜叶等级为一芽二叶。
甲醇、乙腈、乙醇(均为色谱纯) 德国Merk公司;甲基叔丁基醚、正己烷(均为色谱纯) 德国CNW科技公司;丙酮(色谱纯) 国药集团化学试剂有限公司;甲酸(色谱纯)、类胡萝卜素标准品(纯度均大于99%) Sigma-Aldrich(上海)贸易有限公司,用甲基叔丁基醚-甲醇(3∶1,V/V)混合溶液进行配制,于-20 ℃保存。
1.2 仪器与设备
6CR-45型茶叶揉捻机 浙江上洋机械股份有限 公司;JY-6CHF-7型红茶发酵机、JY-6CHZ-9B型茶叶烘焙提香机 福建佳友茶叶机械智能科技股份有限公司;QTRAP 6500+型LC-MS/MS仪 美国SCIEX公司;5424R型离心机 德国Eppendorf公司;AS 60/220.R2型电子 天平 波兰Radwag公司;MM400型球磨仪 德国Retsch公司;CentriVap型离心浓缩仪 美国Labconco 公司;MIX-200型多管涡旋振荡器 上海净信实业发展有限公司;KQ5200E型超声清洗仪 昆山舒美超声仪器有限公司。
1.3 方法
1.3.1 样品采集
工夫红茶加工工艺如下所示:
萎凋:将鲜叶(70%~75%)薄摊(2~3 cm)在水筛上,后置于自建萎凋室内,28~30 ℃萎凋至鲜叶含水量58%~60%,共耗时18 h。
揉捻:将20 kg萎凋叶填装到揉捻机中,采用“空-轻-中-重-空”循环加压原则进行揉捻,揉捻转速设置为38 r/min,共耗时1.5 h。
发酵:将揉捻叶摊放到发酵机不锈钢筛中,每筛厚度20~25 cm,发酵参数设置为30 ℃、90%~95%相对湿度,发酵过程每30 min均匀翻拌一次,共耗时4 h。
干燥:将发酵叶薄摊(1~2 cm)至烘焙提香机不锈钢筛中进行热风干燥。干燥分2 次完成,分别为:第1次120 ℃(提前空机升温至该设定温度)烘至茶叶在制品20%~25%含水量,第2次80 ℃(提前空机升温至该设定温度)烘至足干(5%~6%含水量),两次烘焙间冷却回潮至室温。
实验中每道工序结束时取样1 次,每次取样20 g并立即液氮保存。按照加工顺序所取样品分别标记为FL(鲜叶)、WC(萎凋叶)、RL(揉捻叶)、FD(发酵叶)、DA(干燥叶),实验重复3 次,共获得待测样15 份。
1.3.2 样品前处理
将待测样品液氮预处理后真空冷冻干燥,然后研磨仪研磨(30 Hz、1.5 min)至粉末状;称取50 mg茶样粉末,加入适量内标,用正己烷-丙酮-乙醇混合物提取液(1∶1∶2,V/V,含0.01g/mL BTH)进行提取;室温涡旋20 min,重复提取一次后离心,合并上清液;将得到的提取液浓缩后用甲醇-甲基叔丁基醚混合溶液复溶,过0.22 μm滤膜后,保存于棕色进样瓶中,用于LC-MS/MS分析。
1.3.3 检测方法
1.3.3.1 仪器检测条件
色谱条件:进样量2 μL;色谱柱为YMC C30柱(100 mm×2.0 mm,3 μm);流动相:A为甲醇-乙腈(1∶3,V/V)加入0.01% BHT和0.1%甲酸,B为甲基叔丁基醚加入0.01% BHT;流速为0.8 mL/min;柱温为28 ℃;流动相线性梯度洗脱:0~3 min,100% A、0% B; 3~5 min,100%~30% A、0%~70% B;5~9 min,30%~5% A、70%~95% B;9~10 min,5%~100% A、95%~0% B;10~11 min,100% A、0% B。
质谱条件:大气压化学离子源温度350 ℃,气帘气压力25 psi;去簇电压20~100 V;碰撞电压13~75 V进行扫描检测。
1.3.3.2 类胡萝卜素的定性定量
基于标准品构建MWDB(Metware Database)数据库,对质谱检测的数据进行定性分析。利用三重四极杆质谱-多反应监测模式下获得不同样本的质谱分析数据后,对所有目标物的色谱峰进行积分,进而完成定量分析。
标准曲线的制作:配制质量浓度0.01、0.05、0.1、0.5、1、5、10、40 μg/mL的类胡萝卜素标准品溶液,获取各个质量浓度标准品的对应定量信号的质谱峰强度数据;以外标与内标质量浓度比为横坐标,外标与内标峰面积比为纵坐标,绘制不同物质的标准曲线。
将检测到的样本积分峰面积比值代入标准曲线方程进行计算,实际样本中该物质的绝对含量计算公式如下:
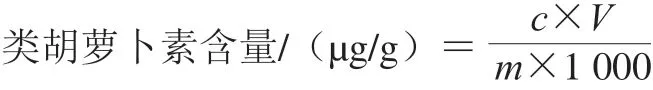
式中:c为样本中积分峰面积比值代入标准曲线得到的质量浓度/(μg/mL);V为复溶时所用溶液的体 积/μL;m为称取的样本质量/g。
1.4 数据统计分析
采用SPSS 20.0软件对数据进行差异显著性分析;采用Excel 2013、KingDraw软件绘制图表。
2 结果与分析
2.1 在制品类胡萝卜素组成
采用LC-MS/MS方法检测工夫红茶各工序茶叶制品中类胡萝卜素组成和绝对含量,发现15 份茶叶样品中共检测出类胡萝卜素24种(其中鲜叶、发酵叶20种,萎凋叶、揉捻叶21种,干燥叶19种),共包含胡萝卜素类3种,即α-胡萝卜素、β-胡萝卜素、八氢番茄红素;叶黄素类10种,包含叶黄素、紫黄质、花药黄质、新黄质、玉米黄质、海胆烯酮、角黄素、α-隐黄质、β-隐黄质、β-阿朴胡萝卜素醛等;类胡萝卜素酯类11种,包含叶黄素酯7种(叶黄素二肉豆蔻酸酯、叶黄素肉豆蔻酸酯、叶黄素月桂酸酯、叶黄素二月桂酸酯、叶黄素棕榈酸酯、叶黄素癸酸酯、叶黄素油酸酯)、玉米黄质酯2种(玉米黄质棕榈酸酯、玉米黄质二肉豆蔻酸酯)、紫黄质酯2种(紫黄质二丁酸酯、紫黄质棕榈酸酯)。检出类胡萝卜素组分绝对定量对应标准曲线见表1,各标准曲线的相关系数均大于0.99,以此为基础测定的各工序茶叶类胡萝卜素绝对含量见表2。
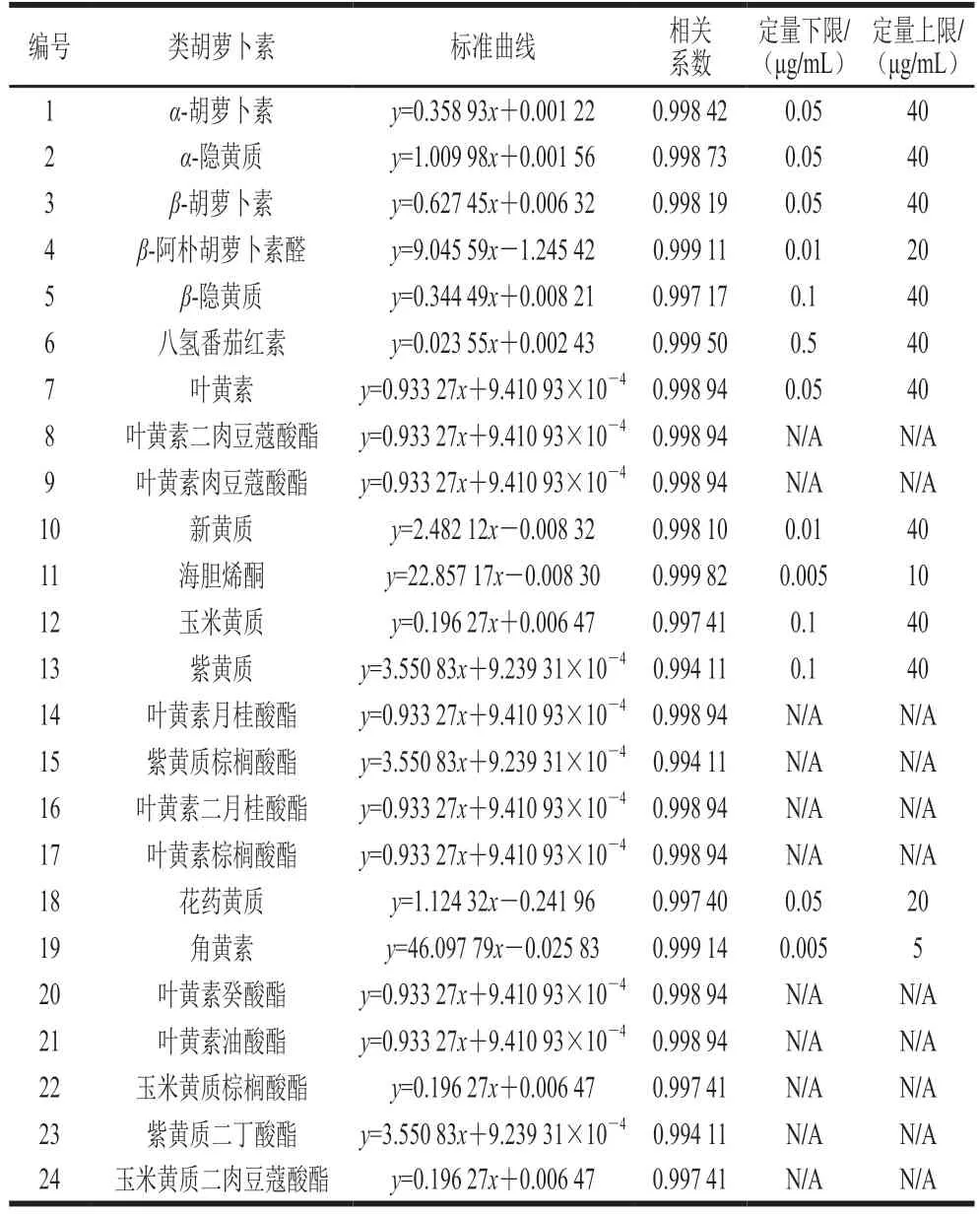
表1 类胡萝卜素标准曲线Table 1 Standard curves for carotenoids
如图1、表2所示,不同种类的类胡萝卜素在茶叶中含量差异较大,其中含量最高的类胡萝卜素组分为叶黄素(126±3.605 6)~(317.666 7±12.662 3)μg/g,占鲜叶检出类胡萝卜素总量的67.51%;其次是β-胡萝卜素(31.533 3±1.365 0)~(70.166 7±1.650 3)μg/g、紫黄质(2.156 7±0.025 2)~(20.033 3±1.721 4)μg/g、 八氢番茄红素(7.673 3±0.362 3)~(12.166 7±1.159 0)μg/g; 同一物质在加工过程中的变化也存在较大差异,除仅存在萎凋叶的叶黄素油酸酯、玉米黄质棕榈酸酯、仅存在揉捻叶的玉米黄质二肉豆蔻酸酯和仅存在萎凋和揉捻叶中的紫黄质二丁酸酯外,其余参与代谢的类胡萝卜素变异系数(coefficient of variation,CV)最大组分为叶黄素棕榈酸酯(130.852%),其次为玉米黄质(72.397%)、花药黄质(71.948%)。同时数据表明,作为吸光发色团(本身显橘红色)且将光能传递给无环番茄红素(深红色)的角黄素[32]以及叶黄素癸酸酯、紫黄质二丁酸酯均在萎凋工序后检出,这可能因该类物质在鲜叶中含量较低或萎凋阶段鲜叶失水、细胞内渗透压改变引起区隔化作用减弱导致酶与底物接触反应所制;叶黄素油酸酯、玉米黄质棕榈酸酯经萎凋工序后均未检出,可能是由于萎凋阶段细胞内酶促氧化引起的合成速率低于降解速率和缓慢热降解所制;紫黄质二丁酸酯、玉米黄质二肉豆蔻酸酯经历揉捻工序后均未检出,这可能是由于揉捻阶段鲜叶组织破损和细胞破碎引起的激烈酶促氧化所制。该类物质的形成与降解均为红茶色泽(包括在制品色泽及干茶和叶底)及香气的形成奠定了物质基础。鉴于此,本实验将按照类胡萝卜分类和酶促氧化主要代谢途径(图2A)对工夫红茶加工过程中类胡萝卜素组分进行详细分析。
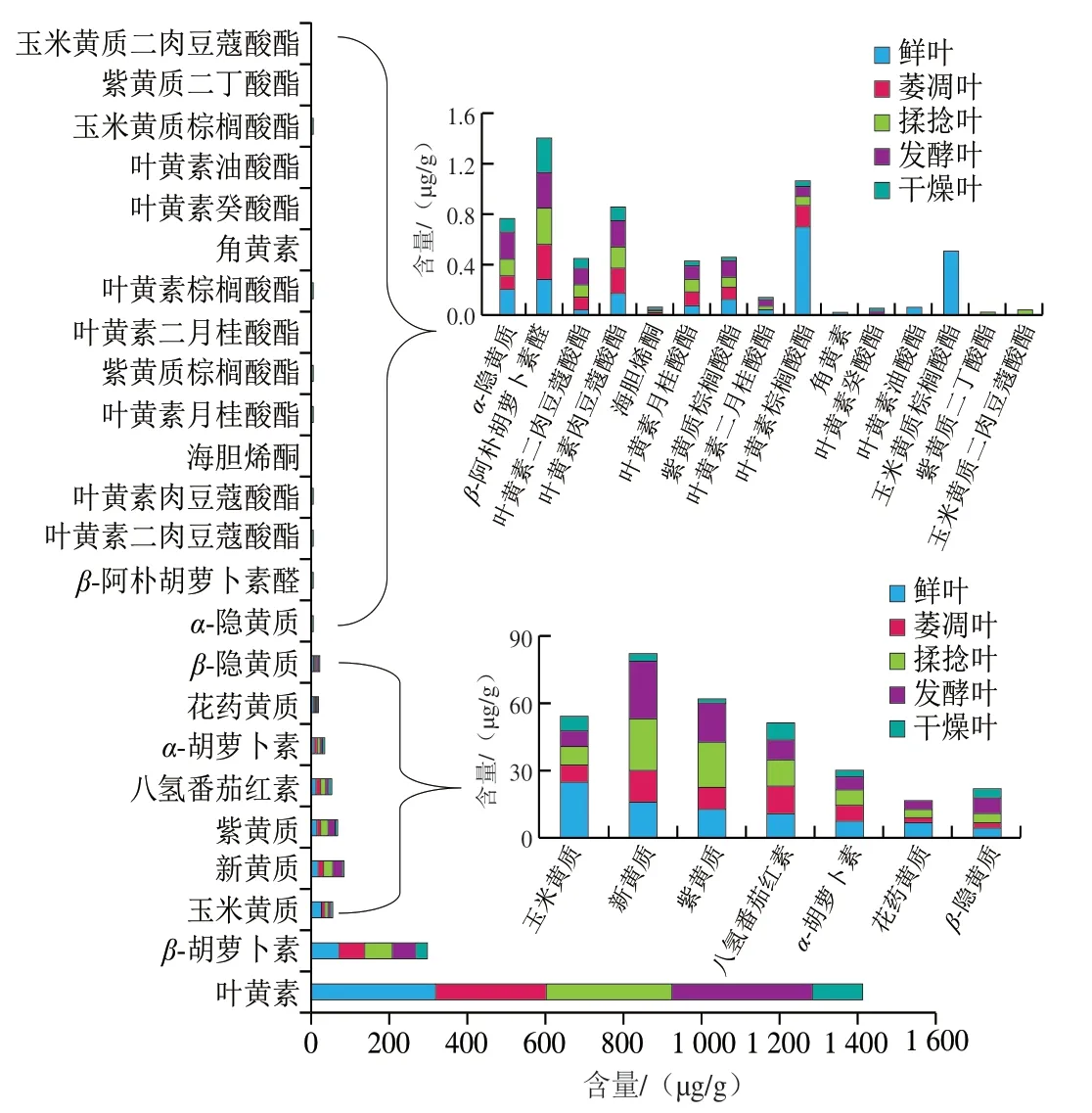
图1 类胡萝卜素含量分布 Fig. 1 Distribution of carotenoid contents in fresh tea leaves and intermediate products of Congou black tea manufacturing
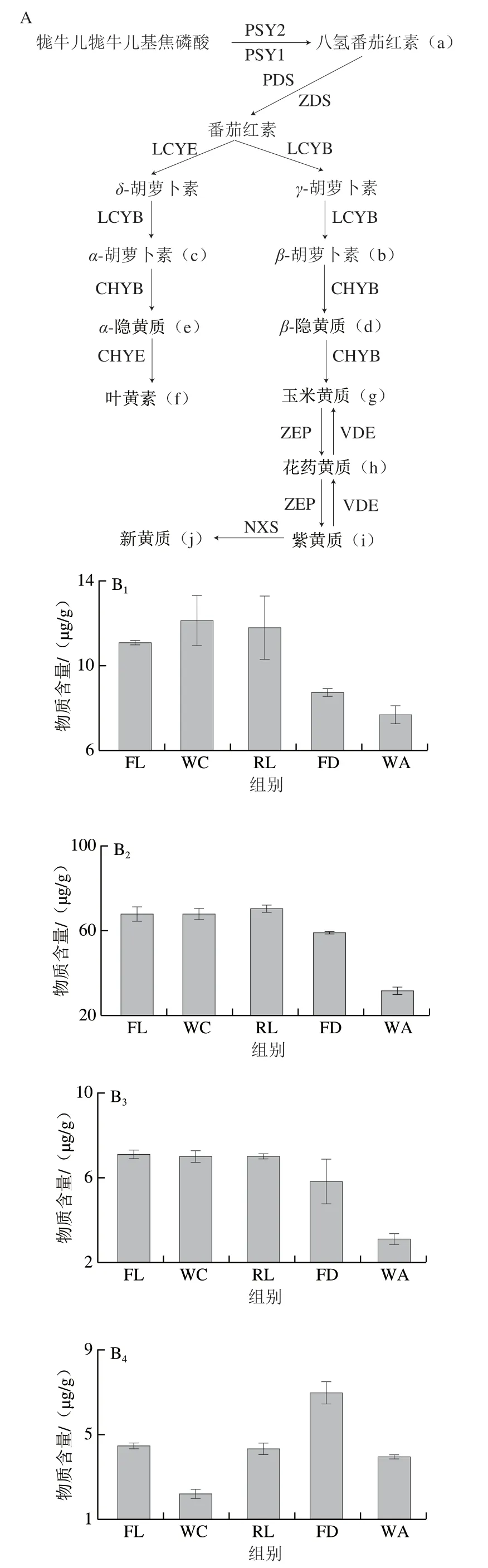
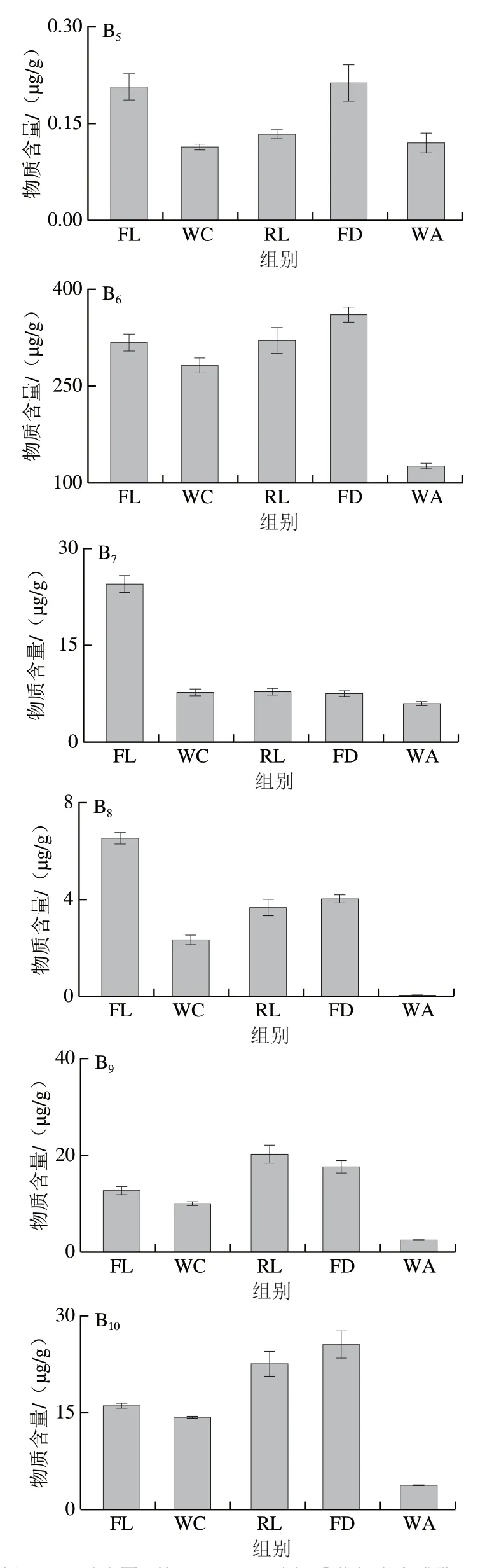
图2 类胡萝卜素生物合成途径[26](A)及对应物质含量(B)Fig. 2 Biosynthetic pathway of carotenoids (A) and contents of intermediate and final products in fresh tea leaves and intermediate products of Congou black tea processing (B)

表2 工夫红茶各工序茶叶类胡萝卜素含量 Table 2 Contents of carotenoids in fresh tea leaves and intermediate products of Congou black tea processing μg/g
2.2 类胡萝卜素变化分析
2.2.1 胡萝卜素类
如图2B1所示,八氢番茄红素经萎凋后出现小幅增加(约1.100 0 μg/g),然后随着红茶加工进行逐渐降低,尤其在发酵工序降低最为明显(分别较鲜叶、揉捻叶降低了21.18%、25.86%),待干燥结束成品茶中八氢番茄红素含量为(7.673 3±0.362 3)μg/g,较鲜叶降低了30.66%,可见发酵阶段剧烈酶促氧化和干燥强烈湿热作用促进了八氢番茄红素的酶促降解和热裂解。已有研究表明,几乎所有光合植物(除裸藻外)八氢番茄红素上游产物来源于4-磷酸甲基赤藓糖醇途径形成的C5异戊烯基二磷酸/烯丙基二磷酸构建,而后经牻牛儿牻牛儿基焦磷酸合成酶、八氢番茄红素合成酶调控合成八氢番茄红素,然后经八氢番茄红素脱氢酶和ζ-胡萝卜素脱氢酶等酶多步催化脱氢形成番茄红素,再经ε-番茄红素环化酶、β-番茄红素环化酶形成δ-胡萝卜素、β-胡萝卜素和α-胡萝卜素,进而完成后续物质代谢[33-34], 同时ε-番茄红素环化酶/β-番茄红素环化酶蛋白的比例也一直被认为是控制植物β-胡萝卜素、叶黄素、玉米黄质等的生物合成及其含量比例的基础[35]。
如图2B5所示,鲜叶中β-胡萝卜素经长时萎凋和揉捻处理后其含量约有增加(较鲜叶增加2.233 4 μg/g),但后期发酵阶段剧烈的酶促氧化加快了β-胡萝卜素的降解(分别较鲜叶、揉捻叶降低了13.1%、15.9%),最后经2 次干燥处理后成品茶中β-胡萝卜素含量为(31.533 3±1.365 0)μg/g,较鲜叶和发酵叶分别减少53.58%、46.58%,呈显著降低趋势(P<0.05)。而鲜叶、萎凋叶、揉捻叶中α-胡萝卜素含量均无显著差异(P>0.05),但在发酵和干燥工序经酶促氧化和湿热降解后显著降低(P<0.05),分别较鲜叶降低17.78%、55.87%,较鲜叶成分保存率为44.13%(图2B2)。由此推断,发酵和干燥是β-胡萝卜素、α-胡萝卜素降解的主要阶段,同时本研究发现β-胡萝卜素低温自氧化产物β-阿朴胡萝卜素醛、海胆烯酮、角黄素(鲜叶中未检出)在红茶加工整个过程中含量变化差异不大。已有研究证实,β-胡萝卜素可经类胡萝卜素裂解双加氧酶家族氧化裂解后经转移酶形成香气物质或其前体物质,根据β-胡萝卜素双键断裂部位可生成β-紫罗酮、β-环柠檬醛、茶香螺酮、二氢猕猴桃内酯等降异戊二烯香气物质及其衍 生物[38-39],β-胡萝卜素酶促降解产物[40-41]见图3。同时,干燥过程中相对较长的高温湿热作用可促进β-胡萝卜素的高温氧化降解等非酶促降解,较之于较短湿热作用时间能获得更多的热裂解产物[42],而α-胡萝卜素作为体内维生素重要合成来源而受到广泛关注[43]。
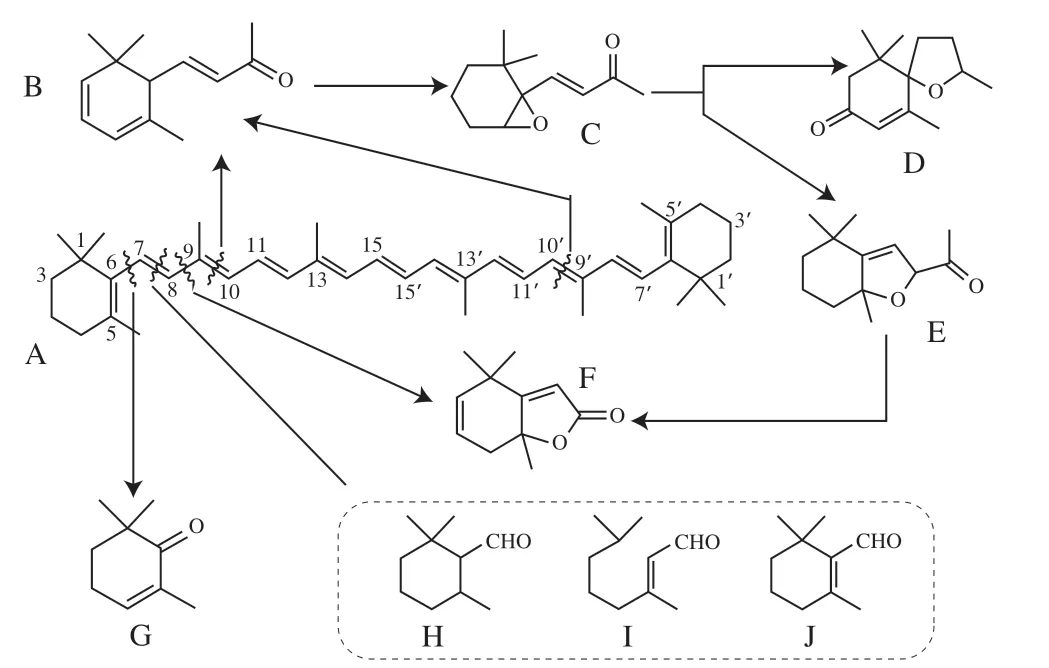
图3 β-胡萝卜素酶促降解[40-41]Fig. 3 Enzymatic degradation of β-carotene
2.2.2 叶黄素类
已有研究证实,α-胡萝卜素、β-胡萝卜素分别经β-胡萝卜素羟化酶催化形成α-隐黄质和β-隐黄质,且β-隐黄质生物利用率被证实明显优于β-胡萝卜素和α-胡萝卜素[44]。如图2B2、B5所示,β-隐黄质含量明显高于α-隐黄质且两者含量随加工进程变化趋于一致,均是经萎凋处理后降低至最小值然后在揉捻和发酵阶段逐渐增加至最大值(分别较萎凋叶增加91.32%、214.03%)最后经干燥阶段湿热作用迅速分解,可见揉捻和发酵阶段对隐黄质的酶促合成作用大于催化降解,且温度(高温)对隐黄质的热降解作用影响较大。
如图2B6所示,茶叶中叶黄素含量经萎凋工序后呈现小幅降低(约11.02%)而后经发酵阶段显著提升 (P<0.05),待干燥完成后叶黄素含量剧烈减少(约占发酵叶的34.87%),整个加工过程叶黄素保存率仅为39.66%。前期研究发现,α-胡萝卜素经β-胡萝卜素羟化酶和ε-胡萝卜素羟化酶催化形成叶黄素,而叶黄素在热胁迫下裂解同时可能伴有异构化、芳构化、环化和聚合等反应,总结推测出叶黄素形成重要香气物质途径主要包括:1)在C6—C7位间发生碳链断裂,生成氧化异佛尔酮;2)在C9—C10位间发生断裂生成3-羟基-α-紫罗兰醇,再经氧化还原生成3-氧代-α-紫罗兰醇,最后在弱酸环境下脱水形成巨豆三烯酮(烟草的主要呈香物质);3)在C21—C22位间发生断裂生成3-羟基-β-紫罗兰酮,后者进一步转化成β-大马酮;4)在C22位环化侧链断裂并失水形成紫罗兰烯;5)在C23—C24位间氧化断裂形成藏花醛环柠檬醛[45-47](图4)。
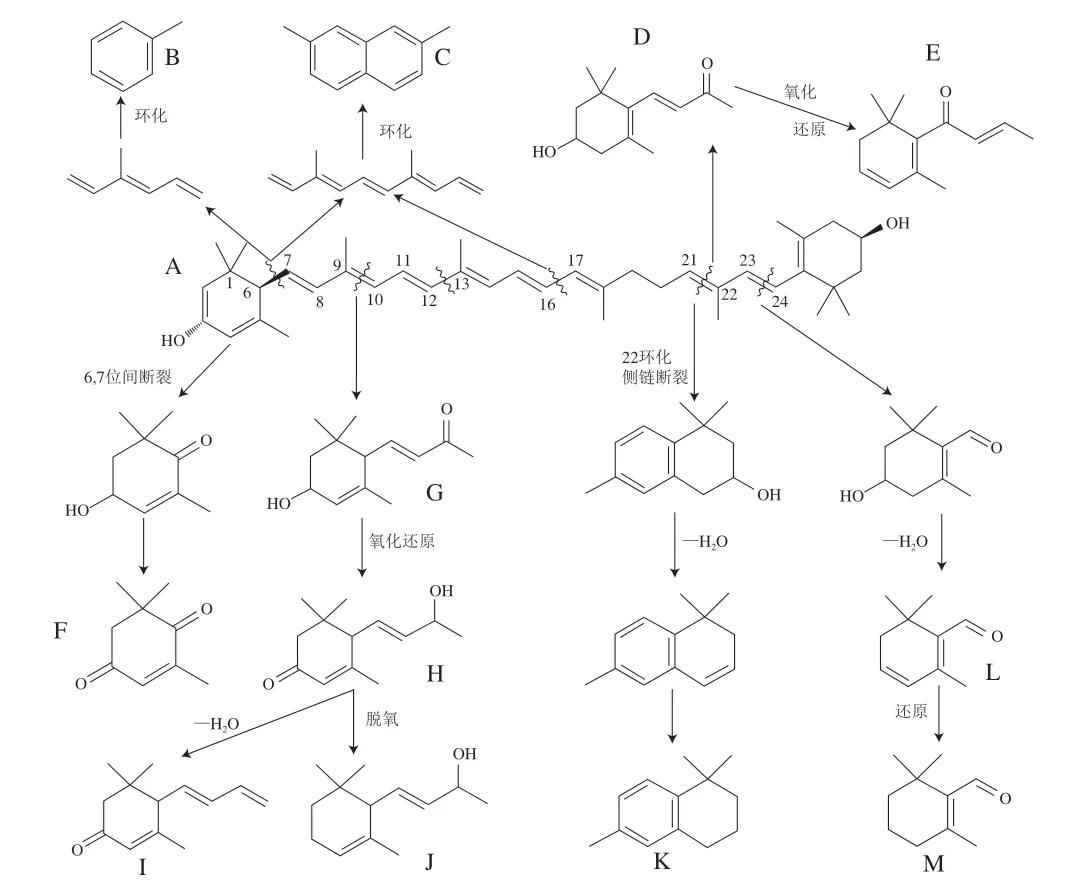
图4 叶黄素热裂解机理推测[43]Fig. 4 Deduced thermal decomposition mechanism of lutein
如图2B7所示,玉米黄质含量在整个加工过程中呈逐渐降低趋势,其中萎凋阶段降低最为激烈,由鲜叶(24.800 0±1.126 9)μg/g降低至萎凋叶(7.896 7±0.331 3)μg/g,减少率为68.16%,至干燥结束茶叶玉米黄质含量为(6.080 0±0.167 0)μg/g,较鲜叶保存率为24.52%,可见玉米黄质对萎凋长时中温作用响应高于后期细胞破损引起的酶促氧化及干燥阶段的高温湿热作用。研究发现,玉米黄质经玉米黄素环氧化酶催化形成花药黄质,而花药黄质和玉米黄质可作为外周集光色素复合体II能量猝灭剂和聚集增强剂发挥光保护作用[48],同时花药黄质经玉米黄素环氧化酶催化形成紫黄质。本研究中,花药黄质经萎凋工序后迅速降低63.83%,为(2.353 3±0.145 0)μg/g,而后经揉捻和发酵工序逐渐增加至(4.01 3 3±0.168 6)μg/g,最后在干燥阶段发生剧烈分解(本研究中未检出)(图2B8); 而紫黄质含量经萎凋后降至(9.710 0±0.266 3)μg/g (较鲜叶降低23.34%)后,经揉捻工序迅速增加至(20.033 3±1.721 4)μg/g,待干燥完成后其含量快速降低至(2.156 7±0.025 2)μg/g,较发酵叶降低率和鲜叶保留率分别为87.72%、13.03%(图2B9),可见紫黄质在红茶加工阶段对酶和温度的响应与花药黄质较为相似。
紫黄质经新黄质合成酶催化形成新黄质,新黄质在双加氧酶的作用下先断裂C9=C10双键生成蚱蜢酮,然后降解形成丙二烯三醇,最后在酸性条件下水解生成β-大马士酮[49],而这种红茶茶汤重要香气物质亦可在酸性条件下由新黄质热裂解直接获得[50]。本研究中,新黄质随红茶加工进程呈先增加后降低的变化趋势,同时发现揉捻和发酵是新黄质累积的重要阶段,较之于鲜叶分别增加了40.79%、59.63%,而随后干燥阶段新黄质含量显著降低(P<0.05),仅为发酵叶含量的14.49%,且较鲜叶的保存率为23.13%(图2B10),由此可推断干燥可能为β-大马烯酮形成的重要工序。
2.2.3 类胡萝卜素酯类
由于叶黄素类等在光、热和氧气条件下的不稳定性,使得这类物质存在多种结构更为稳定的酯化物[51],本研究中共检出叶黄素酯类、玉米黄质酯类、紫黄质酯类等脂肪酸化类胡萝卜素酯共计11种,但其整体含量偏低(0~(0.708 0±0.078 3)μg/g)。其中,叶黄素脂肪酸酯7种,包含叶黄素肉豆蔻酸酯、叶黄素二肉豆蔻酸酯、叶黄素月桂酸酯、叶黄素二月桂酸酯、叶黄素棕榈酸酯、叶黄素油酸酯、叶黄素癸酸酯,其中以叶黄素棕榈酸酯含量最高,为(0.045 1±0.006 9)~(0.708 0± 0.078 3)μg/g;玉米黄质酯化物包含玉米黄质棕榈酸酯、玉米黄质二肉豆蔻酸酯,且仅在鲜叶和揉捻叶中分别检出,可见其在后期酶促氧化过程合成小于分解;紫黄质酯化物共检出2种,即紫黄质棕榈酸酯和紫黄质二丁酸酯,其中前者由鲜叶(0.123 7±0.021 2)μg/g经萎凋、揉捻缓慢降至(0.082 2±0.007 5)μg/g,而后在发酵酶促作用下恢复到鲜叶含量水平,最后在干燥阶段剧烈湿热作用下迅速分解或转化(较发酵叶降低约68.56%),而紫黄质二丁酸酯仅在萎凋叶和揉捻叶中检出。
3 讨 论
类胡萝卜素的降解(酶促或非酶促)不仅会导致食品色泽变化,而且影响其香气组成和呈味特征,如Ravichandran[52]发现添加类胡萝卜素的红茶在加工过程中产生的风味物质比不添加的多1 倍,且成品茶风味品质得到极大改善;肖亚冬等[53]发现热处理后的甜玉米汁中的β-紫罗兰酮、甲基庚辛酮、柠檬烯、苯甲醛、仲辛酮、p-伞花烃、甲苯、连三甲苯等香味物质与反式类胡萝卜素变化呈显著负相关,其中叶黄素和β-胡萝卜素贡献最大;Zepka等[54]加热腰果梨模拟汁中的类胡萝卜素发现大量连三甲苯、对二甲苯、p-伞花烃、苯乙烯等芳香烃类、烷烃类挥发性化合物生成。红茶加工过程中,酶促氧化和热裂解是类胡萝卜素降解的主导因素,基于类胡萝卜素对不同光质吸收特性和降解、衍生产物呈味特征,结合不同光质萎凋对红茶综合品质调控研究基础(如紫外灯照射摊青叶能显著提升其芳樟醇、反式氧化芳樟醇、橙花叔醇、β-紫罗酮、棕榈酸甲酯、柠檬醛等成分含量[55];黄光在前期促进红茶萎凋叶β-葡萄糖苷酶基因(CsBG1、CsBG2)、β-樱草糖苷酶基因(CsBP)上调,后期调控β-葡萄糖苷酶活性提高,并促进工夫红茶甜花香显现[56];绿、紫、蓝光促进苯乙醇(玫瑰花香,红茶重要香气物质)释放,黄、橙、红光萎凋能显著改善红茶的香气和口感使茶具有甘甜、鲜醇的 口感[57];紫外光促进萎凋叶α-法尼烯、香叶醇、茉莉酮合成及反式-芳樟醇、橙花叔醇、邻苯二甲酸二异丁酯、顺式-罗勒烯等萜类香气物质含量[58],开展不同组合光质和阶段单一光质萎凋或发酵以此调控红茶品质具有潜在的重要研究意义。同时类胡萝卜素热降解产生的降异戊二烯类化合物及其衍生物所表现出的清香、花香或果香丰富了红茶香气浓度、香型和层次,是红茶特征香气的重要来源,然而受降解速率和键位断裂处影响,对其不同热裂解产物所需最适温度、湿度、氧气浓度仍缺乏较为系统和深入的研究。
品种是茶叶品质形成的物质基础,不同茶树品种鲜叶内含成分的差异决定了其茶类适制性和成品茶感官品质,如陈丽等[21]比较37个茶树品种发现乌龙茶品种类胡萝卜素总量最高,红茶品种的环氧玉米黄素和玉米黄质高于其他品种;杨培迪等[59]比较不同茶树品种绿茶干燥茶色泽,发现类胡萝卜素和叶绿素b含量的增加会导致绿茶叶片红、蓝色调及整体彩度升高而明度和绿、黄色调降低;刘关华等[60]揭示番茄红素-β-环化酶基因(CsLCYb)在黄化茶树叶片的胡萝卜素合成和叶色变化过程中十分重要,由此表明类胡萝卜素具有潜在的品种选育和茶叶等级判别能力。同时,结合茶树品种类胡萝卜素含量分布差异,根据其吸光、代谢差异开展茶叶离体采摘前光照处理以此积累香气呈味和前体物质具有重要意义,如蓝光和红光照射采摘前茶树新梢可能会通过上调苯丙氨酸解氨酶、苯乙醛合成酶及苯乙醛还原酶I、II表达水平,进而显著增加采前鲜叶中内源挥发性苯丙烷类/苯环型化合物(可来源于胡萝卜素降解)如苯甲醇、苯乙醇、苯甲醛含量[61];蓝光和红光照射采前茶树鲜叶可以激活9/13-LOX,促进挥发性脂肪酸衍生物如挥发性短链脂肪醇、醛、酮等的合成和释放[62]。因此,基于茶叶加工对产品品质定向调控需求,结合本研究结果,在后期的研究中有必要系统、深入开展不同光源、不同温湿度对类胡萝卜素酶促氧化或热裂解反应代谢研究。同时,基于本研究类胡萝卜素在常规工艺下成分的动态变化,可结合鲜叶采前处理(如施肥、光源照射)、组合萎凋(如做青、光源照射)、干燥(产热、导热方式)及外源添加类胡萝卜素等处理,开发特征香气突出的天然或调味型茶叶新产品,以期满足茶产品多元化市场需求。
4 结 论
本研究采用LC-MS/MS法测定工夫红茶加工各工序茶叶在制品类胡萝卜素含量,发现各工序茶叶共检出类胡萝卜素24种,其中胡萝卜素类3种、叶黄素类10种、类胡萝卜素酯类11种;不同种类的类胡萝卜素在茶叶中的含量差异较大,其中叶黄素(126.000 0±3.605 6)~(317.666 7±12.662 3)μg/g、β-胡萝卜素(31.533 3± 1.365 0)~(70.166 7±1.650 3)μg/g 含量较高;同一类胡萝卜素在加工过程中的变化也存在较大差异,其中以叶黄素棕榈酸酯CV值最大为130.852%。对比不同类胡萝卜素组分在加工过程中的含量变化,发现所检出物质含量变化总体呈现3种趋势,即先增后减、持续降低和先降低后增加再降低,其中以发酵、干燥阶段叶黄素变化速率最大,分别为10.25、58.33 μg/(g·h)。此外,研究发现持续中温(萎凋)、酶促氧化(揉捻、发酵)和剧烈湿热作用(干燥)是引起类胡萝卜素变化的主要诱因,但所检出类胡萝卜素对其响应程度存在较大差异。
