超高效液相色谱法测定特殊医学用途婴儿配方食品中的19种游离氨基酸和牛磺酸
2022-03-05卢兰香宿书芳张艳侠尹丽丽郑文静孙立臻祝建华刘艳明
卢兰香,薛 霞,宿书芳,张艳侠,尹丽丽,程 志,郑文静,孙立臻,王 骏,祝建华,刘艳明
(山东省食品药品检验研究院,山东省特殊医学用途配方食品质量控制工程技术研究中心,山东省食品药品安全检测工程技术研究中心,山东 济南 250101)
特殊医学用途婴儿配方食品是指针对患有特殊紊乱、疾病或医疗状况等特殊医学状况婴儿的营养需求而设计制成的粉状或液态配方食品[1]。部分婴儿由于各种疾病原因,不能喂养母乳或普通婴儿配方食品,特殊医学用途婴儿配方食品,是这些婴儿生命早期或出生后相当长时间内赖以生存的主要食物[2]。
氨基酸是构成人体营养所需蛋白质的基本物质,常被加入到特医食品中,起到促进发育、调节人体代谢等作用[3];牛磺酸(Tau)与胱氨酸的代谢密切相关,并且结构与氨基酸类似,被称为类氨基酸物质[4]。目前,GB 25596—2010《特殊医学用途婴儿配方食品通则》可用于特殊医学用途婴儿配方食品的氨基酸有19种,但是并未给出相应的检测方法。国内关于食品中氨基酸的检测标准仅有GB 5009.124—2016《食品中氨基酸的测定》[5],该标准规定了16种氨基酸的检测方法,没有覆盖GB 25596—2010中包含的胱氨酸、色氨酸以及谷氨酰胺3种氨基酸的检测。GB 25596—2010规定了Tau的添加量为0~3 mg/100 kcal,而GB 5009.169—2016《食品中牛磺酸的测定》[6]检测范围不包括特殊医学用途婴儿配方食品。国内外报道的氨基酸检测涉及的研究对象大多为生物样品或普通食品,而Tau的研究对象多为婴幼儿配方乳粉和饮料;对特殊医学用途婴儿配方食品中氨基酸和Tau的同时检测鲜有报道。由于医用食品因其特殊的功能性用途,产品基质和结构成分与婴幼儿配方乳粉及普通食品有着较大的区别[7],使得常规食品或婴幼儿配方乳粉中氨基酸和Tau的检测方法在医用食品检测领域难以直接应用。
目前,氨基酸和Tau的检测技术主要有氨基酸分析仪[5,8-9]、高效液相色谱仪[10-17]及液相色谱-串联质谱仪[18-24]等。GB 5009.124—2016采用的是离子交换茚三酮柱后衍生的方法,该方法中使用的氨基酸自动分析仪价格昂贵、用途专一、灵活性差,大大限制了其推广和使用。而液相色谱分析法,普适性广,具有分析速度快、灵敏度高、操作简单等优点,已成为检测氨基酸的首选方法。因氨基酸和Tau属于极性大且无紫外吸收的一类化合物,故需进行衍生化。常用的衍生剂有异硫氰酸苯酯(phenylisothiocyanate,PITC)[11,17]、2,4-二硝基氟苯(2,4-dinitrofluorobenzene,DNFB)[10]、邻苯二甲醛(o-phthaldiadehyde,OPA)[15]、9-氯甲酸芴甲酯(9-fluorenyl methyl chloroformate,FMOC)、OPAFMOC联用[12]、丹磺酰氯(1-dimethylaminonaphthalene-5-sulphonyl-chloride,Dansyl-Cl)[25]、6-氨基喹啉基-N-羟基-琥珀酰亚氨基甲酸酯(6-aminoquinolyl-Nhydroxysuccinimidyl carbamate,AQC)[26-28]等。DNFB衍生过程中能够产生对测定结果有干扰的副产物,PITC衍生试剂具有挥发性且毒性较大,需真空干燥装置去除过量衍生剂,FMOC衍生过量的反应剂必须用戌烷萃取除去[29];OPA衍生产物在室温不稳定,分解率高[30];Dansyl-Cl反应活性较差,反应速度慢,且易生成多级衍生产物干扰测定。AQC[31]可与伯胺和仲胺反应生成稳定的衍生物脲,其衍生物有很强的紫外吸收和荧光吸收,衍生操作简单,衍生速度快,过量的试剂能自然水解,不需要特殊的处理或提取;而且还不受样品基质、大量电解质、维生素和微量元素的干扰,特别适用于食品等复杂基质中氨基酸的分析。
本研究针对检测标准中检测对象覆盖不全、检测范围不包含医用食品,无法满足监管需求的问题,采用AQC衍生,建立超高效液相色谱同时测定特殊医学用途婴儿配方食品中19种游离氨基酸和Tau的检测方法,填补医用食品中氨基酸和Tau检测标准空白和技术缺失,可以为殊医学用途婴儿配方食品的质量控制和监管提供技术支持。
1 材料与方法
1.1 材料与试剂
实验用特殊医学用途婴儿配方食品:无乳糖配方、乳蛋白部分水解配方、乳蛋白深度水解配方、氨基酸配方、早产/低出生体质量婴儿配方、氨基酸代谢障碍配方、母乳营养补充剂均为市售。
标准品:天冬氨酸(Asp,纯度≥99.7%)、丝氨酸(Ser,纯度≥99.9%)、谷氨酸(Glu,纯度≥ 98.0%)、组氨酸(His,纯度≥99.9%)、精氨酸(Arg,纯度≥91.3%)、苏氨酸(Thr,纯度≥ 99.9%)、脯氨酸(Pro,纯度≥99.5%)、酪氨酸(Tyr,纯度≥99.6%)、缬氨酸(Val,纯度≥ 99.4%)、蛋氨酸(Met,纯度≥98.3%)、赖氨酸(Lys,纯度≥88.1%)、异亮氨酸(Ile,纯度≥ 99.5%)、亮氨酸(Leu,纯度≥99.9%)、苯丙氨酸(Phe,纯度≥99.4%)、谷氨酰胺(Gln,纯度≥ 99.2%)、色氨酸(Trp,纯度≥99.6%),均购自Dr. Ehrenstorfer GmbH公司;丙氨酸(Ala,纯度≥ 99.8%)、胱氨酸(Cys,纯度≥99.9%),均购自北京曼哈格生物科技有限公司;甘氨酸(Gly,纯度≥99.0%) 中国计量科学研究院;Tau(纯 度≥99.8%) 美国Sigma-Aldrich公司。
乙腈(色谱纯) 美国Fisher公司;甲酸(色谱纯)、Waters AccQ-Tag氨基酸测定试剂盒(AccQ-Fluor 试剂盒(包括硼酸缓冲液1、衍生剂粉2A、稀释 液2B));α-淀粉酶(活力≥1.5 U/mg) 美国Sigma-Aldrich公司;甲酸铵(色谱纯) 美国Fisher公司;盐酸(优级纯)、氢氧化钠(分析纯) 国药集团化学试剂有限公司;有机微孔滤膜(0.22 μm) 上海安谱科学仪器有限公司。
1.2 仪器与设备
H-CLASS超高效液相色谱仪(配备二极管阵列检 测器) 美国Waters公司;AB204-S型电子天平 瑞士 Mettler Toledo公司;SB-800DTD型超声波清洗器 宁波新芝生物科技股份有限公司;3-18K型冷冻离心机 德国Sigma公司;MS3涡旋混合器 德国IKA公司;SW22型恒温水浴振荡摇床 优莱博技术(背景)有限公司;Milli-Q超纯水制备器 美国Millipore公司。
1.3 方法
1.3.1 标准溶液的配制
标准储备液(10.0 mmol/L):分别准确称取适量(精确至0.1 mg)标准品于10 mL容量瓶中,分别用0.1 mol/L盐酸定容至刻度。
标准工作溶液:将以上各标准储备液稀释,配成混合标准溶液,使用前逐级稀释至各组分均为3.0、5.0、10.0、25.0、50.0、100.0、200.0、250.0 μmol/L的系列标准工作溶液,待用。
1.3.2 样品前处理
1.3.2.1 提取
样品混匀后称取1 g(精确到0.000 1 g)至50 mL离心管中,加入20 mL 45~50 ℃的水,混匀。充分摇匀,加入0.1 gα-淀粉酶,混匀后,置于(55±5)℃的恒温水浴振荡摇床中30 min。取出,冷却至室温后,用盐酸溶液调节试样溶液的pH值至1.7±0.1,放置约2 min后,再用氢氧化钠溶液调pH值至4.5±0.1后,超声约10 min。将试样溶液转移至25 mL容量瓶中,用水冲洗比色管,洗液合并于25 mL容量瓶中,加水定容后,摇匀,样液全部转移至50 mL离心管中,8 000 r/min离心5 min,上清液经0.22 μm有机相微孔滤膜过滤后待用。
1.3.2.2 衍生
AccQ-Fluor衍生剂的制备:吸取2B瓶中1 mL AccQFluor稀释剂放入装有AccQ-Fluor衍生剂粉末的2A瓶中,加盖密封,涡旋10 s,在55 ℃加热装置上加热2A瓶,直至AccQ-Fluor衍生剂粉末全部溶解,加热时间不超过10 min。密封,室温下保存于干燥器中,有效期1 周。
衍生样品或标准溶液:移取10 μL标准工作溶液或1.3.2.1节的样品提取液于6 mm×50 mm试管的底部,加入70 μL AccQ-Fluor硼酸盐缓冲液(Buffer 1)涡旋混合后,加入20 μL AccQ×Fluor衍生剂,立即涡旋混合,室温放置1 min,将样品溶液转移至微量自动进样样品瓶中,加盖密封,置于55 ℃加热装置上加热10 min,冷却至室温后上机测定。
衍生试剂空白溶液:移取80 μL AccQ-Fluor硼酸盐缓冲液(Buffer 1)于6 mm×50 mm试管的底部,加入20 μL AccQ-Fluor衍生剂,立即涡旋混合,将样品溶液转移至微量自动进样样品瓶中,加盖密封,上机测定。
1.3.3 色谱条件
超高效液相色谱柱:AccQ-Tag Ultra C18(2.1 mm×100 mm,1.7 μm);流动相:A为甲酸-甲酸铵缓冲溶液(20 mmol/L,pH 2.25),B为甲酸-甲酸铵缓冲溶液(20 mmol/L,pH 3.00),C为乙腈;进样体积1 μL;柱温55 ℃;检测波长260 nm,梯度洗脱程序如表1所示。
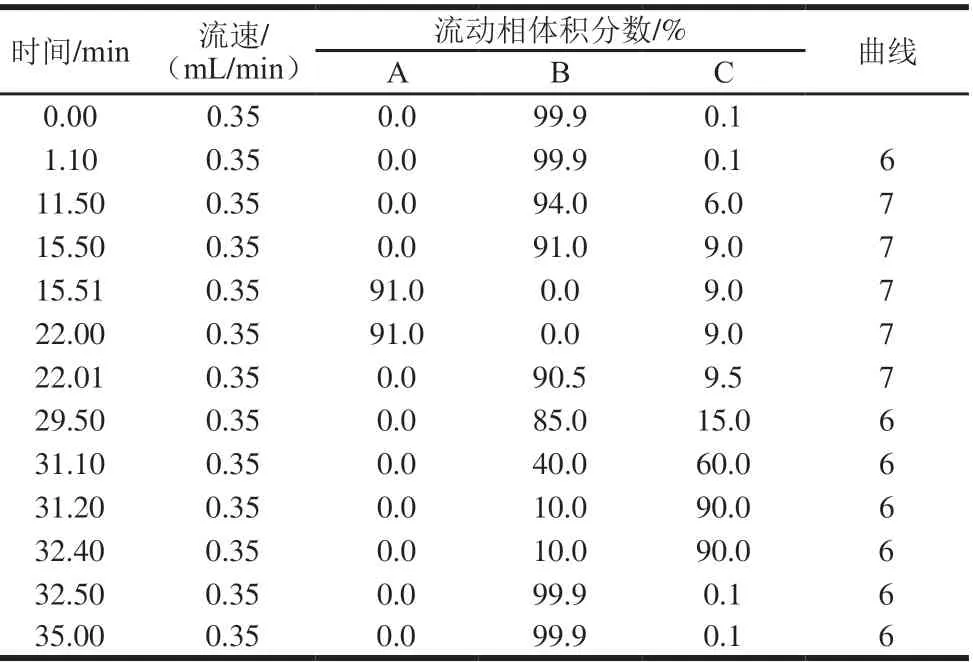
表1 梯度洗脱程序Table 1 Gradient elution program
1.4 数据处理
通过与仪器配套的Empower 3色谱数据处理系统完成数据采集与处理,以及Origin 8.0进行绘图。
2 结果与分析
2.1 前处理条件的优化
2.1.1 沉淀方式的选择
特殊医学用途婴儿配方食品的配方及其多样复杂,样品中含有大量的碳水化合物、氨基酸、蛋白质、麦芽糊精等物质,若不除去会严重干扰目标物的测定。由于氨基酸和Tau结构相似,都包含羧基(磺酸基)和氨基的极性化合物,很难靠单纯的阴阳离子固相萃取法同时实现多种氨基酸和Tau的净化,所以实验采用沉淀法除去样品中的干扰物质。实验以某乳蛋白深度水解配方特殊医学用途婴儿配方食品为代表,考察调pH值沉淀、亚铁氰化钾-乙酸锌沉淀剂、体积分数80%乙腈溶液3种沉淀方式对特殊医学用途婴儿配方食品中19种氨基酸和Tau提取量(图1A)和回收率(图1B)的影响。
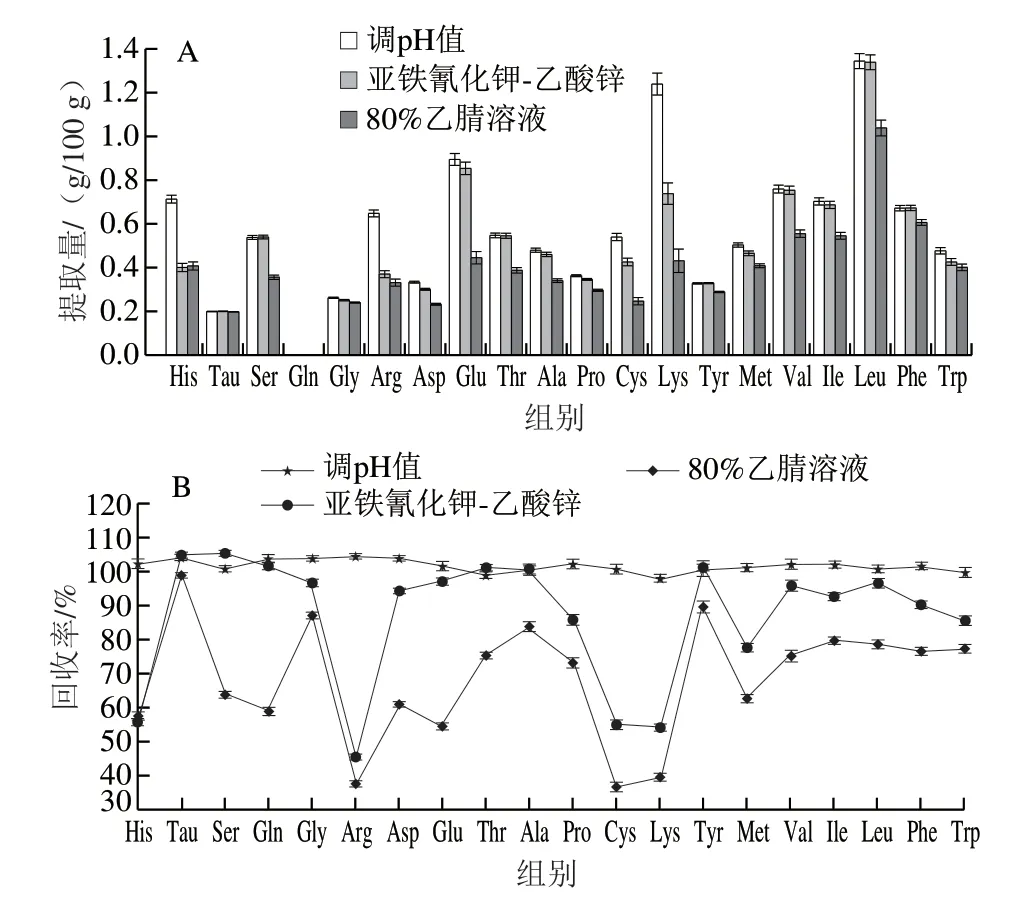
图1 沉淀方式对19种氨基酸和Tau提取的影响Fig. 1 Effect of precipitation methods on the recovery of 19 amino acids and taurine
实验表明,3种沉淀方式对不同氨基酸和Tau的提取和回收率的影响趋势基本一致。亚铁氰化钾-乙酸锌和80%乙腈溶液两种沉淀方式沉淀效果良好,滤液澄清透明;但样品中19种氨基酸和Tau回收率大部分有不同程度的偏低现象,样品中除谷氨酰胺未检出外,其他18种氨基酸和Tau的含量大部分也出现不同程度的偏低现象,与对回收率的影响相符。而调pH值沉淀,除蛋白深度水解配方和氨基酸配方滤液出现轻微浑浊外,剩余其他配方特殊医学用途婴儿配方食品的滤液均为澄清透明溶液,沉淀效果良好,且提取效果良好和回收率正常。原因可能是氨基酸和Tau在乙腈中的溶解度较低,而且乙腈在沉淀干扰物质时可能同时沉淀了目标物;亚铁氰化钾-乙酸锌是通过生成氰化亚铁酸锌络合物与干扰物质共沉淀,可能吸附或包裹了部分目标物。调pH值沉淀净化效果良好,目标物提取效率高,所以实验选择调pH值沉淀去除样品中的干扰物质。
2.1.2 提取方式的选择
由于特殊医学用途婴儿配方食品基质的特殊性和复杂性,实验以某乳蛋白深度水解配方特殊医学用途婴儿配方食品为代表,考察α-淀粉酶酶解和不酶解对样品中19种氨基酸和Tau提取的影响结果表明,用α-淀粉酶酶解和不酶解,样品中氨基酸和Tau含量没有明显差异;但是不用α-淀粉酶酶解直接调pH值沉淀时,样品处理液浑浊,离心后滤液仍然很浑浊无法通过微孔滤膜过滤,酶解后滤液相对较澄清,滤液均可顺利通过微孔滤膜。所以实验选择用α-淀粉酶酶解。
2.1.3 衍生试剂用量的影响
氨基酸本身无紫外吸收,需衍生化后才能进行超高效液相色谱分析,因此衍生试剂的用量直接影响氨基酸和Tau分析结果的准确性和重复性。实验向250 μmol/L 的19种氨基酸和Tau混合标准溶液中分别加入5、10、20、30 μL的衍生化试剂,考察衍生试剂体积对19种氨基酸和Tau衍生物峰面积的影响(图2)。结果表明,随着衍生试剂用量的增加,19种氨基酸和Tau衍生物的峰面积逐渐增加,超过20 μL之后趋于平稳。实验发现衍生试剂加入量为5、10 μL时,在His和Tau之间会产生一个色谱峰,而且与Tau不能完全分离;可能是因为衍生不完全而产生的异构体。衍生过程中的副产物6-氨基喹啉(6-aminoquinoline,AMQ)很强的紫外吸收,随着衍生试剂的增加AMQ峰面积逐渐增加,且会在氨基酸和Tau衍生物的峰前形成一个大的试剂峰并伴有拖尾现象,从而干扰目标物的测定。所以实验选择衍生试剂的用 量为20 μL。
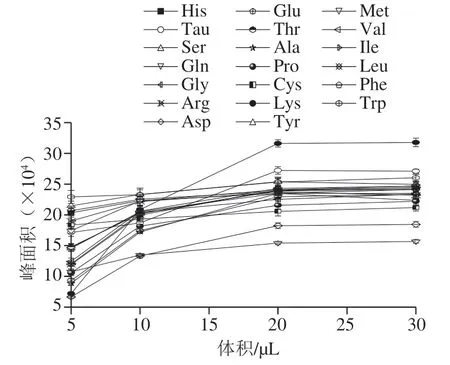
图2 衍生试剂用量对19种氨基酸和Tau衍生物峰面积的影响Fig. 2 Effect of derivatization reagent dosage on peak area of 19 amino acids and taurine
2.2 超高效液相色谱条件的优化
2.2.1 色谱柱的选择
实验选取Waters Acquity UPLC HSS T3(2.1 mm×100 mm,1.7 μm)、BEH Shield RP18(100 mm×2.1 mm,1.7 μm)和AccQ-Tag Ultra C18(2.1 mm×100 mm,1.7 μm)3种色谱柱对分离效果的影响。结果表明:BEH Shield RP18分离效果最差,HSS T3分离时Arg和Gly不能完全分离,Ile、Leu、Phe、Trp不能完全分离;AccQ-Tag Ultra C18分离效果最好,能够实现19种氨基酸和Tau的完全分离。因此,实验选择 AccQ-Tag Ultra C18色谱柱。
2.2.2 流动相条件的选择
2.2.2.1 流动相种类
由于实验采用超高效液相色谱,考虑到磷酸盐对输液泵和色谱柱的影响以及梯度设置的限制,所以比较常用的甲酸-甲酸铵缓冲液和乙酸-乙酸铵缓冲液对19种氨基酸和Tau分离效果的影响。实验发现,甲酸-甲酸铵缓冲液能实现19种氨基酸和Tau的有效分离,且峰形良好,所以实验选取甲酸-甲酸铵缓冲液作为流动相。
2.2.2.2 流动相浓度
实验比较10、20、30 mmol/L的甲酸-甲酸铵缓冲液,对19种氨基酸和Tau分离效果的影响。实验表明,Gly和Arg比较难分离,在10 mmol/L甲酸-甲酸铵缓冲液中分离度为0.89,不能实现完全分离;在20、30 mmol/L的甲酸-甲酸铵缓冲液中的分离度分别为1.76、3.16均大于1.5,都能实现完全分离,但考虑到盐浓度对超高效液相色谱仪的输液泵和色谱柱的影响,所以实验选择甲酸-甲酸铵缓冲液的浓度为20 mmol/L。
2.2.2.3 流动相pH值
一级或二级氨基酸与AQC的衍生产物脲含有羧基,流动相pH值对其分离度影响很大,在相同pH值条件下难以使所有目标物实现完全分离。实验发现,Ser、Gln、Gly、Arg、Asp完全分离需要的pH值高于Cys、Lys、Tyr、Met、Val,所以实验针对不同氨基酸性质拟采用不同pH值的流动相进行梯度洗脱。实验分别考察pH 2.00、2.25、2.50对Cys、Lys、Tyr、Met、Val分离效果的影响(图3A),pH 2.75、3.00、3.25对其他氨基酸和Tau分离效果的影响(图3B)。
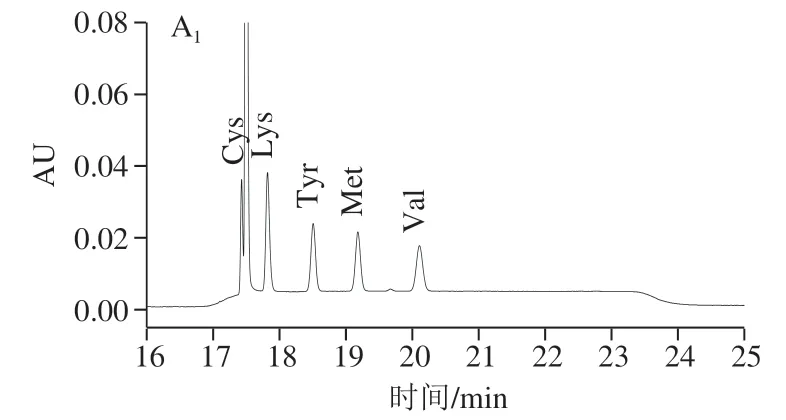
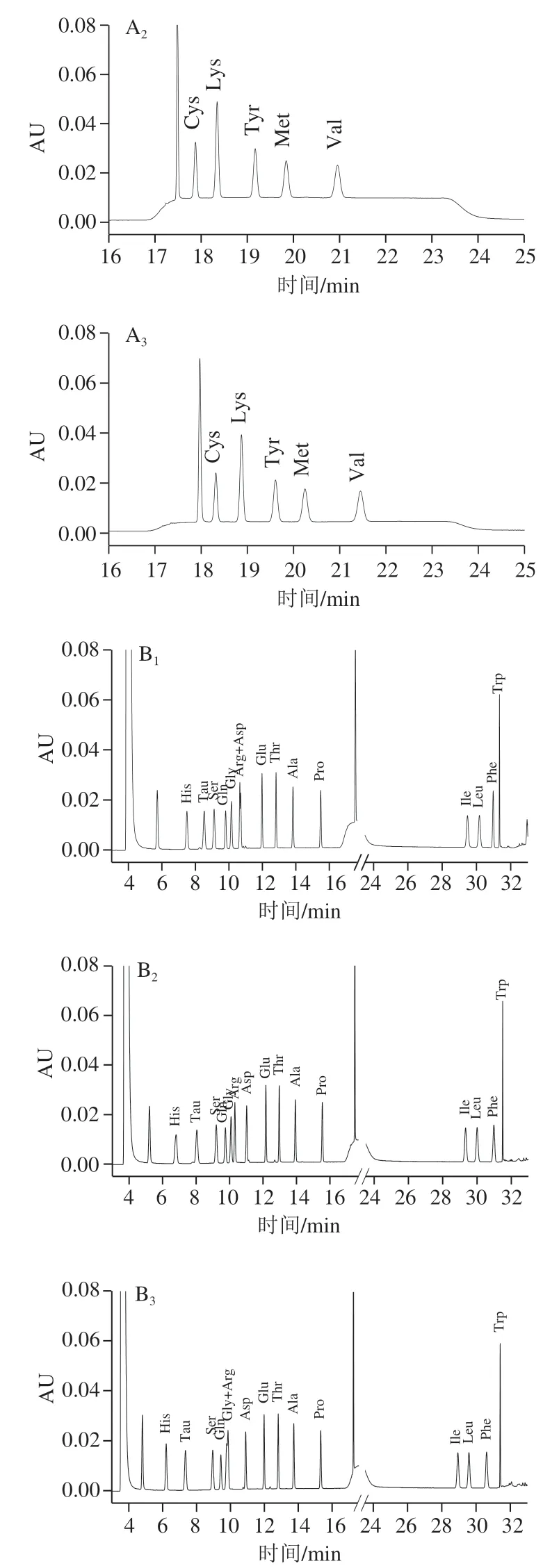
图3 缓冲液pH值对19种氨基酸和Tau分离的影响Fig. 3 Effect of buffer pH on separation of 19 amino acids and taurine
实验表明,流动相pH值较小范围内变化,对19种氨基酸和Tau的分离度影响较大,与文献[32]报道一致,因此,为保证流动相pH值的准确性和稳定性,pH值数值需精确到小数点后两位。
由图3A可知,pH 2.50时Cys与衍生峰不能完全分离,pH 2.25和pH 2.00对Cys、Lys、Tyr、Met、Val分离效果都比较好,因此,从保护色谱柱的角度考虑,在15.5~22.0 min内甲酸-甲酸铵缓冲溶液的酸度选择为pH 2.25。
图3B表明,甲酸-甲酸铵缓冲溶液pH 3.25时,Arg与Asp难以分离;pH 2.75时,Gly与Arg几乎重叠为一个峰,难以实现完全分离;pH 3.00时,目标化合物的分离度效果和峰形都很好,所以,除15.5~22.0 min,甲酸-甲酸铵缓冲溶液的pH值选择为3.00。
综上所述,实验选择20 mmol/L的甲酸-甲酸铵缓冲溶液为流动相,15.5~22.0 min范围内缓冲溶液pH值为2.25,梯度洗脱程序中其他时间的缓冲溶液pH 3.00。
2.2.3 检测波长的选择
取配制好的19种氨基酸和Tau混合标准溶液(100.0 μmol/L),用Waters H-CLASS超高效液相色谱仪配备的Waters二极管阵列检测器于190~400 nm的波长范围内进行紫外光谱全波长扫描,得光谱图见图4。可以看出,目标化合物的最大吸收波长均为260 nm,故选择260 nm为最佳波长。
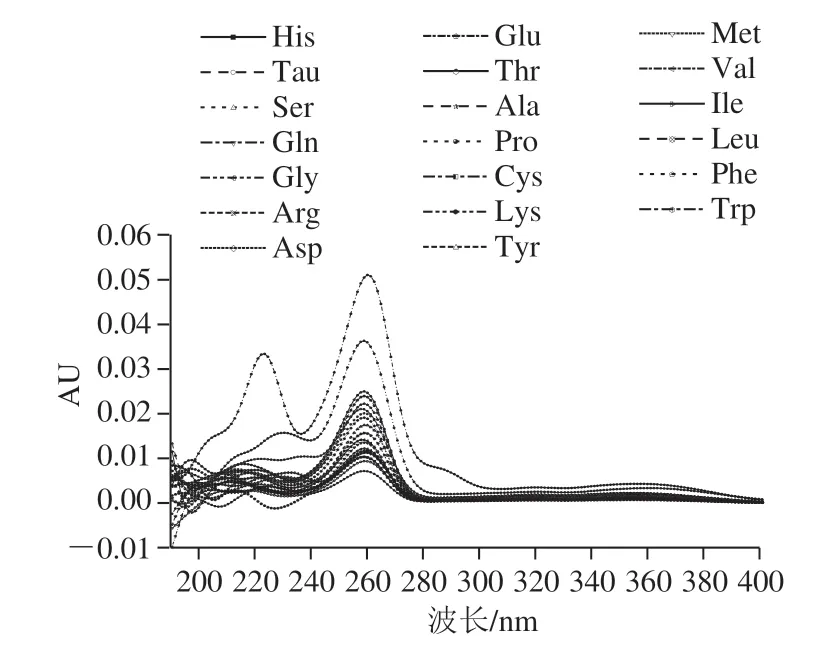
图4 19种氨基酸和Tau(100.0 μmol/L)的光谱图Fig. 4 Ultraviolet absorption spectra of 19 amino acids and taurine (100.0 μmol/L)
2.3 方法学考察
2.3.1 线性范围、检出限和定量限测定结果
将1.3.1节步骤配制的标准系列工作液按1.3.2.2节衍生后,按质量浓度由低到高的顺序依次经超高效液相色谱进行分析测定,以各目标化合物的峰面积(Y)对其质量浓度(X)作标准曲线,线性相关系数均大于0.999。按1.3.2节前处理方法处理后,以RSN≥3得到目标化合物的检出限,以RSN≥10得到目标化合物的定量限 (表2)。图5为19种氨基酸和Tau标准溶液(100 μmol/L)、无乳糖配方特殊医学用途婴儿配方食品及其加标水平为100 μmol/L的超高效液相色谱图。
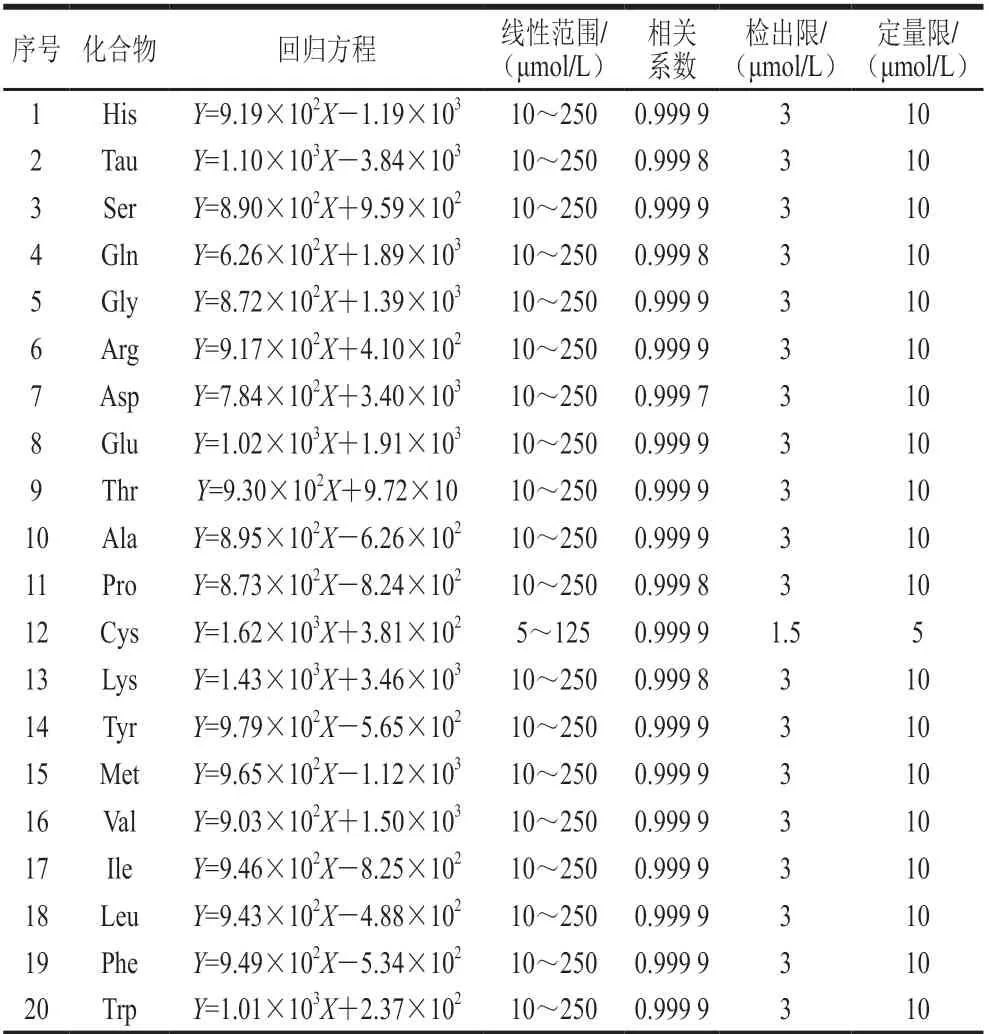
表2 19种氨基酸和Tau的线性回归方程、线性范围、相关系数、 检出限及定量限Table 2 Linear equations, linear ranges, correlation coefficients, and limits of detection and quantitation for 19 amino acids and taurine
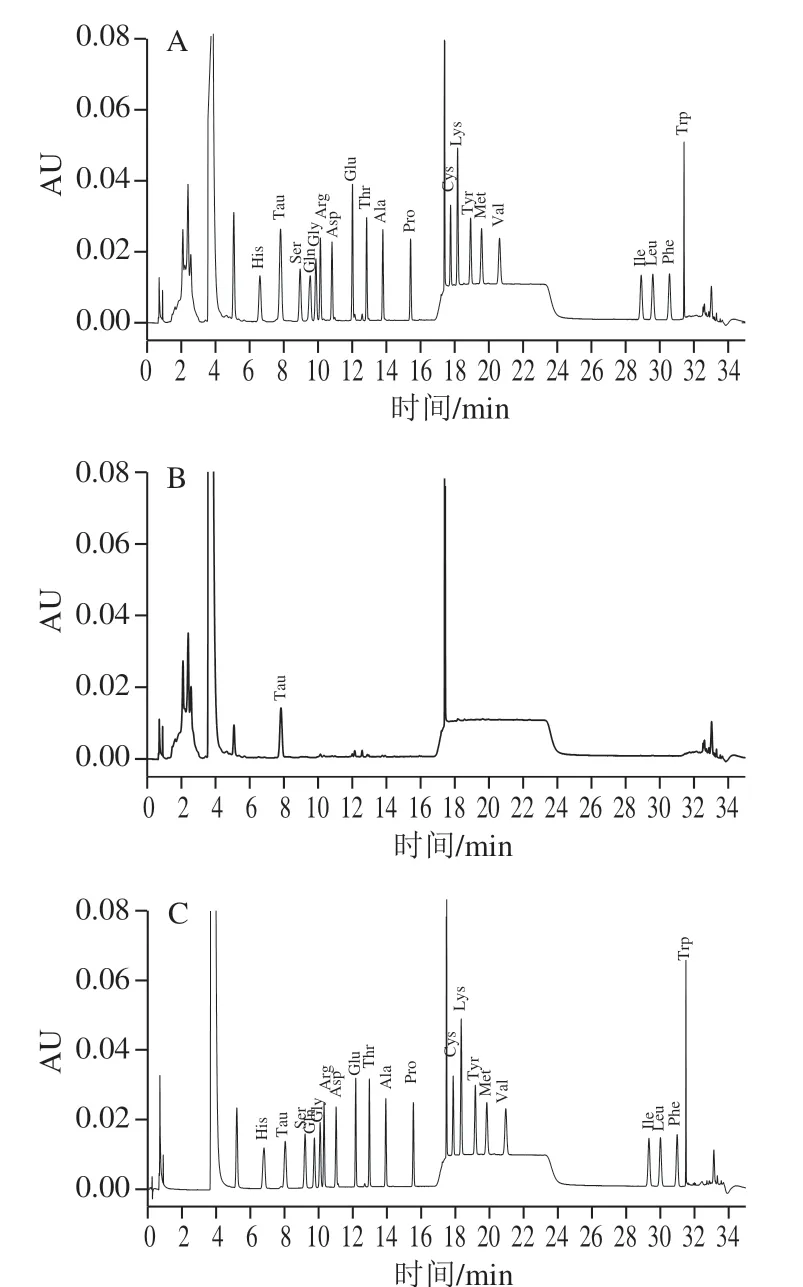
图5 19种氨基酸和Tau样品标准溶液与样品及其加标的 超高效液相色谱图Fig. 5 HPLC chromatograms of mixed standard solution of 19 amino acids and taurine, blank sample and spiked sample
2.3.2 回收率和精密度实验结果
选取某早产/低出生体质量婴儿配方和氨基酸配方为代表进行特殊医学用途婴儿配方食品回收率实验。样品中未检出的目标化合物按其定量限、5 倍定量限、10 倍定量限,已知含量的目标化合物按其含量的50%、100%、150%,分别添加3个不同水平的标准溶液进行回收率实验,各个水平平行测定6 次。由表3可知,加标回收率在90.16%~109.84%之间,相对标准偏差在1.03%~4.77%之间。
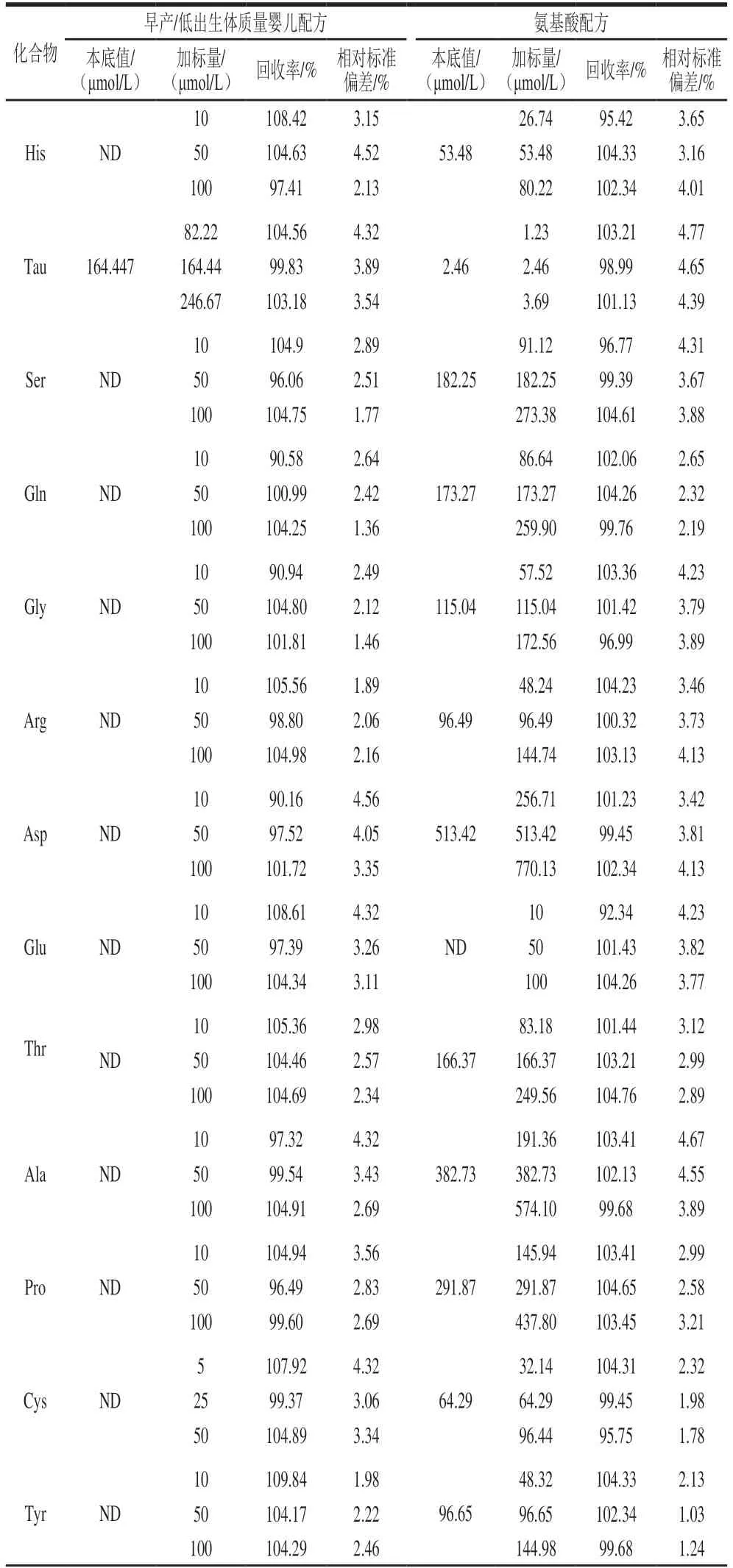
表3 方法的回收率和精密度(n=6)Table 3 Recoveries and RSDs for the developed method (n = 6)
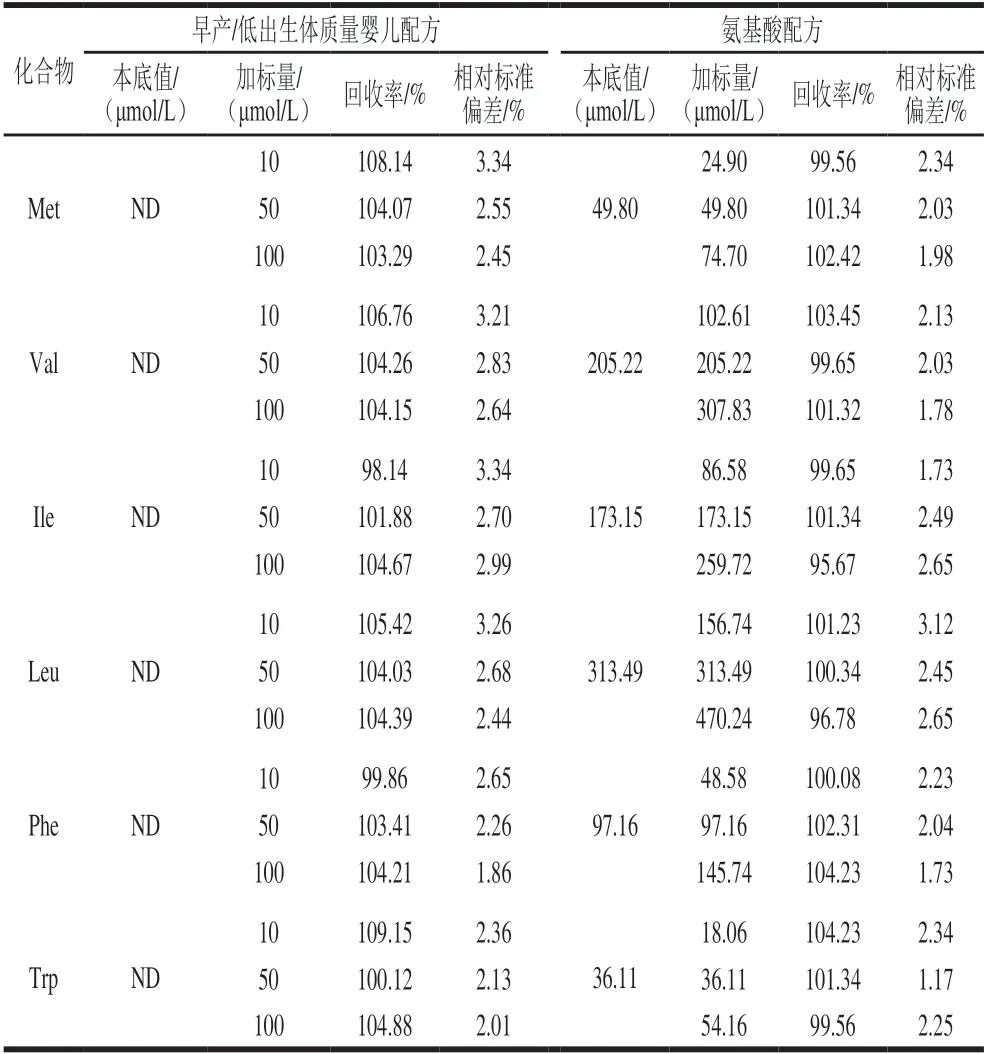
续表3
2.3.3 实际样品的测定结果
应用本方法对市售不同配方的特殊医学用途婴儿配方食品:无乳糖配方、乳蛋白部分水解配方、乳蛋白深度水解配方、氨基酸配方、早产/低出生体质量婴儿配方、氨基酸代谢障碍配方、母乳营养补充剂中的19种氨基酸和Tau进行分析(表4)。结果表明,特殊医学用途婴儿配方食品中均含有Tau,所测得的含量与其产品标签标示基本一致;乳蛋白深度水解配方、氨基酸配方和氨基酸代谢障碍配方中均含有大量游离氨基酸,且与氨基酸配方和氨基酸代谢障碍配方配料表中氨基酸种类相符。
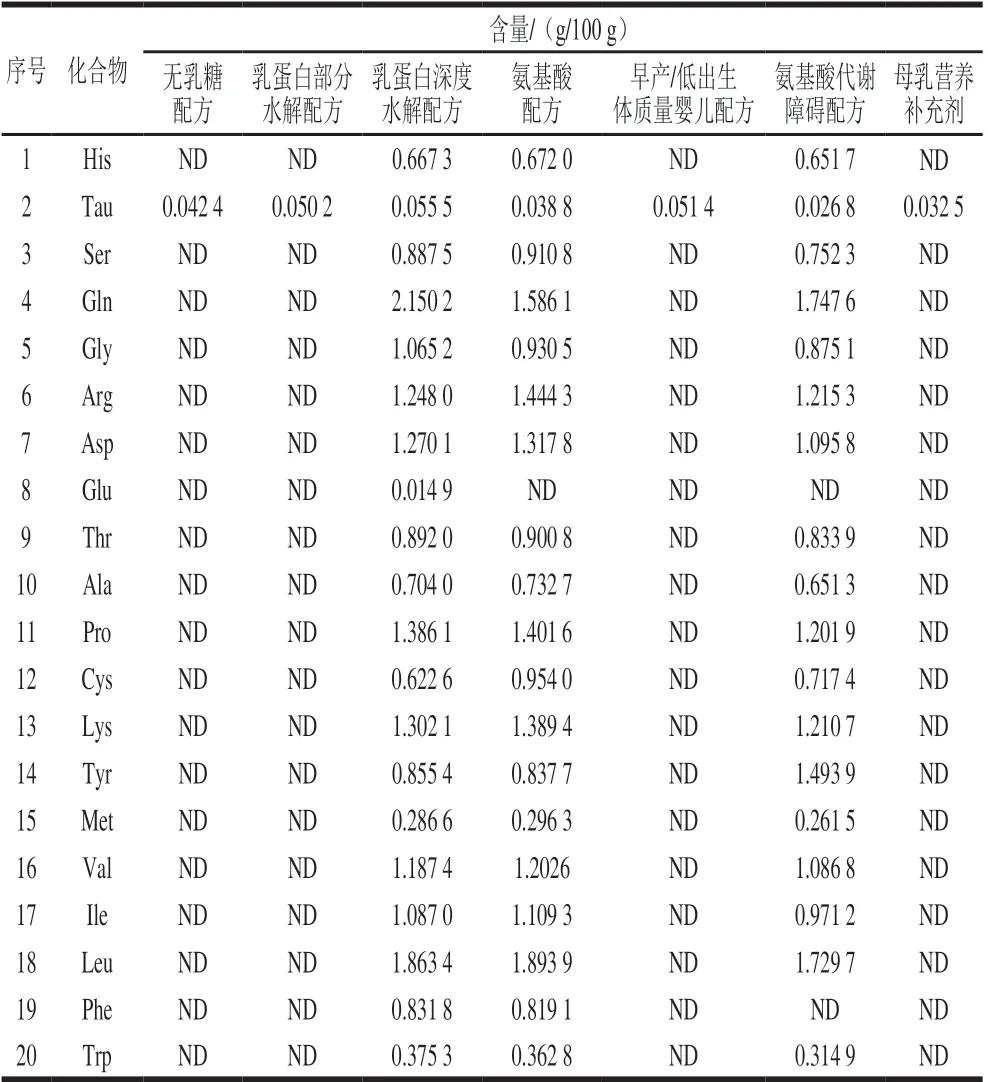
表4 特殊医学用途婴儿配方食品中19种氨基酸和Tau的含量Table 4 Contents of 19 amino acids and taurine in formulas for special medical purpose intended for infants
3 结 论
本实验系统考察不同沉淀条件和不同提取条件对氨基酸和Tau提取的影响,优化流动相种类、浓度、pH值和色谱柱对19种氨基酸和Tau分离的影响,采用操作简单、衍生速度快的AQC为衍生试剂,建立了超高效液相色谱法测定特殊医学用途婴儿配方食品中19种游离氨基酸和Tau的分析方法。
本方法前处理采用α-淀粉酶酶解后调pH值去除蛋白等杂质,操作简单;针对不同氨基酸的性质,采用不同酸度流动相进行梯度洗脱,实现19种氨基酸和Tau的完全分离。该方法简单易行,选择性好,结果准确可靠,灵敏度高;适用于特殊医学用途婴儿配方食品中游离氨基酸和Tau的测定。
本研究填补了殊医学用途婴儿配方食品中氨基酸和Tau的检测标准空白和技术缺失,满足了殊医学用途婴儿配方食品的质量控制和监管的技术要求,为产业健康发展提供了技术支持。
