微生物法测定维生素片中的泛酸含量
2022-03-05高志城周敏张任广
高志城 周敏 张任广
摘 要:目的:建立适用于定量测定维生素片中泛酸含量的微生物法。方法:植物乳杆菌(ATCC8014)繁殖速度与泛酸的含量呈正比关系,且在一定浓度范围内呈线性关系,对培养后菌悬液的吸光度与泛酸标准工作曲线进行比较,定量测定出维生素片中的泛酸含量。结果:微生物法测定泛酸的线性范围为0~98.0 ng,其标准曲线多变量相关系数为0.991 29,测定维生素片中的泛酸含量的相对标准偏差(RSD)为2.23%,回收率为91.4%~103.4%。结论:微生物法测定维生素片中的泛酸含量操作简便、稳定可靠、重复性好。
关键词:微生物法;泛酸;维生素片;植物乳杆菌
Determination of Pantothenic Acid in Vitamin Tablets by Microbiological Method
GAO Zhicheng, ZHOU Min, ZHANG Renguang
(Institute of Analysis, Guangdong Academy of Sciences (China National Analytical Center, Guangzhou), Guangzhou 510000, China)
Abstract: Objective: A microbiological method for quantitative determination of pantothenic acid in vitamin tablets was established.Method: The growth rate of Lactobacillus plantarum (ATCC 8014) was in direct proportion to the content of pantothenic acid,and showed a linear relationship within a certain concentration range. According to the comparison between the absorbance of bacterial suspension after culture and the working curve of pantothenic acid standard, the content of pantothenic acid in vitamin tablets was determined quantitatively. Results: The linear range of the microbiological method was 0~98.0 ng and the multivariate correlation coefficient of the standard curve was 0.991 29. The relative standard deviation (RSD) of the determination of pantothenic acid content in vitamin tablets was 2.23% and the recovery rate was 91.4%~103.4%. Conclusion: The microbiological method for the determination of pantothenic acid in vitamin tablets is simple, reliable and repeatable.
Keywords: microbiological method; pantothenic acid; vitamin tablets; lactobacillus plantarum
泛酸常用的檢测方法有微生物法[1]、微孔板试剂盒法[2]以及仪器分析法。仪器分析法包括液相色谱-串联质谱法[3]、火焰原子吸收法[4]、超高效液相色谱-同位素稀释质谱法[5]等。微生物法测定泛酸具有更高的灵敏度和更低的检出限,微生物法的实际应用更普遍,且是我国食品安全国家标准中关于食品中泛酸含量的推荐测定方法。本研究参考《食品安全国家标准 食品中泛酸的测定》
(GB 5009.210—2016)方法,通过改善相关试验条件,建立标准曲线,进行重复性试验以及加标回收试验,建立适用于测定维生素片中泛酸含量的微生物法。
1 材料与方法
1.1 材料与试剂
试验菌株为植物乳杆菌(ATCC8014,广东省微生物菌种保藏中心);泛酸钙标准品(纯度94.3%,Dr.Ehrenstorfer GmbH,德国);泛酸测定用培养液(青岛高科技工业园海博生物技术有限公司)。
1.2 仪器与设备
紫外分光光度计(UV-2700型,岛津仪器苏州有限公司)。
1.3 试验方法
1.3.1 泛酸标准溶液的配制
准确称取22.60 mg泛酸钙标准物质,按标准
GB 5009.210—2016制成泛酸标准储备液
(39.2 µg/mL)、泛酸标准中间液(0.98 µg/mL)和
泛酸标准工作液(19.6 ng/mL)。标准工作液现配现用。
1.3.2 接种液的制备
菌种复苏为将用磁珠保存的植物乳杆菌(ATCC8014)直接划线于MRS琼脂培养基平板上,36 ℃厌氧培养72 h。将活化后的植物乳杆菌从琼脂平板上挑取一环接种于乳酸菌肉汤中,36 ℃培养
24 h。试验前一天,取2 mL泛酸标准工作液和4 mL泛酸测定用培养液混匀,分装于2支5 mL试管中,塞好棉塞,于121 ℃高压灭菌5 min后,即为种子培养基。冷却后用移液枪将活化后的菌悬液0.5 mL转种至2支种子培养基中,于36 ℃恒温培养箱中培养20~24 h。取出后3 000 r/min离心10 min,弃上清液,无菌操作下用已预先灭菌的生理盐水淋洗2次,3 000 r/min离心10 min,弃上清液。再加入3 mL灭菌生理盐水,振荡混匀,稀释,使用分光光度计,于550 nm处,以生理盐水为对照管调零,测定菌液的透光率为60%~80%,制成接种液。
1.3.3 样品前处理
称取适量试样0.2~2.0 g至100 mL锥形瓶中,加入80 mL乙醇溶液,超声振摇提取4 h以上,用水定容至100 mL。样品超声后先用0.2 µm无菌滤膜进行过滤,根据试样中泛酸含量,用水对试样提取液进行适当稀释(F),使稀释后试样提取液中泛酸浓度约为20 ng/mL。
1.3.4 标准系列管的制备
取试管分别加入泛酸标准工作溶液0 mL、
0.50 mL、1.00 mL、1.50 mL、2.00 mL、2.50 mL、3.00 mL、3.50 mL、4.00 mL、4.50 mL和5.00 mL于试管中,补水至5.0 mL,相当于标准系列管中0 ng、9.8 ng、19.6 ng、29.4 ng、39.2 ng、49.0 ng、58.8 ng、68.6 ng、78.4 ng、88.2 ng和98.0 ng的泛酸,再加入
5.0 mL泛酸测定用培养液,混匀,每个浓度做3个平行。
1.3.5 待测液的制备
分别取待测液1.0 mL、2.0 mL、3.0 mL和4.0 mL
加入培养管中,补水至5 mL,再加入泛酸测定用培养液5 mL,反应体系为10 mL,混匀,每个浓度做3个平行。
1.3.6 灭菌及接种培养
将所有的标准系列管以及试样系列管塞好棉塞,121 ℃高压灭菌5 min(国家标准要求15 min,灭菌时间过长,培养基颜色过深会对培养后的测量有一定的影响),灭菌后降温到高压灭菌锅可以打开时,立刻将标准系列管和试样系列管拿出,置于预先准备好的冰水中迅速冷却。用移液器向每支测定管中各加50 µL接种液,用涡旋振荡器充分振荡混匀后,(37±1) ℃恒温培养16~20 h,直至达到最大混浊度,即再培养2 h后吸光度值无明显变化。准备一支标准0管(含0 ng泛酸)不接种作为0对照管。
1.3.7 系列管测定
将培养好的标准系列管、试样系列管取出,用厚度为1 cm的比色杯于550 nm处,以未接种0对照管调节吸光度值为0,依次测量标准系列管、试样系列管的吸光度值。测定时,每支试管用漩涡振荡器混合均匀后,立即将试管内培养液移入比色皿内,在波长为550 nm进行测定,待读数稳定30 s后,读出吸光度值A,每支试管的稳定时间要相同。
2 结果与分析
2.1 泛酸的标准曲线
以泛酸标准品溶液的浓度为横坐标,标准品溶液的吸光度值为纵坐标,根据多变量方程,拟合微生物法的标准曲线,回归方程为Y=-1.784 54×
10-6X3+1.482 96×10-5X2+0.035 501 1X-0.070 036 3,多变量相关系数为0.991 29。由于微生物生长的特殊性,随着泛酸浓度的增加,吸光度值的增加会越来越慢,而不是呈直线式增长。因此,采用多变量方程拟合标准曲线,更符合试验菌株的实际生长情况,可得到更准确的试验结果。
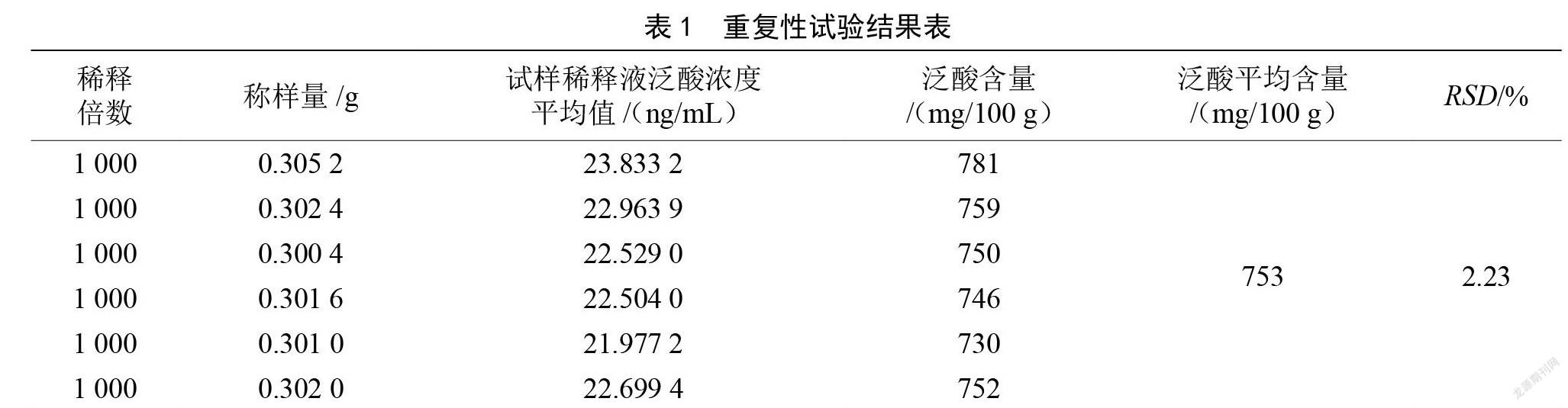
2.2 方法的重复性试验
用微生物法对同一维生素片测定6次,泛酸含量测定结果见表1。由表1可知,6次测定的泛酸含量平均值为753 mg/100 g,相对标准偏差为2.23%,说明该方法的重复性良好,试验结果可靠。
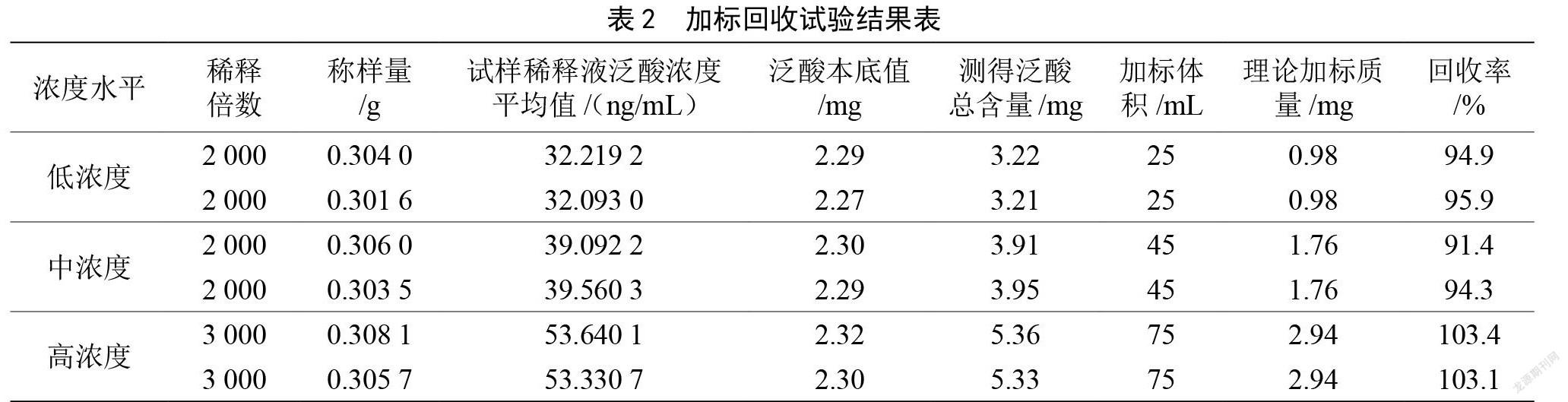
2.3 方法的回收率试验
称取已知泛酸含量的维生素片进行回收率试验,先对试验样品进行前处理,按表2精确地加入浓度为39.2 µg/mL的泛酸标准溶液,按照1.3.6的方法培养后,测定泛酸的含量。3个不同浓度水平下的回收率为91.4%~103.4%,平均回收率为97.2%,说明该方法具有较高的回收率,可以满足多种维生素片中泛酸含量的测定需求。
2.4 讨论
由于微生物法的灵敏度较高,对试验人员和试验用器具的要求较严格,在实际检验过程中要注意以下2点。①灭菌时,由于维生素测定用培养基的特殊性,灭菌时间不宜过长,要严格按照培养基配制说明操作,灭菌结束后一旦达到高压灭菌锅可以打开的温度,应立即取出试验系列管放入冰水浴中冷却,尽量避免有色物质产生。②使用分光光度计来调整接种液浓度,同时也对培养时间进行控制。接种液浓度过高、培养时间过长易导致菌体凝聚、沉淀,用漩涡振荡器无法将其打散,用分光光度计测量时无法得到均匀的菌悬液,造成结果偏差大,因此可通过降低接种液浓度和缩短培养时间以解决菌悬液凝聚的问题,提高试验的准确性。
3 结论
本研究通过改善菌种复苏的条件、确定适宜的接种液浓度、選择合适的维生素片中泛酸测定用培养基以及缩短标准系列管和试样系列管的灭菌时间等措施,得到了满意的试验结果,解决了试验过程中菌种活力不够、菌体凝集沉降、有色物质产生等导致的试验数据不稳定、重复性差的问题,为建立维生素片中泛酸含量的测定提供了有效的理论依据。但本研究还存在一些问题。由于整个试验持续时间较长,为避免菌种质量带来不良影响,每次试验都用新的磁珠保存的植物乳杆菌,而非采用之前保存的菌悬液,整个检验周期需5~6 d。如果可以直接低温冷冻保藏菌种在适宜的培养基中,保证菌种的活力就可以缩短菌种复苏时间,从而缩短检测周期,3~4 d就可以得到结果。微生物法具有较高的灵敏度和较低的检出限,在检验泛酸含量较低的样品时,优于高效液相色谱法。本研究提高了微生物法测定泛酸的数据的稳定性,为泛酸含量的实际检测工作提供了有效参考和数据支持。
参考文献
[1]中华人民共和国国家卫生和计划生育委员会.食品安全部国家标准 食品中泛酸的测定:GB 5009.210—2016[S].北京:中国标准出版社,2016.
[2]赵平,郭莹莹,王玉芝,等.微孔板式微生物法测定婴幼儿配方乳粉中泛酸含量[J].食品安全质量检测学报,2021,12(8):3294-3299.
[3]王亚慧,侯海荣,陈明涛,等.液相色谱-串联质谱法对锡林浩特地区马奶中泛酸含量的测定[J].农产品加工,2019(24):66-68.
[4]张晓栋,范婷婷.火焰原子吸收法测定复方利血平片中的泛酸钙[J].华西药学杂志,2019,34(1):79-80.
[5]孙宇,周璇,朱桂芳,等.超高效液相色谱-同位素稀释质谱法测定食品中的泛酸[J].食品安全质量检测学报,2021,12(16):6594-6599.
