食源性致病菌检测免疫传感器研究进展
2022-03-04吴有雪吴美娇田亚晨方水琴
杨 昊, 吴有雪, 吴美娇, 刘 涛, 李 斌, 田亚晨, 刘 程, 方水琴, 刘 箐
上海理工大学健康科学与工程学院, 上海 200093
据世卫组织报道,每年食源性疾病会导致40多万人死亡,其中5岁儿童以下死亡病例约占三分一[1]。因此,食品安全已成为全球首要关注的公共安全卫生问题。造成人体食源性疾病的原因有很多,主要包括食品中的病毒、细菌、寄生虫、毒素和化学物质等,其中食源性致病菌是主要因素之一。目前,食源性致病菌主要有大肠杆菌O157:H7、单核细胞增生李斯特氏菌、沙门氏菌、金黄色葡萄球菌、志贺氏菌等[2]。1996年,日本爆发了大肠杆菌O157:H7食品污染事件,造成6000多人感染,并导致2人死亡。2005年,西班牙发生了预煮鸡沙门氏菌污染事件,导致2000多人死亡[3]。食源性致病菌污染不仅能对人体健康造成危害,还会对社会经济带来影响。随着抗生素的滥用,细菌耐药性逐渐变强,从而导致食品安全问题的加重。因此,实现食源性致病的即时检测,对预防食源性致病菌感染,降低由食源性造成的损失至关重要。
由于传统的食源性致病菌检测方法具有操作繁琐、耗时长等缺点,无法满足即时检测的目的[4],因此亟需一种快速检测技术的建立。免疫传感器具有检测过程简单、便携、特异性强、灵敏度高等优点,可弥补食源性致病菌检测方法中的不足[5]。本文首先简述了传统食源性致病菌检测方法,然后详细分析了免疫传感器各类技术及其在食源性致病菌检测的应用,以期能够为食源性致病菌检测领域的研究人员提供参考和帮助。
1 传统检测技术
食源性致病传统检测方法主要包括分离培养与生化鉴定法、聚合酶链式反应以及免疫学检测法。分离培养法由于检测限低、可信度高、操作简单,是检测食源性致病菌的金标准[6]。但该方法需要进行微生物的分离培养和多种鉴定实验,费时费力。聚合酶链式反应(Polymerase chain reaction,PCR)是通过检测目标致病菌的特定核酸序列来达到检测食源性致病菌的目的。该方法具有特异性强、灵敏度高,检测时间短等显著优点,但需要依赖专业的操作人员和昂贵的PCR仪器,使其无法应用在低资源地区[7]。免疫学检测方法是一种基于抗原抗体特异性结合的方法,主要包括免疫扩散、酶联免疫吸附法(Enzyme linked immunosorbent assay,ELISA)、胶乳聚集实验、免疫层析法等[8]。免疫扩散是通过抗原抗体在凝胶介质中反应产生沉淀线来实现病原体检测的。该方法灵敏度低,操作繁琐,在食源性检测中应用较少[9]。ELISA是基于抗原抗体特异性反应和高效酶标记技术相结合的免疫学检测方法。该方法虽然缩短了检测的时间,降低了检测成本,但灵敏度较低,且易受外界环境干扰而产生假阳性[10]。免疫层析法是通过带有标记的抗原或抗体在硝酸纤维素膜上的检测区域发生免疫反应后产生可视化颜色的现象来实现致病菌的检测。该方法实现了食源性致病菌的实时便携性检测,将检测时间缩短至5 min~10 min,但依赖于肉眼进行结果的判读,检测灵敏度不高[11]。
2 免疫传感器技术
生物传感器主要包括识别元件、换能器和放大元件三部分。在检测时,目标分析物与识别元件特异性结合产生生物化学信号,再利用换能器将化学信号转化为光、电等可测量的信号,最后通过放大元件实现信号的放大输出,从而实现对目标分析物的高灵敏度检测。根据识别元件的不同可以将生物传感器分为免疫传感器、DNA传感器、微生物传感器等(图1)。免疫传感器是基于抗原抗体特异性结合来实现致病菌检测的,具有特异性强、检测时间短、灵敏度高等优势。该方法是免疫化学领域的主要发展方向,在食源性致病菌检测中应用广泛[12]。根据免疫传感器转化信号的不同,可以将其分为光学免疫传感器和电化学免疫传感器。
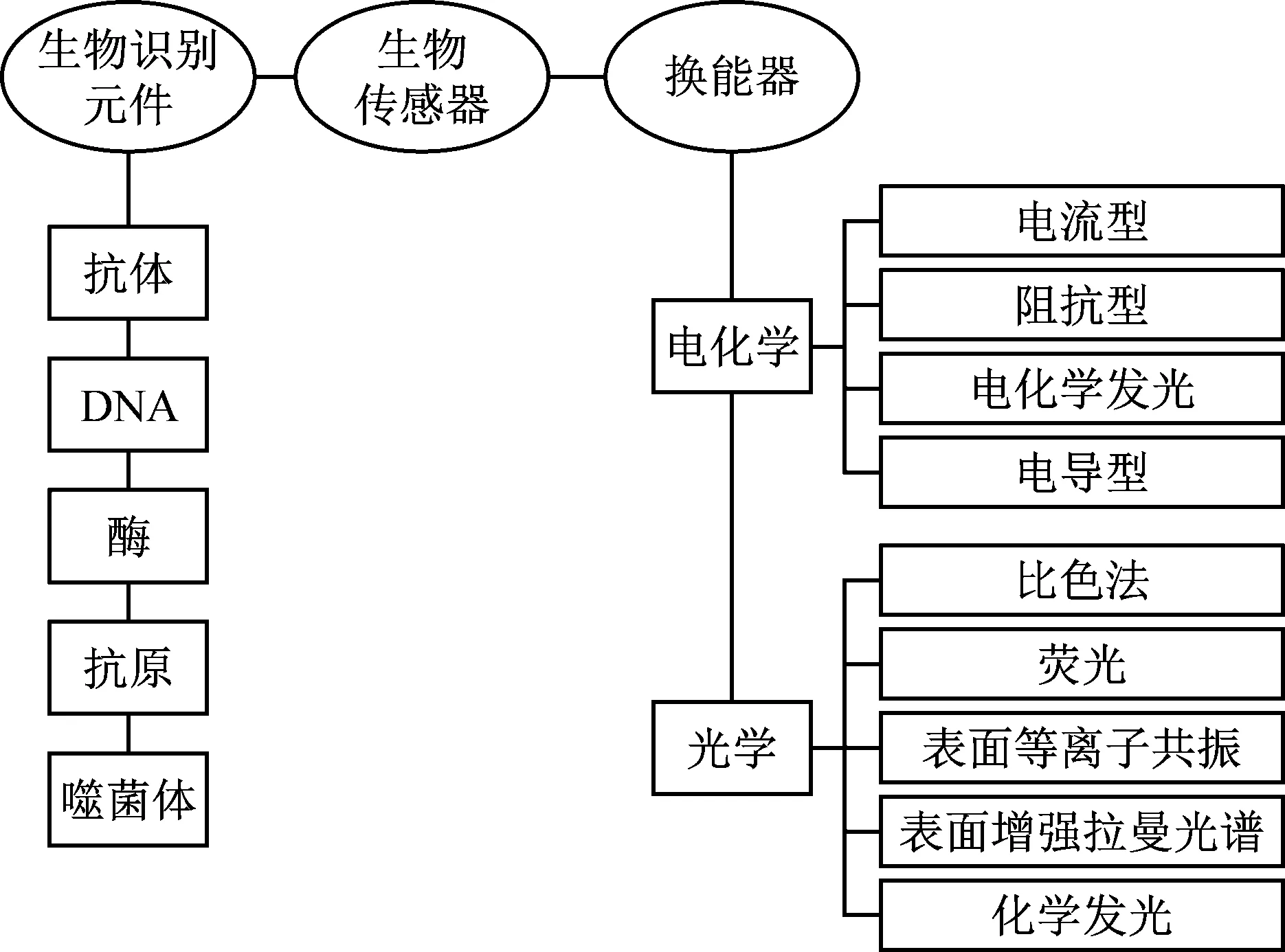
图1 生物传感器组成和类型
2.1 光学免疫传感器
光学免疫传感器是利用光学材料修饰抗原或抗体,在发生免疫反应时,通过光的散射、折射、反射、吸收将产生的化学信号转化为光学信号的一种装置。该方法具有灵敏度高,抗干扰能力强等优点。目前,常见的光学免疫传感器主要包括比色免疫传感器、荧光免疫传感器、表面等离子共振免疫传感器和表面增强拉曼光谱免疫传感器等。表1总结概述了各类光学免疫传感器在食源性致病菌检测中的应用。

表1 不同光学免疫传感器在食源性致病菌中的应用
2.1.1比色免疫生物传感器
比色法是基于溶液对光的原则性吸收建立的方法。比色免疫生物传感器通过建立抗原抗体反应与比色物质颜色变化关系,以实现定量检测的目的,此外这种方法可以通过肉眼观察从而判断实验结果,大大提升了检测的效率。近年来,酶、金纳米颗粒(Gold nanoparticle,AuNPs)和二氧化硅纳米颗粒广泛应用于比色免疫分析中,提高了检测灵敏度[20]。
金纳米棒(Gold nanorods,GNR)具有被氧化后显示出颜色改变的特性[21],基于此,GUO等[22]利用磁性纳米粒子与鼠伤寒沙门氏菌抗体偶联,通过旋转式磁选机对靶标菌进行富集,然后与带有过氧化氢酶标记的抗体偶联形成双抗夹心复合物催化体系中的H2O2,剩余的H2O2与辣根过氧化物酶(Horseradish peroxidase,HRP)发生反应生成具有强氧化能力的羟基自由基来蚀刻GNR,通过检测上清中的吸光度变化,来检测鸡肉样品中的鼠伤寒沙门氏菌。该方法检测灵敏度为35 CFU/mL,检测时间3 h,实现了沙门氏菌的高灵敏度检测,但该过程需要经过过氧化氢酶催化H2O2和HRP催化H2O2蚀刻GNR两次反应,因此检测时间较长。基于此,VERDOODT等[13]开发了一种抗原抗体结合使AuNPs聚集发生颜色的改变的方法,来检测金黄色葡萄球菌。该方法只需通过N-羟基琥珀酰亚胺(NHS)和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)活化羧基,使抗体与AuNPs偶联,再加入靶标抗原即可实现金黄色葡萄球菌的检测。检测时间缩短至1 min,检测灵敏度为100 CFU/mL。虽然酶和金纳米粒子在免疫传感器中的使用提高了检测的灵敏度,但这两种材料具有操作条件苛刻、价格昂贵、使用寿命短等缺陷,在实际应用中存在着不足[23]。有研究人员发现,有色二氧化硅纳米颗粒具有合成容易、生产成本低、亲水表面大等优点[24],基于此,SHAMS等[25]利用超顺磁性纳米颗粒和活性蓝二氧化硅纳米颗粒分别标记靶标的多克隆抗体(Polyclonal antibody,PAb)和单克隆抗体(Monoclonal antibody,MAb)形成双抗体夹心模式来检测食品中的布鲁氏菌。活性蓝二氧化硅纳米颗粒被体系中的NaOH溶液蚀刻后,活性蓝染料释放出来使溶液变蓝。经过磁分离操作后测量上清液的染料吸光度,可以定量检测布鲁氏菌。该方法检测限为450 CFU/mL,实现了布鲁氏菌的高灵敏度检测,并且该传感器在120 d内性能保持良好,具有较好的稳定性。
2.1.2荧光免疫传感器
荧光免疫传感器是基于荧光现象,将荧光物质标记抗原或抗体实现检测可视化的一类装置。目前,常用的荧光标记物有荧光染料、量子点、荧光金属纳米粒子等。这类荧光物质具有较高的光稳定性、较强的荧光信号和良好的生物相容性等优点,常作为蛋白标记材料广泛应用于免疫传感器中[26]。
GUO等[27]利用三种有机荧光染料(7-羟基香豆素、异硫氰酸荧光素和罗丹明)分别标记克罗诺杆菌、单核细胞增生李斯特氏菌和大肠杆菌O157:H7,形成有色细菌,然后通过蛋白G将三种菌的MAb固定在96孔板底部,最后将这三种目标菌污染的牛奶样品和三种有色细菌依次加入孔中,利用有色细菌与无荧光菌的竞争,实现了对三种菌的多重检测,检测限为103CFU/mL。本课题组曾利用异硫氰酸荧光染料标记大肠杆菌O157:H7和其特异性抗体,用于横向流动免疫分析中双标记放大信号检测大肠杆菌O157:H7。固定在结合垫位置的荧光抗体与样品垫上的荧光细菌结合后层析至检测线,被检测线上的另一株大肠杆菌O157:H7抗体所捕获。对检测线区域进行紫外激发光照射后,可以看到明亮的黄色条带,该方法检测灵敏度为104CFU/mL,检测时间缩短至5 min~10 min[28]。此外,量子点的应用,开创了食源性致病菌检测的新方法。DEHGHANI等[29]开发了一种氧化石墨烯(Graphene oxide,GO)与石墨烯量子点(Graphene quantum dot,GQD)发生荧光共振能量转移的方法来检测食品样品中空肠弯曲杆菌。GQD与抗体偶联后,发生的免疫反应导致GO和GQD之间的距离增大,荧光共振能量转移失败,GQD荧光增强;若溶液中不含有空肠弯曲菌,则GQD与GO通过π-π键发生堆积,产生微弱的荧光现象。该传感器的检测限为10 CFU/mL,检测时间为1.5 h。
2.1.3表面等离子体共振免疫传感器
表面等离子共振(Surface plasmon resonance,SPR)是基于一定波长的光与薄金属表面的电子相互作用后产生强烈共振的现象。其检测原理为病原体与固定在金属表面的抗体特异性结合后,导致金属表面质量增加,从而引起光折射率的改变,产生可测量的信号。表面等离子体共振具有快速、无标记、高灵敏度检测等诸多优点。近年来,通过纳米粒子、生物亲和分子、酶与金属片表面的结合,增强了测量信号,提高了检测灵敏度[30]。FARKA等[31]建立了一种HRP在SPR表面发生催化反应生成沉淀来检测食品样品中的鼠伤寒沙门氏菌。发生免疫反应时,HRP催化4-氯-1-萘酚生成不溶性的苯并-4-氯环己二烯酮,沉淀沉积在SPR表面造成SPR信号的改变。该方法检测限为104CFU/mL,分析时间为10 min。MASDOR等[32]开发了一种在金芯片表面生成硫醇自组装分子膜(Self assembled monolayer,SAM)来定量检测空肠弯曲菌的方法。空肠弯曲菌PAb固定在芯片表面用于捕获目标菌,之后与AuNps标记的空肠弯曲菌MAb形成双抗夹心式检测模式。抗体抗原的结合导致金芯片表面的光折射率发生改变,从而引起SPR信号发生改变。该方法检出限为4×104CFU/mL。为了增加SPR传感器表面抗体的有效固定量,TAHERI等[33]利用蛋白G的生物亲和性在SPR表面定向固定抗霍乱弧菌重组外膜蛋白抗体,大大提高了霍乱弧菌重组表面抗原与PAb之间的结合率,检测灵敏度明显提高,达到43 CFU/mL。
2.1.4表面增强拉曼光谱免疫传感器
拉曼光谱是指一定波长的光与物质分子相互作用后,导致光散射频率改变而产生散射光谱的现象[34]。但这种方法产生的信号比较微弱,限制了其在检测中的使用[35]。表面增强拉曼光谱(Surface enhancement raman spectroscopy,SERS)是将物质固定在金属或纳米粒子表面来增强拉曼散射,其增强效果通常可达到107~1015倍,因此SERS可用于目标分析物单分子层面的超高灵敏度检测[36]。CHATTOPADHYAY等[37]开发了一种乙酰乙酰氧基功能化聚合物磁性纳米颗粒富集沙门氏菌,利用抗体偶联带有SERS标签修饰的AuNPs来检测食品中的大肠杆菌。之后通过对免疫复合物形成过程中产生的拉曼散射强度进行扫描,来定量沙门氏菌的浓度。该免疫传感器实现了沙门氏菌的超高灵敏检测,检测灵敏度可达10 CFU/mL。近几年,有研究人员发现中空AuNPs、花状AuNPs等具有较高的结构均匀性和光学特性,可以结合更多的SERS标签,有效实现信号的放大[38]。基于此特性,HWANG等[39]建立了一种拉曼报告分子标记的空心金纳米球作为SERS检测探针的横向流动免疫分析传感器,来检测葡萄球菌肠毒素B。靶标抗原与带有SERS检测探针的抗体特异性结合,层析至检测区,被检测区固定的另一株特异性抗体所捕获,发生纳米金的聚集而显色。通过对检测区的拉曼信号进行测定,实现了在免疫层析试纸条上的便捷式定量检测。该方法的检测灵敏度为0.001 ng/mL,与传统ELISA检测方法相比,灵敏度提高了三个数量级[40]。此外,在检测体系中引入多种SERS标签,可实现致病菌的多重检测。WU等[41]通过5,5′-二硫代双和4-MBAL两种拉曼报告分子标记AuNPs分别与单核细胞增生李斯特氏菌和鼠伤寒沙门氏菌的MAb偶联作为信号探针,开发了一种基于LFA的多重SERS免疫传感器。该方法检测范围为102~107CFU/mL,检测限为75 CFU/mL,检测时间低至10 min。
2.2 电化学免疫传感器
电化学免疫传感器是通过转换器将免疫反应中的生物信号转换成电流、电阻、电导等可测量信号的一种装置,具有灵敏度高、检测时间短、体型小、成本低等优点,广泛应用于食源性致病菌的检测。电化学免疫传感器在致病菌检测中的检测性能主要依赖于电极材料以及抗体在电极表面的固定。因此通过在传感器中引入石墨烯、碳纳米管、铟锡氧化物、纸基以及交叉型阵列微电极等多种新型材料,能有效提高病原菌检测的灵敏度[42]。电化学免疫传感器根据传导信号可分为电流型、阻抗型、电导型和电化学发光四类,表2总结概述了各类电化学免疫传感器在食源性致病菌检测中的应用。

表2 不同电化学免疫传感器在食源性致病菌中的应用
2.2.1电流型免疫传感器
电流型免疫传感器是基于抗原抗体免疫反应造成的电极表面电子转移或者离子聚合物特性的改变,使电流信号发生改变,通过测量电信号来实现食源性致病菌的检测。SILVA等[49]基于离子聚合物零电流电位测量技术,将抗体固定在AuNPs聚合物膜表面,实现了对沙门氏菌的检测。体系中无靶标菌时,聚合物膜的离子通量为稳定状态,无信号的变化;有靶标菌存在时,传感器表面发生免疫反应阻挡离子的转移,电流信号发生改变。该电流型免疫传感器可在1 h内检测低至6 Cells/mL的沙门氏菌。这种方法实现了沙门氏菌的高灵敏度检测,但无法对沙门氏菌进行定量检测。ROUSHANI等[50]建立了一种利用抗蛋白A鸡IgY抗体作为捕获抗体,与AuNPs偶联后固定在玻碳电极(Glassy carbon electrode,GCE)表面来检测食品中的金黄色葡萄球菌。抗蛋白A鸡IgY抗体能够特异性的结合目标菌,从而阻碍电极表面电子的转移,导致电流发生改变。该免疫传感器的线性范围为10~107CFU/mL,检测限为3.3 CFU/mL,与PCR检测方法相比,灵敏度提高了100倍[51]。HU等[52]利用HRP可以催化氧化态硫氨酸转化为还原态硫氨酸的特性,来检测阪崎肠杆菌。HRP的催化反应可以促进电极表面电子的转移,当电极表面发生免疫时,阻碍了HRP的活性中心和溶液中的硫氨酸之间的催化反应,造成电极的还原峰电流降低。该传感器检测线性范围为102~109CFU/mL,最低检测限为91 CFU/mL。
2.2.2阻抗型免疫传感器
阻抗型免疫传感器是通过对电极溶液施加正弦直流电压,使电极表面出现交流阻抗,当电极表面发生免疫反应时,阻抗信号发生改变,以此来实现致病菌的快速检测。HUANG等[53]为了实现对大肠杆菌的检测,利用戊二醛将抗体固定在牛血清白蛋白偶联的3D-银纳米花工作电极表面,免疫反应发生时,电极表面的阻抗发生改变,以此来检测食品中的大肠杆菌。这种3D-银纳米花结构具有较大的孔隙率、表面积和良好的导电性,有效提高了电化学检测信号,实现了对检测限为102CFU/mL大肠杆菌的高灵敏度检测。虽然Ag、Au等贵金属纳米材料修饰电极,能够提高了检测灵敏度,但成本高,且不易合成。为了解决此问题,SOARES等[54]利用激光诱导聚酰亚胺的方法制备了多孔石墨烯作为工作电极,来高灵敏度检测沙门氏菌。免疫反应导致电极表面的阻抗响应发生改变。该传感器检测限为6 CFU/mL,检测时间为22 min,与Au、Ag纳米颗粒的固定材料相比,灵敏度更高,而且降低了检测成本。此外,随着绿色合成新型材料方法的发展,以半胱氨酸为模板制备的新一代纳米材料也被广泛应用于免疫传感器中[55]。PANDEY等[56]利用半胱氨酸绿色合成了石墨烯包裹的氧化铜-半胱氨酸结构(rGO-CysCu),来作为金电极的修饰材料,通过抗体在金电极表面的固定来检测饮用水样品中的大肠杆菌O157:H7。由于rGO-CysCu修饰电极具有较高的比表面积和电子转移速率常数,因此大大提高了电极的稳定性和灵敏度,检测限低至3.8 CFU/mL。
2.2.3电化学发光免疫传感器
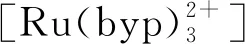
2.2.4电导型免疫传感器
电导型免疫传感器是基于电极表面发生的免疫反应产生的化学信号通过导电聚合物的转换作用,将化学信号转化为可测量的电信号的一种装置,具有检测速度快、体型微小等优点。在检测过程中,电极表面的电导率发生改变,以此来定量检测目标分析物。ICHI等[61]将抗脂多糖蛋白抗体与羧基化的超顺磁性纳米粒子共价偶联后固定在金交叉薄膜电极表面,当抗原抗体结合时,阻碍了电子的转移,使电解池溶液的电导率降低。该传感器可用于多种革兰氏阴性菌的检测,其中用于大肠杆菌检测灵敏度为1 CFU/mL。HAN等[62]提出了一种基于单壁碳纳米管的微流控场效应晶体管免疫传感器,使用这种传感器可以检测磷酸盐缓冲液中流动的金黄色葡萄球菌。在这个检测体系中抗体被固定在功能化的碳纳米管表面,当带负电的细菌流经碳纳米管时导致电流增大,电导率变大。该传感器检测时间为35 min,检测限为150 CFU/mL。
3 总结与展望
近几年,纳米粒子等新型材料在免疫传感器中的应用,增加了抗体表面修饰的信号探针数量,改善了抗体抗原的固定化,提高了检测灵敏度。除了上述提到的免疫传感器方法,还有多种新型的免疫传感器被提出,例如PARK等[63]提出了一种等离子体共振成像免疫传感器芯片,成功实现了肠炎沙门氏菌、产志贺毒素的大肠杆菌和单核细胞增生李斯特氏菌的多靶标检测。该免疫传感器经过菌液富集步骤后,灵敏度可达到1CFU/mL。而且该功能化的生物芯片可重复利用,大大降低了检测成本。集成微流控的应用实现了食源性致病菌的高通量检测。PARK等[64]采用环介导等温扩增和侧向流动装置检测的集成旋转式微流控系统检测水或牛奶中的多种致病菌,检测限为50 CFU/mL。以上免疫传感器在成本、灵敏度、特异性方面得到了很大的提高,并摆脱了对大型仪器的依赖,但免疫传感器在实际应用中仍存在以下几个问题,表3总结了免疫传感器在检测致病菌方面的优缺点。

表3 免疫传感器各技术优缺点
(1) 灵敏性和稳定性制约着免疫传感器的发展,提高免疫传感器的灵敏度和稳定性一直是研究人员研究的的热点。近期,WEI等[65]开发了一种基于ECL标签N-(4-氨基丁基)-N-乙基异鲁米诺和SERS标签罗丹明同时固定Ti3C2Tx MXene 电极材料的ECL/SERS 双模式免疫传感器,实现了对创伤弧菌的检测。ECL的线性范围为1~108CFU/mL,检出限为1 CFU/mL;SERS的线性范围为102~108CFU/mL,检出限为102CFU/mL。Ti3C2Tx MXene 电极材料具有较大的表面积和传输电子的能力,可以使更多的SERS标签和AuNPs负载在电极表面,极大的提高了检测灵敏度,同时这种双模式传感器得到的两组结果可以相互比较,提高结果的真实性。因此我们可以将电化学和光学技术结合起来,开发更多新型纳米材料和微型电极材料,构建双模式免疫传感器,提高检测灵敏度。
(2) 抗体制备比较困难。免疫传感器主要是基于抗体的特异性识别来实现抗原的检测,因此抗体的开发就显得极为重要。目前,抗体的制备具有周期长,操作繁琐,这增加了免疫传感器的构建成本,并且筛选到特异性高的抗体极为困难。由于纳米抗体具有分子量小、亲和力高、能耐高温强酸强碱等优点,提高了抗体的稳定性和特异性,缩短了制备周期。因此我们可以将纳米抗体应用于免疫传感器中,来提高传感器的稳定性和使用时间,同时降低传感器的构建成本。
(3) 大多数检测样品中含有复杂的基质,会干扰免疫传感器的检测结果。因此在检测前需要对检测样品进行复杂的预处理,比较费时费力。另外,在读取数据时需要借助于大型的仪器,不能实现检测的便携性。因此,可以将传感器与计算机、智能手机等联用,开发出一种操作自动化检测系统,使传感器向着智能化、自动化方向发展。
