共轭亚油酸生理功能及微生物合成调控研究进展
2022-03-04王光强艾连中刘欣欣
刘 雷, 窦 慧, 王光强, 艾连中, 刘欣欣
上海理工大学健康科学与工程学院,上海食品微生物工程技术研究中心,上海 200093
共轭亚油酸(conjugated linoleic acid,CLA)是含有共轭双键的十八碳二烯酸的总称[1],是人体无法合成,必须从外界食物中获取但又必不可少的脂肪酸之一。研究表明,CLA 具有增强人体抗氧化能力和免疫能力的作用,并且在调节血液胆固醇和甘油三酸脂水平、防止动脉粥样硬化、促进脂肪氧化分解等方面具有调节作用[2,3]。
CLA主要存在于反刍动物肉制品和乳制品中,在反刍动物瘤胃内通过异构化和生物脱氢反应形成[4],但普遍存在含量较低,无法满足人体需求的问题。后续研究发现,CLA可通过化学合成和生物合成等方法获得。化学合成利用含有亚油酸(linoleic acid,LA)的油脂作物为原料,通过异构化高效合成CLA[5],却存在成本高、步骤繁琐、分离提纯困难等问题。较化学合成相比,通过微生物合成CLA具有更大的潜力[6],微生物合成采用的菌株多为益生菌株,本身对人体无害;且具有选择性合成生物活性CLA的优点,有利于产品的纯化及后续研究。
目前文献集中报道了CLA高产菌株的筛选,并对合成机制进行解析,如植物乳杆菌和痤疮丙酸杆菌的CLA合成机制[7],为进一步研究打下基础。但是不同菌株的CLA合成效率、合成途径都存在差异,且合成产物的构型会受到许多因素的影响,另外关于CLA合成过程的调控机制研究较少。因此本文综述了CLA的多种生理功能和合成方式,阐述能够合成CLA的菌株以及乳酸菌中CLA合成机制,并对提高CLA产量的方法以及调控机制进行探讨。为以后对CLA合成调控机制的研究提供借鉴。
1 共轭亚油酸的生理功能
CLA因具有减肥降脂、抗癌、抗炎和和代谢调节等作用而备受关注(图1),在发酵食品应用领域显示巨大潜力,可应用于饲料和保健品等行业,能够有效提高食品的营养价值。
图1 CLA生理功能
1.1 减肥降脂
CLA进入机体后能够增加体能消耗,因此在体重控制方面可以有效降低体内脂肪沉积。通过服用c9,t11-CLA和t10,c12-CLA能够有效降低甘油三酯水平[8],进一步研究表明以t10,c12-CLA处理原代脂肪细胞时,甘油三酯、游离脂肪酸、神经酰胺、胆固醇酯、磷脂的从头合成被抑制,细胞总脂质含量降低,说明对于降低脂肪积累作用的CLA异构体主要是t10,c12-CLA[9]。通过对代谢途径的研究发现,FGF21(成纤维细胞生长因子21)在脂质代谢、胰岛素敏感性以及肥胖问题等方面发挥重要作用,而FGF21受到PPAR-α(过氧化物酶增殖激活受体-α)的调控。t10,c12-CLA作为PPAR-α的一种高亲和性配体和催化剂,能够间接诱导肝FGF21的表达,从而减少脂质积累,这说明t10,c12-CLA可以通过调节PPAR-α来间接调控FGF21从而控制脂质代谢[10]。
动物实验表明,使用能够产生高浓度t10,c12-CLA的罗伊氏乳杆菌HI120治疗C57BL/6型肥胖小鼠,结果显示小鼠的饮食、体重和血清甘油三酯水平无明显变化,但是血清胆固醇水平明显降低[11]。与热量限制(CR)减轻体重的机制相比,奇怪的是t10,c12-CLA能够实现减脂的同时也会使小鼠的血糖升高[12]。可以肯定的是,t10,c12-CLA的喂食可通过操纵肠道菌群来预防与肥胖相关的代谢紊乱,对肠道菌群有着正调节作用[13]。
t10,c12-CLA能够不同程度的影响脂质水平,在控制体重、降低体脂率方面存在潜力。因此,一些能够合成CLA的菌株可作为潜在的益生菌制剂,通过口服将食物来源的LA在肠道中转化为CLA,从而有助于预防和治疗肥胖症和高脂血症。
1.2 抗癌抗炎
1.2.1抗癌作用
随着研究的不断深入,现已发现CLA对多种癌症细胞存在预防和延缓癌细胞生长作用。CLA能够有效抑制MCF-7乳腺癌细胞的活力,并推测是CLA激活了线粒体凋亡通路所导致[14]。同时,CLA对HCT-116大肠癌细胞的活力也有明显抑制作用,显著降低肿瘤细胞生长和增殖关键基因的表达。此外,CLA通过下调促炎细胞因子和上调抗炎细胞因子的基因表达,使得自由基清除活性明显增加[15]。CLA异构体具有不同生理活性,t10,c12-CLA似乎与能量消耗和脂肪代谢相关。而早期研究表明,c9,t11-CLA能够抑制胃癌细胞的生长,且抑制效果与c9,t11-CLA的浓度呈正相关[16]。与c9,t11-CLA相似,顺9,反11-十八碳二烯酸(c9,t11-CLA)对人结肠癌细胞生长有强抑制作用[17],能够抑制MCF-7乳腺癌细胞增殖和迁移,诱导细胞凋亡[18],同时可以诱导参与人类巨噬细胞脂质代谢基因的表达[19]。
1.2.2抗炎作用
CLA通过抑制促炎因子的表达显著改善小鼠的结肠炎,缓解效果的强弱与菌株合成CLA的能力高度相关[20]。通过短期口服CLA会抑制肠炎沙门氏菌的PhoP/PhoQ双组分信号系统,在致病关键毒力因子的表达上发挥重要作用,进而影响沙门氏菌在小鼠肠道中的定植和全身传播导致的结肠炎[21],这些发现可能有助于设计新的抗沙门氏菌疗法。还有研究表明c9,t11-CLA:t10,c12-CLA(80∶20)混合物不仅对动脉粥样硬化小鼠模型疾病的发展有抑制作用,而且能够减少由此引发的机体损伤等问题[22]。
2 共轭亚油酸合成方式
2.1 化学合成
通常,化学合成CLA的三种方法为:(1) 碱催化异构化;(2) 油酸烯丙醇脱水法;(3) 过渡金属催化LA异构化。其中,使用最广泛的是以LA或富含LA植物油为底物的碱催化异构化反应,其产物为CLA异构体混合物[5]。除了碱性异构化外,以过渡金属为催化剂能够有效地催化生产CLA[23]。这类催化反应条件相对温和,而且产生的反式共轭亚油酸异构体较少,但是也存在催化金属昂贵、回收困难,产物多为CLA异构体混合物等问题。
目前已知一些异构体具有有益的生理活性,而混合物可能会产生未知的生理效应。因此需要对CLA异构体混合物进行提纯,低温结晶法、尿素包合法和制备银离子(Ag+)色谱法等手段都能够有效的提纯CLA异构体[24]。但目前的提纯工艺能耗高,提纯工艺复杂,容易产生未知反应产物等问题都需要进一步的解决。
2.2 生物合成
2.2.1乳、肉制品获取
牛羊等动物通过将饮食中的多不饱和脂肪在瘤胃内脂解,经过异构化和生物氢化催化等步骤生成CLA[4]。但普通饲养的牛羊而得到的乳、肉制品中CLA含量较低,因此可通过对动物喂养添加某些油籽或蔬菜的饲料进行饮食控制,增加LA前体含量水平进而提高CLA含量。补充氢化棕榈油和葵花籽油使得牛奶脂肪中的CLA增加15%~36%[25],SHINGFIELD KJ等发现每天摄入70 g/头的豆油使得牛奶中的CLA浓度达到2%~3%[26]。如前所述,CLA普遍存在于动物肉类和乳制品中,从这些来源中获取CLA相对容易,也是人类较为直接的获取方式。但远低于人体每日需求摄入量,需要更高效的获得方式合成CLA。
2.2.2微生物合成
微生物发酵工艺日渐成熟,CLA也可通过细菌发酵进行生产。许多乳酸菌可将不饱和脂肪酸转化为CLA,特别是将LA转化为CLA[27]。微生物发酵虽然较为高效且反应条件温和,但因为不同菌株的CLA生产能力不同,同样存在产量偏低无法满足商业要求的问题。因此需要对菌种的产能进行鉴定,高产量的菌种更利于商业化生产。另外通过对CLA合成机制的深层次研究,以基因重组技术和异源表达的方式来培养能够满足人类需求的菌种具有较大潜力。
2.2.3乳酸菌CLA合成机制
不断有研究表明乳酸菌中CLA的合成需要多种酶的共同参与,植物乳杆菌AKU1009a中鉴定出CLA-HY(亚油酸水合酶)、CLA-DH(短链氢化酶/氧化还原酶)和CLA-DC(乙酰乙酸脱羧酶)共同作用才能使LA合成CLA[28]。同样,植物乳杆菌ZS2058通过MCRA(肌球蛋白交叉反应抗原)、DH和DC编码的三组分亚油酸异构酶系统经多步反应催化LA转化为CLA[29], 如今乳酸菌中CLA和CLNA生产中涉及的酶及酶活性已被阐明[30]。
亚油酸首先在CLA-HY 催化下发生水合作用形成10-羟基-顺式-12-十八烯酸(10-HOE),10-HOE再经脱水、双键移位、水合、脱水等多步反应,最终转化为 c9,t11-CLA。植物乳杆菌α-烯醇化酶(ENOLASE)在亚油酸生物加氢的复杂代谢中具有辅助作用,通过10-羟基-顺式-12-十八烯酸(10-HOE)的脱水和异构化催化生成具有生物活性的c9,t11-CLA[31]。这也进一步解释了乳酸菌中产生CLA的相关机制,为下一步合成调控奠定基础(图2)。
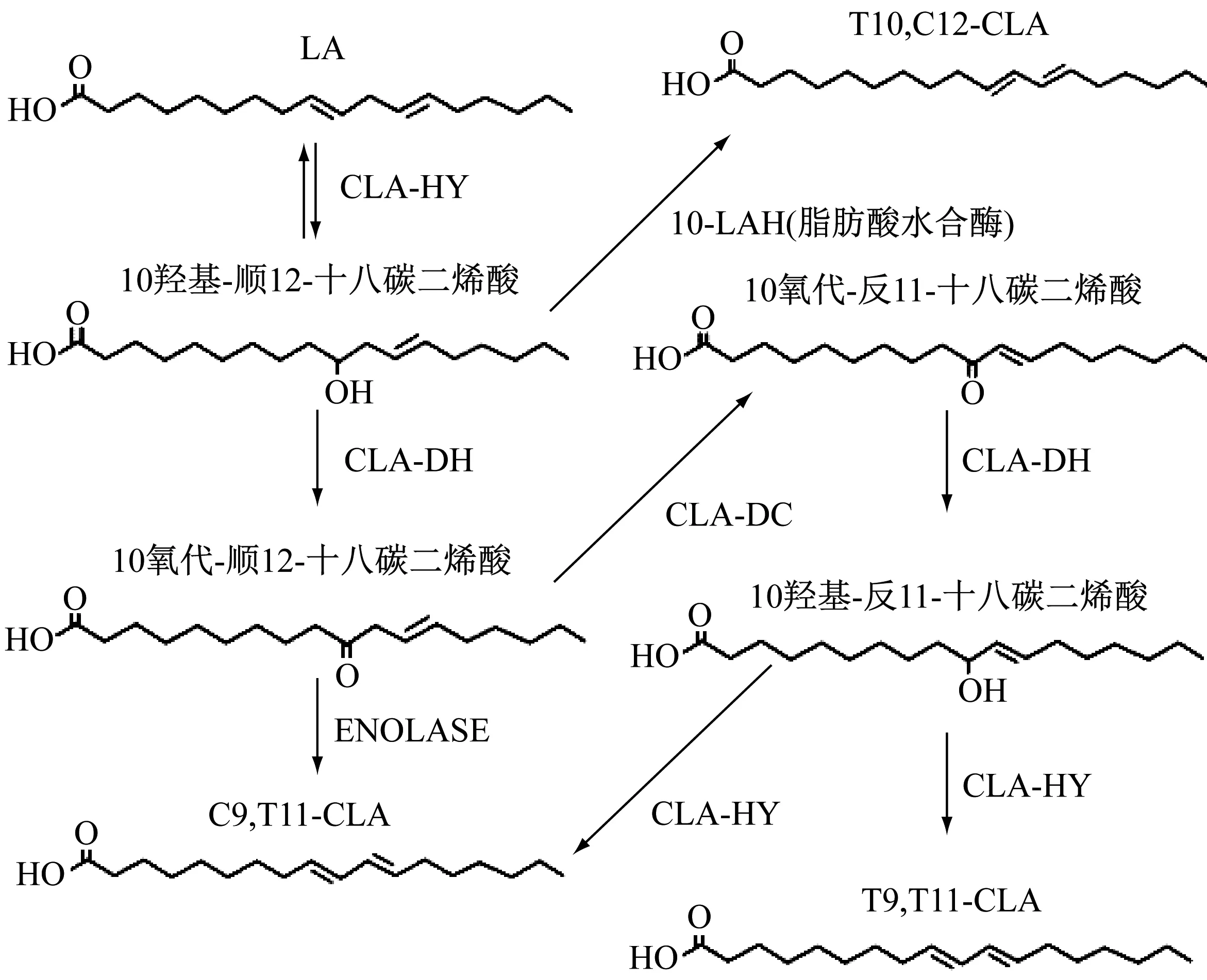
图2 乳酸菌CLA合成机制
3 不同菌株的共轭亚油酸合成能力
目前研究中多种细菌都能将游离LA转化为CLA,如溶纤维丁酸弧菌、植物乳杆菌、干酪乳杆菌、双歧杆菌、痤疮丙酸杆菌和费氏丙酸杆菌。但不同菌株的合成能力有所差异,因此筛选高产菌株有利于满足商业化需求,同时能够生产单一CLA异构体的菌株将减少纯化步骤,为生产带来便利。
3.1 瘤胃细菌
瘤胃细菌是指存在于牛羊等反刍动物瘤胃中细菌的总称,其中溶纤维丁酸弧菌A38能够高效产生CLA,可将40%的LA转化为CLA,其中95%为c9,t11-CLA[32]。COAKLEY M及其同事首先报道了双歧杆菌产生CLA的能力,其中c9,t11-CLA是CLA的主要异构体[33],短双歧杆菌LMC520对LA的转化率高达90%,对单甘酯的转化率为78.8%[34]。痤疮假单胞菌ATCC6919能催化高浓度LA合成t10,c12-CLA[35]。埃氏巨型球菌YJ-4也能催化游离LA转化生成35%的CLA,其中接近85%的成分为t10,c12-CLA[36]。
3.2 乳酸菌
乳酸菌作为人体肠道正常菌群,具有多种益生特性,能够选择性合成益生功能更强的c9,t11-CLA和t10,c12-CLA活性异构体,在食品行业具有广阔应用前景。其中,植物乳杆菌AKU1009a的转化率高达85%[37]。植物乳杆菌JCM1551以蓖麻油酸为底物也能积累高达2700 mg/L的CLA[38]。植物乳杆菌NCUL005能够产生32.2%的c9,t11-CLA和67.8%的t10,c12-CLA[39]。鼠李糖乳杆菌PL60和戊糖乳杆菌IFO12 011同样能够产生大量的t10,c12-CLA[40]。
高产菌株的筛选为进一步提高CLA产量提供良好的基础,本文对近年部分高产菌株合成能力统计如下表1,为以后菌株的选取提供借鉴作用。
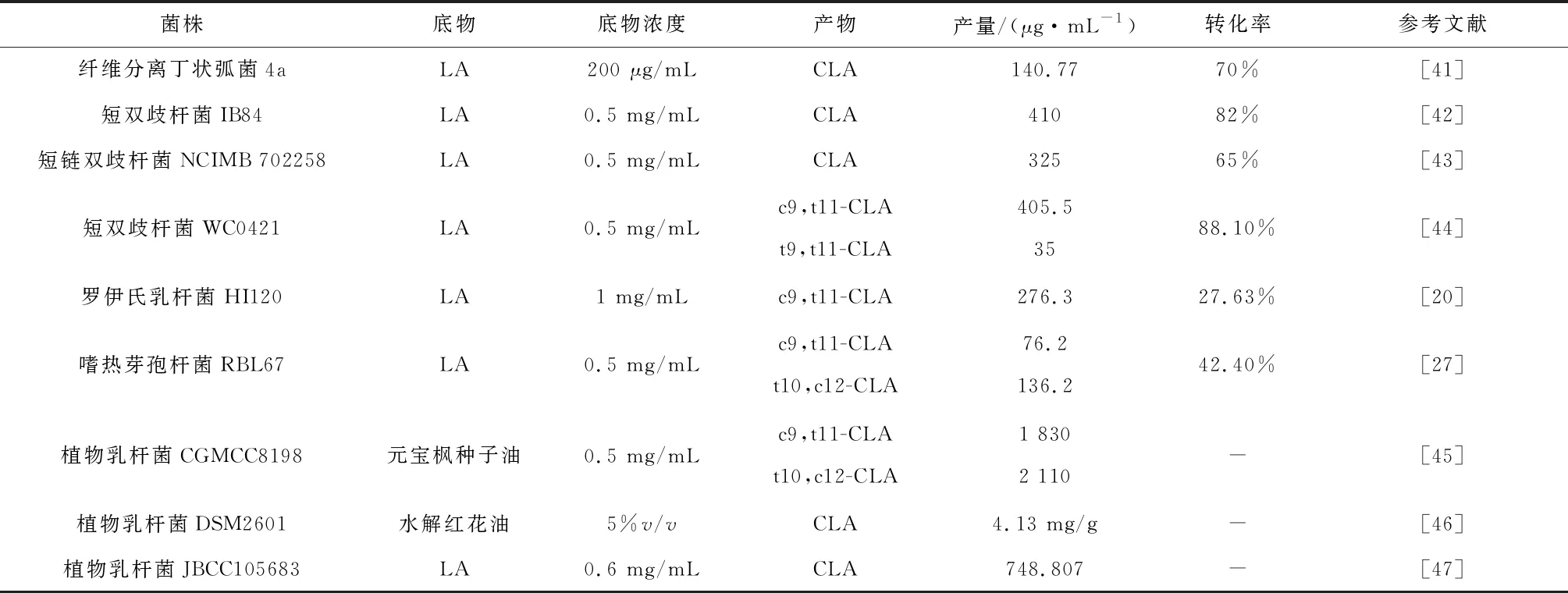
表1 不同菌株合成CLA能力
4 微生物合成调控
4.1 培养条件优化
在细菌生产CLA的过程中,培养时间、pH、温度和菌株接种量等因素都会影响CLA的产量[48],菌株能够利用的底物种类也有所差异[49],价格低廉易获取且能被菌株高效利用的底物更利于下一步培养开发。利用甘油作为唯一碳源,通过表达二酰基甘油转移酶(DGA1),Δ12去饱和酶(MA12D)和痤疮丙酸杆菌异构酶(PAI)来生产t10,c12-CLA,解脂耶氏酵母Po1 g的最大CLA含量和脂质产量分别为132.6 mg/L和2.58 g/L[50]。弗氏假单胞菌可将水解的黑加仑榨汁渣中的脂质转化为c9,t11-CLA,在10%(w/v)的浆液中,c9,t11-CLA富集可达0.51 mg/mL,从而使食品工业低价值植物性副产物的价态转化为高附加值的食品配料[51]。选择底物浓度时,经常出现底物抑制现象,与500 μg/mL的最佳底物浓度相比,动物芽孢杆菌在生产t9,t11-CLA时,当底物浓度在800 μg/mL~1 000 μg/mL左右时会受到抑制作用。总转化率下降了19%~28%[52]。
高产菌株经常作为生物合成CLA的研究对象,一般会选择单一菌株进行培养,但通过菌株的混合培养能达到不错的效果,共培养就是这种高效生产CLA策略。通过乳球菌和乳杆菌共培养,牛奶中总CLA(主要是c9、t11-CLA、t9、t11-CLA和部分t10、c12-CLA)产量在72 h达到56.51 mg/mL[53]。另外培养环境中加入其他物质也能影响CLA的产量,通过加入乙腈和α-二癸基甲基钠改变烯醇酶的活性,实现CLA含量增加约6倍[31]。添加壳聚糖和亚油酸可使菌体干生物量中CLA的产量在36 h内提高到21 mg/g[54],猜测和壳聚糖改变细胞膜通透性有关。
4.2 CLA合成相关酶的调控
CLA的转化过程少不了酶的作用,过表达MCRA以增强CLA的产生,发现单个细菌细胞的总共轭亚油酸产量提高了21倍[55]。在酰基辅酶A合成酶抑制剂的存在下,t10,c12-CLA的含量从1.2 mg/L增加到29 mg/L[56]。CLA还原酶活性是影响CLA产量的另一个重要因素,高活性还原酶催化CLA转化为反式痘苗酸导致CLA的积累减少[57]。相反,纤维分离杆菌MDT-5由于缺乏CLA还原酶活性而更容易发生CLA的积累[58]。
4.3 基因表达调控
CLA的产量与基因转录水平存在较大关联性,植物乳杆菌CGMCC8198中存在一个保守的亚油酸异构酶(Liase)基因,其转录可被元宝枫种子油诱导。发酵后c9,t11-CLA和t10,c12-CLA的含量分别提高了9倍和2.25倍[45]。通过定向进化MCRA基因和亚油酸异构酶基因,构建重组菌突变体库,筛选出的突变菌株其CLA产量明显提高[59]。LysR家族的转录调节子LTTR能够与CLA基因启动子区域结合,调控cla-dh和cla-dc的转录,与野生株相比,lttR过表达菌株中CLA含量增长5倍[60]。这也是首次报道转录因子对CLA合成基因表达的影响,证明CLA的合成受到其它调控因子的调控,对于CLA代谢网络有了更进一步的认识。
通过修改脂质积累途径,过表达DGA1、MA12D和PAI基因构建新型重组菌株,并优化培养条件(碳和氮源、碳氮质量比、CaCl2含量),使得CLA产品构型单一且纯度高。但同时也观察到CLA降解速率为117 mg/L/h。通过消除β-氧化基因,可获得1.8 mg/L/h的降解速率,使得CLA含量进一步提高[61]。
4.4 协同作用
米根霉菌脂肪酶(ROL)与植物乳杆菌的洗涤细胞协作使用的方式可以一步法生产CLA异构体,主要包括c9,t11-CLA和t10,c12-CLA,以蓖麻油为底物最高产量为406 μg/mL[62]。更可以通过将游离的PAI和ROL作为催化剂,建立了从葵花油生产CLA的联合体系,在最佳条件下,t-10,c-12-CLA的最大产量达到9.4 g/L[63]。基于固定化PAI和ROL的协同生物催化体系,将植物油转化为特异性CLA,可得到高达109 g/L的t10,c12-CLA,转化率为90.5%[64]。
5 展望
CLA在降酯、抗癌、抗动脉硬化、免疫调节等方面效果显著,但许多研究用的是 CLA 异构体混合物,不是单一的异构体, 这就需要我们对CLA异构体的单体作用进一步的研究,深入了解有益异构体的作用机制,使有益CLA 异构体得到广泛应用与开发。未来将发现更多CLA异构体的生理功能,更好的被人们所利用,同时满足广阔的市场需求。
关于高产CLA菌株已有不少报道,其中乳酸菌广泛存在于人体肠道中,因具有重要生理功能的菌群而备受关注。而且乳酸菌中CLA合成机制基本阐明[28],通过多组酶系可以将LA转化为CLA。但研究表明CLA并不是最终产物,在其他酶的作用下CLA作为中间体最终形成其他脂肪酸。为了获得高浓度CLA产物,通过阻断或者抑制CLA还原过程使细菌大量积累CLA成为一种新的思路。一般来说CLA的积累是逐步的,可以优化培养条件以及在固化菌体的前提下优化CLA分离技术,形成一种高效可循环的生产模式,以此达到商业化需求的目的。
近年来随着合成CLA相关酶蛋白基因的挖掘,有利于通过重组菌株的构建进而异源表达合成CLA,进一步提高CLA的产量[50]。CLA的产生是对环境的应激反应,这一过程是复杂的,是否存在其他代谢途径影响着CLA的合成;某些条件变量在CLA合成途径中又起到怎样的作用还未可知。另外细菌中存在大量转录调控因子,它们对维持细菌正常代谢发挥重要作用,但是目前关于CLA转录调控机制研究较少,未来可以深入研究转录调控因子对CLA合成的影响,为CLA合成调控研究提供新的方向。
