外电场作用下N2O分子的结构与光谱特性
2022-03-04梁冬梅邓明森
梁冬梅,荆 涛,黄 意,邓明森
(1.凯里学院 理学院,凯里 556011;2.贵州师范学院 物理与电子工程学院,贵阳 550018)
1 引 言
氧化亚氮(N2O)作为一种大气污染物,不仅产生强烈的温室效应,而且还会引起一系列的环境问题,如:臭氧层破坏,产生酸雨等[1, 2].因此,对N2O分子进行有效的消除或控制已成为世界科学人士关心的环境问题之一[3].目前国内外工业上对N2O分子的控制主要采用直接催化分解的技术将其脱除[4,5].早期的理论集中在N2O分子各电子态不同势能面特征的研究[6,7].近年来,理论研究主要在催化分解N2O分子的反应动力学上[8-12].而目前对于电场环境下N2O分子微观性质的研究还很少.
气体分子中的电子在外电场的作用下获得一定的能量,从较低能量的基态跃迁到较高能量的激发态并有次级电子产生,从而使其原有的电子结构发生极大的改变,有望产生一些新现象和新性质[13-16].因此,研究直线型N2O分子的外场效应对于催化分解N2O,甚至找到新的催化剂对其进行脱除具有重要的理论指导意义.本文首先使用B3LYP/6-311+g(d)方法[12]对直线型N2O基态分子进行了优化,得到该分子在无电场和外电场作用下的电子结构,然后分析了外电场对N2O分子红外光谱特性的影响,最后使用CIS/6-311+g(d)方法研究了分子的激发特性和外电场之间的关系.
2 理论与计算方法
外电场作用下分子体系的哈密顿量H可以写为[17]:
H=H0+Hint
(1)
其中,H0代表无外场作用时的哈密顿量,Hint是微扰项,代表外电场与分子体系相互作用的哈密顿量.在偶极近似下,微扰项Hint可表示为,
Hint=-μ·F
(2)
式中μ为分子的电偶极矩,F为外电场.
采用密度泛函理论方法B3LYP/6-311+g(d),首先优化得到无外电场时N2O分子的稳定结构,如图1所示.进一步对分子N2O沿分子轴方向Z轴添加-0.04~0.04 a.u.(-0.04,-0.03,-0.02,-0.01,0,0.01, 0.02, 0.03, 0.04)的外电场进行优化,并在此基础上采用CIS方法对分子的激发态物理量,包括激发能、激发波长和振子强度等进行了计算.
3 计算结果与讨论
3.1 N2O分子无电场下的稳定构型
为了验证基组的准确性和可靠性,本文首先采用不同的方法和不同的基组对N2O分子进行了结构优化.如表1所示,在B3LYP/6-311+g(d)基组水平计算下,优化得到的键长RN-O为0.11853 nm,键长RN-N为0.11255 nm,分别与实验值0.1184 nm,0.1128 nm[18]最为接近,因此,后面的计算将采用B3LYP/6-311+g(d)基组进行.

表1 不同方法优化N2O分子的基态结构参数
3.2 外电场对分子N2O基态的影响
对分子N2O沿Z轴方向施加-0.04~0.04 a.u.的外电场,分子基态参数在外电场作用下的变化情况如表2、3、4所示.
从表2可以看出,随着电场的不断增大,分子键长RN-O不断增大,键长RN-N不断减小,如图2所示.分子键长的变化与分子内电场的变化有关[19].无外电场存在时,N2O分子整体不显电性,即N原子和O原子正负电荷的代数和为0.

表2 外电场下优化的N2O分子的键长、总能量和偶极矩
在有外电场存在时,从表3的外电场下N2O分子的Mulliken电荷布局可以看出,随着沿Z轴正向电场的不断增大,2N原子的电荷布局数不断增大,1O原子的电荷布局数不断减小,3N原子的电荷布局数不断减少.这说明在外电场的作用下,2N原子的电负性越来越强,电荷密度不断增大,1O原子的电负性越来越弱,相应的3N原子的正电性越来越弱,1O和3N原子周围的电荷密度都不断变小,分子内电子远离1O而偏向2N,从而导致1O上电荷减少,2N上电荷增加.换句话说,N-O之间的电场强度不断减弱,键长RN-O不断增大,而N-N之间的电场强度不断增强,键长RN-N不断减少.

表3 外电场下N2O分子的电荷分布
如图3所示,随外加Z轴正向电场的不断增大,体系总能量呈先减小后增大的变化,在F=0时,能量最低,为-184.7182261 a.u.,这是因为随着电场的增大,3N原子和1O原子上的电子不断向2N原子方向转移,使得2N原子的电荷布局数增多,而3N原子和1O原子的电荷布局数减少,从而使得体系哈密顿量H中的势能增大,进而引起体系的总能量降低[20,21],所以分子总能量减小.图4给出了N2O分子偶极矩μ随外电场的变化关系.随着电场从-0.04增大到0.04 a.u.,μ呈先减小后增大的变化,在F=-0.02 a.u.时,偶极矩μ达到最小值0.0191,分子趋于无极分子.这说明外电场的增大使分子的极性不断变化,影响了分子的对称性.
从表4可以看出,随着Z轴正向电场从-0.04增大到0.04 a.u.,HOMO(highest occupied molecular orbital)能量EH逐渐减少,LUMO(lowest unoccupied molecular orbital)能量EL也不断减少,根据计算公式Eg=EL-EH,由图5可以看出,分子的能隙Eg随着电场的增大呈先增大后减小的变化,在F=-0.01a.u.时,Eg达到最大值8.78792 eV.当F>-0.01 a.u.时,带隙不断减少,也就是电子从EH跃迁到EL所需要的能量逐渐减少,电子越容易从HOMO跃迁到LUMO形成空穴.图6画出了LUMO随外电场的变化情况.从图中可以看出,在F=-0.01、-0.02、0、0.01和0.02 a.u.时,LUMO是由π*轨道组成,而当F=-0.03、-0.04、0.03和0.04 a.u.时,LUMO是由σ*轨道组成.而HOMO是由π*轨道组成,电场的加入并没有改变这种组成.

表4 不同外电场下N2O分子的HOMO能量EH、LUMO能量EL和能隙Eg的变化
在外电场下分子N2O红外光谱的变化情况如图7所示.根据计算结果可知,N2O分子具有4个振动模式.无外电场存在时,第1-2的振动模式简并.红外谱中有3个吸收峰.其中第1个吸收峰出现在频率为580 cm-1的位置,是由1-2的二重简并振动模激发,吸收峰强度很小,如图7(a)所示,它是由中间的N原子沿y轴方向摇摆振动产生,与文献[22]提出的588.768 cm-1和文献[23]提供的589.61 cm-1弯曲振动频率值相符.在2344 cm-1处出现与第4振动模对应的最强吸收峰,是由分子的反对称伸缩振动产生.由于O原子和最右边N原子沿Z轴方向的摇摆振动,在频率1328 cm-1处出现与第3振动模相对应的吸收峰.由图7(a)~(e)可以看出,当Z方向加0~0.04 a.u.的电场时,红外光谱没有太大的变化,没有破坏简并的振动模,但三个吸收峰往低频方向有明显的移动.当在Z方向加0~-0.04 a.u.的电场时,第1和2的简并振动模式并没有破坏,由图7(f)~(j)可以看出,吸收峰也发生了明显向低频方向的移动现象,而且红外强度进一步增大.这是因为外电场虽然对分子结构产生了一定的影响,但对分子的内部振动影响并不明显.
图8表示外电场下拉曼光谱的变化.没有加电场时,分子在580,1328,2344 cm-1处峰的位置存在拉曼活性,并在1328、2344 cm-1处的峰存在较强的拉曼活性.当Z方向加0~0.04 a.u.的外电场时,如图8(a)~(e)所示,随着正向电场的增强,580 cm-1处的峰向高频方向有稍许的移动,最大移动距离出现在F=0.04 a.u.的位置,移动了4 cm-1.1328和2344 cm-1处的峰随着正向电场的增大向低频方向发生了明显的移动,而1328 cm-1处峰的强度在外电场F=0.04 a.u.时达到最小,2344 cm-1处峰的强度在外电场F=0.04 a.u.时达到最大.当Z方向加0~-0.04 a.u.的外电场时,如图8(f)~(j)所示,580 cm-1处的峰往高频方向有较小的移动.随着电场从0变化到-0.04 a.u.,1328 cm-1处的峰向高频方向发生了明显的移动,而且强度逐渐增强,2344 cm-1处的峰随着电场的增大向低频方向移动,强度也进一步减弱.从图7和图8可以看出,在2344 cm-1处的峰具有较强的红外强度和拉曼活性,这是分子振动引起分子偶极矩和分子极性改变作用的结果.
3.3 外电场对分子激发态的影响
在得到N2O分子稳定基态构型的基础上,采用杂化CIS方法使用B3LYP/6-311+g(d)基组计算了N2O分子的激发态,得到该分子前9个激发态的激发能,激发波长和振子强度,如表5-7和图9所示.从图9可以看出,无外电场时,N2O分子在123.04 nm处出现紫外光吸收峰.随着沿Z轴正向电场的不断增大,如图9(a)所示,分子N2O的光谱峰发生了蓝移,当外电场达到0.03 a.u.时,蓝移现象并不明显,而当外电场F=0.04 a.u.时,光谱峰值发生了红移.值得一提的是,在加上不同强度的外电场后,N2O分子的紫外光谱在更长的波长位置有吸收峰出现,如图9(a)中的小图所示,随着电场强度从0.01增大到0.04 a.u.,峰值发生了明显的红移,从151.84 nm增大到188.64 nm,而且跃迁强度越来越大,根据跃迁强度的变化从表7可以看出,当外电场强度为F=0.01,0.02,0.03,0.04 a.u.时,这些峰值对应的激发态依次分别为:4(或5),4(或5),2(或3),1(或2).当沿Z轴加0~-0.04 a.u.的外电场,如图9(b)所示,随着电场从0变化到-0.04 a.u.,吸收峰发生了明显的红移,峰值从无电场时的123.04 nm变化到加电场后的144.96 nm,增加了21.92 nm.并且在光谱中更长波长的位置也出现了吸收峰,如图9(b)中的小图所示,随着电场从-0.01变化到-0.04 a.u.,峰值发生了明显的红移,从147.84 nm移动到228.96 nm,移动了81.12 nm.这说明外电场的添加不但使吸收峰能量产生明显的红移,而且可以使无电场下的禁阻跃迁变为有电场下可允许的跃迁,从而提高了跃迁几率,使电子跃迁可以在更低的能量进行,但吸收峰仍在紫外光区.
激发能反映了分子从基态跃迁到激发态所需要的能量,表5为N2O分子在外电场作用下的激发能.从表5的数据可以看出,无外加电场情况下,N2O分子第2-3,4-5激发态都属于二重简并,而外电场的引入破坏了第2和3激发态的简并情况,在F=0.04和-0.04 a.u.时,成为两个能量不等的激发态.各激发态的激发能在电场的作用下发生了明显的变化,如表5所示.最小的激发能是在外加电场F=-0.04 a.u.的第1, 2激发态,为5.4150 eV,对应的激发波长最长,为228.97 nm(表6所示),电子跃迁轨道是HOMO→LUMO.最大的激发能是在外加电场F=0.01 a.u.的第9激发态,为10.9598 eV,对应的激发波长最短,为113.13 nm(表6所示),电子跃迁轨道是HOMO-1→LUMO+1和HOMO→LUMO的叠加.跃迁强度能够反映电子从基态跃迁到激发态的难易程度.从表7可以看出,外电场的加入对各激发态的振子强度产生了明显的影响.第1、2激发态的跃迁需要增加更大的电场(F>0.04 a.u.)后才能产生,而第3、4、5激发态的振子强度在加了电场后仍然较弱,特别是在F=0.04 a.u.时,振子强度变为0,属于禁阻跃迁.第6激发态的振子强度在F=0时,达到了0.5174,属于可允许的跃迁,而随着外电场从0增加到0.04 a.u.,振子强度逐渐变弱,特别是F=0.04和-0.02 a.u.时,振子强度很小,可看作禁阻跃迁,第7激发态的振子强度在外电场增加到0.02 a.u.时不为零,但随着外电场的继续增加,强度越来越小,可以预测在F大于0.04 a.u.后,振子强度接近于0,仍可看作禁阻跃迁.第8激发态的振子强度在F=0时为零,而加了外电场后强度发生了明显的变化.特别是F=-0.02和-0.03 a.u.时,振子强度达到了0.4422和0.3679,成为可允许的跃迁.第9激发态的振子强度在F=0时为0.0560,而当F=0.03 a.u.时,振子强度逐倍增加,变为可允许的跃迁,特别是F=0.04 a.u.时,振子强度达到0.4850,是原来的8倍之多.这表明在外电场存在的条件下,各激发态跃迁的难易程度不同.因此,可以通过调控外电场的强度进一步控制材料的发光强度[24].总之,各激发态的激发能、激发波长和振子强度受外电场影响的变化不同.

表5 不同外电场下N2O分子激发能的变化

表6 不同外电场下N2O分子激发波长的变化
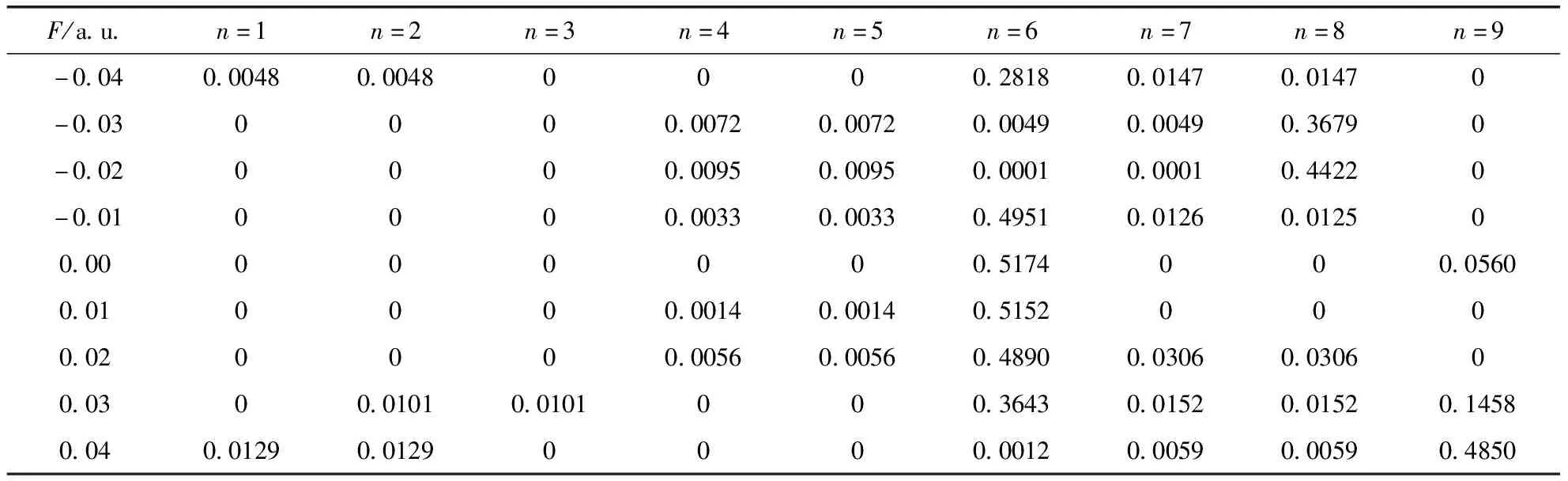
表7 不同外电场下N2O分子振子强度的变化
4 结 论
本文首先采用B3LYP/6-311+g(d)方法优化了不同外电场下直线型分子N2O的结构,分析了分子的键长、偶极矩、前线分子轨道、能隙、红外光谱和拉曼光谱等在外电场下的变化,并在此基础上,采用杂化CIS/6-311+g(d)方法计算了分子前9个激发态,研究了激发态的激发能、激发波长、振子强度和紫外光谱.得出如下结论:
(1)当沿Z轴方向施加电场(-0.04~0.04 a.u.)时,分子N2O的键长随着外电场的增加RN-O不断增大,键长RN-N不断减小,分子偶极矩随外电场的增加呈先减小后增大的趋势,分子极性受到很大影响,分子总能量随外电场的增大呈先减小后增大的变化,分子变的不稳定,能隙随外加电场的增大呈先增大后减小的变化,能隙的减小使分子激发变得更容易.外电场的变化使LUMO的组成发生了变化,由π*轨道变为σ*轨道.
(2)外电场的增加使红外光谱向低频方向移动,而拉曼光谱受外电场的影响发生了明显的移动.
(3)外电场对N2O分子的激发特性影响明显,使原来简并的能级不再简并,原来不简并的能级在电场的作用下可成为简并能级;在外电场作用下,激发能逐渐减小,激发波长发生红移;振子强度受外电场影响明显,禁阻跃迁的激发态可能变为允许跃迁的激发态,而一些强度较强的激发态在电场的作用下变为较弱或者禁阻跃迁的激发态.
(4)外电场作用下,N2O分子的紫外-可见吸收光谱吸收峰发生了明显的红移,同时,外电场的作用使光谱在波长较长处产生了新的吸收峰,该吸收峰随电场强度的增强而发生了明显的红移,该激发可以在较低能量处进行.这说明可以通过外电场来改变N2O分子的基态性质和激发态光谱特性.
