基于BC3NT的混合系锂空气电池正极第一性原理研究
2022-03-04王玉阳喻明富张添昱
王玉阳, 喻明富, 张添昱, 李 洁, 李 强, 孙 红
(沈阳建筑大学 机械工程学院, 沈阳 110168)
1 引 言
电池技术的发展对实现一个更可持续的现代社会越来越重要[1]. 虽然锂离子电池的研究已经取得很好的成果,但是其仍然受到能量密度的限制[2, 3]. Littauer等[4]在1976年提出了锂空气电池的概念,其电极反应式是:2Li+O2+2e-↔Li2O2.锂空气电池因为理论能量密度极高,可以达到11140 Wh·kg-1,几乎是锂离子电池能量密度的10倍而受到了广泛关注[5]. 它可以直接从环境中获得O2作为反应物[6],以捕获从阳极转移到阴极的Li+. 虽然电池体系能量密度极高,但一些限制电池性能的问题仍需要解决,包括低功率密度、不溶性生成物易堵塞正极孔道使电池停止放电等[7]. 为了解决上述问题,He等[8]于2010年提出基于LISICON膜的混合系锂空气电池,吸引了大量科研人员的注意. 其反应式是:4Li+O2+2H2O↔4LiOH. 锂空气电池按结构和电解液体系可以分为:水系锂空气电池、有机体系锂空气电池、混合系锂空气电池和全固态锂空气电池[9]. 与水系锂空气电池相比,混合系锂空气电池既克服了金属锂与水直接接触的危险,又解决了正极不溶、绝缘的反应产物覆盖电极的难题[10]. 与有机体系相比,混合系锂空气电池使得反应机理变得简单,在负极锂一侧的有机电解质能够有效降低负极锂的副反应及保护金属锂[11]. 生成物LiOH具有很高的水溶性,正常情况下不会堵塞多孔正极,便于连续放电,混合系锂空气电池的内在优势使其成为一种新型有前途的储能电池系统[12]. 该电池因为一系列的优点,受到大量关注. 然而,混合系锂空气电池仍然有很多需要改善的地方. 比如LISICON膜在LiOH溶液中的稳定性较低,循环寿命短、成本高、倍率性能欠佳等[13]. 正极材料对混合系锂空气电池起着至关重要的作用,优秀的正极材料可以提高锂空气电池实际能量密度、电池的循环性能和降低电池的过电势等,所以研究出性能优越的正极材料迫在眉睫.
其中,碳纳米管具有很多优点,如较大的比表面积、价格低廉等,使其成为人们最常使用的正极材料之一,大量科研人员将碳纳米管与金属或者其他材料复合作为正极材料,但是成本很高,而且过程很复杂. 所以科研人员考虑让碳纳米管在有着较大比表面积的同时又能起到催化作用,需要对碳纳米管进行掺杂改性,而改变这些纳米管电子性质的一种方法是在其上掺杂电子给体和受体. 由于硼的原子半径接近于碳原子的半径,容易掺杂,它对碳纳米管起到了杂质的作用[14, 15]. 于是科研人员提出了基于BXCYNZ的三方组合来合成不同类型的纳米管和纳米结构,其中BC3结构是他们最重要的目标[16-18]. 实验和理论研究表明,硼掺杂可以在碳纳米管中形成一维纳米管结构的BC3阳极瘤,并且可以形成相对稳定性与CNT相当的BC3NT[19]. BC3NT含有C-C和B-C键,但没有任何不稳定的B-B键,因此这些结构是稳定的[20, 21]. 研究发现,硼在碳纳米管中的掺入可以有效地调整其电子性能和力学性能,这可能带来一些新的应用[22]. 与碳纳米管不同,这些纳米管表现出不依赖于纳米管直径和手性的电子性质[23]. Wang等[24]已经指出,BC3单壁管具有相对稳定的性能,这种稳定性很可能与这些纳米管是半导体有关,因此可能构成适合纳米电子学技术的一类材料[25-27]. 事实上,目前人们认为BC3结构可以产生非常稳定的材料,在电性能方面优于传统的碳纳米管[28]. 实验室合成的BC3NT极可能存在一些缺陷,因为容易产生缺陷是BC3NT的一大特性[29],缺陷是通过化学键旋转90°得到的. Yeh等[30]分别采用实验和第一性原理计算两种方法论证了随着硼含量的增加,电催化性能逐渐提高. 根据前人对掺杂硼的碳纳米管及其他材料的研究,硼掺杂碳纳米管继承了碳纳米管高比表面积的特点,且具有很好的催化性能,而混合系锂空气电池正极材料恰恰需要改善这两个性能,所以我们恰恰可以利用这些性质来进行混合系锂空气电池正极的研究.
本文使用Material Studio软件,分别以CNT、BC3NT、带有拓扑缺陷(七元环、八元环)的BC3NT作为混合系锂空气电池正极材料. 使用第一性原理研究带有拓扑缺陷的BC3NT的电子结构和对Li+扩散能垒的影响以及对氧气吸附的性质.
2 第一性原理计算模型建立
首先建立(8,0)CNT模型,然后用B元素取代部分C元素,得到BC3NT,如图1所示. 共128个原子,其中包括32个B原子,灰色代表C原子,紫色代表B原子. 七元环拓扑缺陷是通过将纳米管中的一个键旋转90°而产生的,结果是两个具有公共键的七边形和两个被键分开的五边形,如图2(a). 同理,八元环缺陷如图2(b)所示. 本文将带有七元环拓扑缺陷的BC3NT用7MR表示,带有八元环拓扑缺陷的BC3NT用8MR表示.
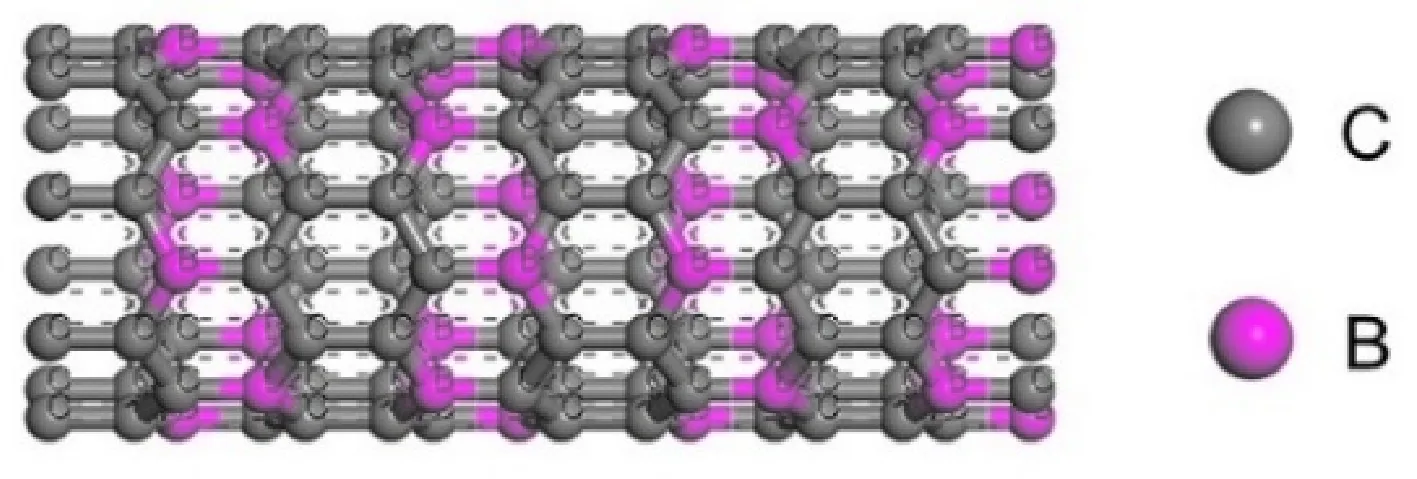
图 1 BC3NT结构Fig. 1 Structure of BC3NT

图2 带有拓扑缺陷的BC3NT结构:(a)7MR, (b)8MRFig. 2 BC3NT structures with topological defects:(a)7MR, (b)8MR
将纳米管放在20 Å·20 Å·17.08 Å的晶胞中,建立模型如图3所示.
图3 纳米管周期模型Fig. 3 BC3NT cycle model
通过求解薛定谔方程可以求出描述体系状态的电子波函数:
(1)
式中,ħ=h/2π,h为普朗克常数,大小是4.13566743*10-15eV·s;m为电子的质量;i=1, 2, …;N为电子的编号;▽为电场梯度(V/m2);r为电子的坐标值;V(ri)为每个电子与所有原子核之间的作用能(eV);U(ri,rj)为不同电子之间的作用能(eV);Ψ(r)= Ψ(r1,…,rN);E是电子的基态能量(eV).
由于固体中存在大量的电子,直接求解薛定谔方程存在很大的困难,第一性原理的核心是采用合理的近似和简化,提出电子波函数Ψ(r)和电子密度函数ρ(r)存在——对应的关系,通过求解ρ(r),便能间接得到Ψ(r).其中ρ(r)满足Kohn-Sham方程:
εiψi(r)
(2)
式中,Exc[ρ]为交换关联泛函;Vext(r)为第i个电子的总能(eV);εi为第i个电子的基态能量.
建立模型之后进行优化,优化过程能量收敛如图4所示. 用基于密度泛函理论(Density Function Theory)的第一性原理Dmol3程序进行模拟计算,计算中自旋不受限制. 电子间交换关联函数采用广义梯度近似(Generalized Gradient Approximation,GGA)下的PBE泛函,为了准确描述反应物与基底间的范德华力,采用Grimme方法进行色散校正. 基组为双数值轨道基组+p轨道极化函数DNP,总轨道截止选取4.9 Å,使得引入的基组误差足够小,采用全电子相对论处理金属原子的相对论效应. 布里渊区积分采用Monkhorst-Pack形式的特殊K点方法,采用1×1×7的K点进行结构优化. 原子结构优化中的能量收敛性判据为1.0e-5Ha,Hellmann-Feynman原子力收敛判据为每个原子受力不大于0.002 Ha·Å-1,最大位移为0.005 Å.
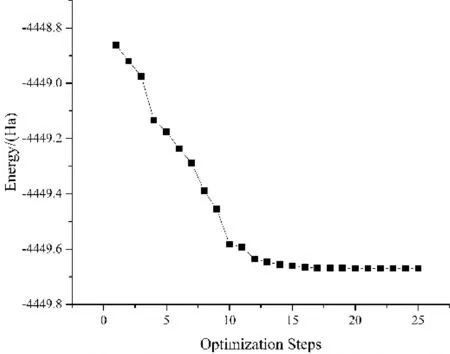
图4 优化过程能量收敛图Fig. 4 Energy convergence diagram of optimization process
氧气在纳米管上吸附能计算公式:
Eads=Etotal-EBC3NT-EO2
(3)
E表示优化后系统的能,Eads表示优化后系统的吸附能,Etotal表示优化后系统的总能量,EBC3NT表示BC3NT优化后的能量,EO2表示氧气优化后的能量.
3 结果与讨论
3.1 模型可靠性验证
本文计算的氧气在BC3NT外表面吸附能值是-3.54875157 eV,与Jalili等[31]得出的结论-3.24 eV相吻合,甚至比他们的结构更稳定,以上都表明本文的结果具有可靠性.
3.2 电子结构分析
CNT、BC3NT、7MR和8MR的能带图如图5所示. 其带隙分别是0.652 eV、0.549 eV、0.620 eV、0.330 eV. 掺杂硼使纳米管能带的带隙减小,完美BC3NT的带隙是0.549 eV,符合Jalili等[31]得出的结论,即完美的BC3NT是一种直接带隙为0.5 eV的半导体. 7MR的带隙是0.620 eV,与纯BC3NT的带隙的大小相比,虽有略微增大,但相差不大. 8MR的带隙是0.330 eV,可以得出八元环拓扑缺陷可以很明显降低带隙,电子更容易跃迁到更高的轨道上,使反应活性更强. 在后三者能带图的带隙处,可以很明显看到杂质带,这就是掺杂硼导致的,掺杂硼使严格的周期性势场受到破坏,从而有可能产生能量在带隙中的局域化电子态,这就是杂质能级. 8MR的能带图空带处杂质带比BC3NT和7MR的杂质带要多. 说明缺陷环越大,处于激发态的电子越多,半导体导电能力增强,其电子活性就越大.
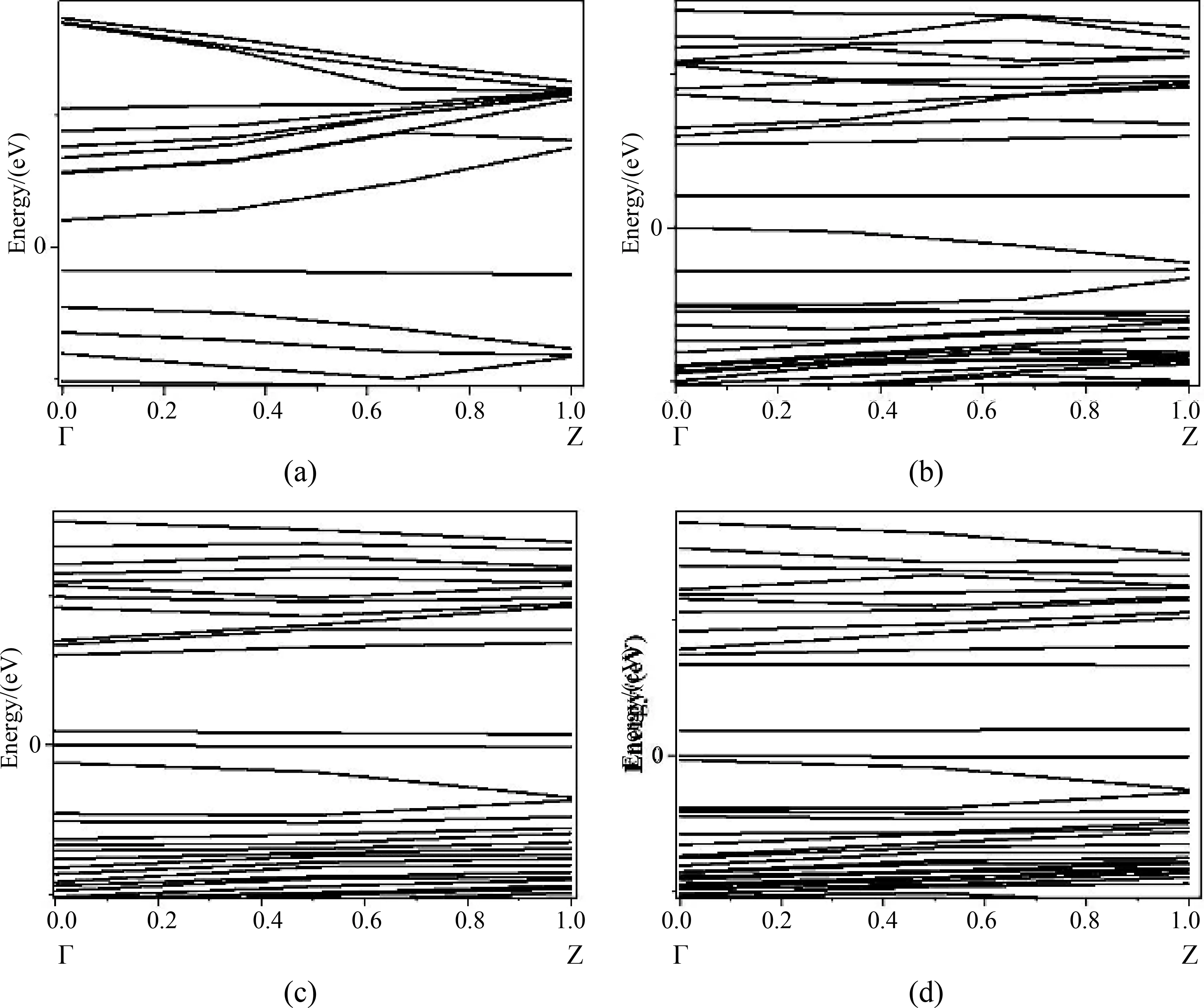
图5 纳米管能带图:(a)CNT, (b)BC3NT, (c)7MR, (d)8MRFig. 5 Band structures of nanotubes:(a)CNT, (b)BC3NT, (c)7MR, (d)8MR

图6 分波态密度图:(a)CNT, (b)BC3NT, (c)7MR, (d)8MRFig. 6 Partial densities of states:(a)CNT, (b)BC3NT, (c)7MR, (d)8MR
CNT、BC3NT、7MR、8MR的态密度图如图6所示. 从图中可以看出激发态的电子主要由2p轨道的电子提供,缺陷态是一种受主态. 从图中也可得出掺杂硼之后,费米能级附近的峰高度增加,积累的电子数大幅度增多,处于激发态的电子数目增多,这些电子全部由2p轨道贡献,说明掺杂硼之后碳纳米管活性增强,对氧气的吸附以及后续的氧还原反应有促进作用,从而提升电池性能.
BC3NT、7MR、8MR的总态密度图如图7所示. 在费米能级上的电子数不为0,说明掺杂硼之后的碳纳米管呈现金属性质,8MR在费米能级占据的电子数最多,而费米能级上占据的电子越多,说明越多的电子处于激发态,导电性越强,物质活性越大. 所以在本文中,8MR的电子活性最大,导电性最强,最有利于氧气吸附以及氧还原反应的进行,其次是7MR、BC3NT.

图7 总态密度图:(a)BC3NT, (b)7MR, (c)8MRFig. 7 Total densities of states:(a)BC3NT, (b)7MR; (c)8MR
3.3 O2吸附分析
O2可能通过三种方式来吸附在纳米管上,包括吸附在顶位、桥位和空位上. 氧气分别在CNT、BC3NT、7MR和8MR的顶位、桥位和空位上的吸附情况如图8所示,其吸附能如表1所示. 结合图8和表1,从计算的吸附能结果来看:对于CNT,其在桥位上的吸附能是0.5 eV,是吸热吸附,需要条件较高,在室温下难以进行. 在顶位和空位上的吸附能分别是-0.05 eV、-0.21 eV,由于数值大小远远小于0.5 eV,所以两者都是物理吸附. 对于CNT来说,最稳定的吸附是空位吸附,但仍然是物理吸附,不利于氧还原反应进行,所以CNT只能作为电极材料,其催化性能很差.
对于BC3NT,氧气在其顶位的吸附能是+2.17 eV,是吸热吸附,很难发生. 氧气在其桥位和空位的吸附能分别是-2.03 eV、-1.69 eV,都是化学吸附,比较稳定,且在桥位的吸附最稳定,有利于氧还原反应的发生,与Jalili等[31]得出的数据-2.27 eV非常接近,证明本文结果具有可靠性.
对于7MR,氧气在其顶位、桥位和空位上的吸附能分别是-1.22 eV、-2.07 eV和-2.65 eV,都是化学吸附,是稳定的. 其中最稳定的吸附位是空位,吸附能是-2.65 eV. 从吸附图可以看出,氧气在7MR空位吸附后,双键断裂,变成微弱连接的单键,处于半解离状态,是有利于后续氧还原反应的.
对于8MR,氧气在其顶位、桥位和空位上的吸附能分别是-0.49 eV、-1.66 eV和-4.32 eV,都是化学吸附,是稳定的. 其中最稳定的吸附位是空位,吸附能是-4.32 eV,此时氧气发生解离吸附,是非常有利于氧还原反应发生的.
从以上分析可以看出,O2在CNT外表面的吸附是非常不稳定的,在掺杂B的CNT外表面吸附是非常稳定的,而且随着缺陷环的增大,吸附能越大,吸附越稳定,并且大的缺陷环使氧气发生稳定的解离吸附,有利于氧还原反应的发生.

图8 O2分别在CNT、BC3NT、7MR、8MR上的吸附:(a)顶位, (b)桥位, (c)空位Fig.8 Stable adsorption of O2 on CNT, BC3NT, 7MR and 8MR:(a)Top site, (b)Bridge site, (c)Vacancy site

表2 电荷转移值
CNT、BC3NT、7MR、8MR最稳定吸附O2时的带隙如图9,分别是0.379 eV、0.208 eV、0.071 eV、0.187 eV. 可以看出吸附O2后,纳米管的带隙都对应减小,且带有七元环拓扑缺陷的BC3NT吸附O2之后,其带隙大幅度减小,变为0.071 eV,金属性非常强,具有良好的导电性,在空带处产生很明显的杂质带. 众所周知,发生电极反应的前提条件是氧气的稳定吸附,而产生缺陷的BC3NT吸附氧气后,活性非常大,有利于后续反应.
O2在BC3NT上吸附前后总电子密度分布如图10(a)所示. 从图中可以看出与碳原子相比,硼原子带少量的电子,发生吸附后,O2带大量电子. 氧气吸附位点如图10(b)所示,O2分子的一个O原子吸附于64号B原子上,氧气总是稳定吸附于硼原子上,说明硼原子对氧气吸引力大于碳原子.
对O2在BC3NT上的吸附进行布居分析得到吸附前后电荷变化如表2,结合图表分析可以看出,碳相对于硼原子电负性较大,产生较大极化,所以使得硼原子带0.180正电荷,这与Yang等[4]的结论一致. 因为氧气在靠近BC3NT时表面带有轻微的负电荷,所以带正电荷的硼有利于对氧气的吸附. 随着吸附距离的减小,氧气分子获得越来越多的负电荷,与硼的作用进一步加强,最终导致稳定吸附于硼上. 而从表中吸附前后的电荷可以看出,在氧气吸附的时候,碳原子失去部分电子,氧气分子得到电子,而硼原子的电荷只有少量变化,所以在氧气的吸附过程中,硼原子起到桥梁的作用,将管壁的部分电荷转移到氧气分子,从而更好的进行吸附,对接下来的反应起到了促进作用. 在这个过程中共向氧气转移电荷值是0.218 eV,这符合Jalili等[31]得出的结论.
O2在7MR上最稳定吸附如图11所示,吸附前后的总电子密度图如图11(a)所示,吸附位点如图11(b)所示.
由于带有七元环拓扑缺陷的BC3NT会有变形发生,所以B-B键不在一条直线上,但是两个B原子对氧气的吸附力要大于纯BC3NT,所以带有七元环拓扑缺陷的BC3NT对氧气吸附更稳定. 吸附前后电荷转移情况如表2所示. 结合图表我们可以得出,对于7MR吸附O2的机理与BC3NT不同,七元环上的两个B原子各吸附一个氧原子,纳米管向O2分子转移更多的电荷,这也是7MR对O2吸附能大于纯BC3NT的原因. 7MR对O2吸附的电荷转移情况与纯BC3NT大致相同,7MR吸附O2时是B原子将纳米管表面的电荷转移到O2表面,碳原子所带电荷减少,O2分子得到更多的负电荷,B原子与带负电的氧气产生更强的吸附作用. 在这个过程中,O2得到电荷-0.332 eV,从电荷大小上看,7MR会将更多的负电荷转移到O2分子表面,这也是7MR对O2分子吸附能更大的原因,这样更有利于氧还原反应.

图9 O2吸附的能带图:(a)CNT,(b)BC3NT,(c)7MR,(d)8MRFig. 9 Band structures of O2 adsorption:(a)CNT,(b)BC3NT,(c)7MR,(d)8MR

图10 氧气在BC3NT上最稳定吸附位点:(a)总电子密度, (b)吸附位点Fig. 10 The most stable adsorption site of O2 in BC3NT: (a)Total electron density distribution, (b)The site of adsorption

图11 氧气在7MR上最稳定吸附位点:(a)总电子密度; (b)吸附位点Fig. 11 The most stable adsorption site of O2 in 7MR:(a)Total electron density distribution, (b)The site of adsorption

图12 氧气在8MR上最稳定吸附位点:(a)总电子密度, (b)吸附位点Fig. 12 The most stable adsorption site of O2 in 8MR:(a)Total electron density distribution, (b)The site of adsorption
O2在8MR上吸附前后的总电子密度以及吸附位点如图12所示,O2在8MR上的吸附能最大,吸附之后双键断裂,氧分子发生解离,两个O原子分别吸附在两个B原子上. 其中一个O原子与76号B原子和74号C原子成键,另一个O原子与71号B原子和42号C原子成键. 此时,两个O原子成为拓扑缺陷环的组成部分,拓扑缺陷环变大. 同理,对8MR吸附O2的情况进行布居分析,得到电荷转移情况如表2所示. O2得到负电荷-0.359 eV,主要由最近的42号和74号C原子提供. O2在8MR上吸附时得到的负电荷最多,库伦作用最强,发生解离吸附最有利于氧还原反应.
由以上分析可以知道,BC3NT、7MR和8MR在吸附O2时,随着缺陷环的增大,向O2转移的电子数增多,吸附能增大,且O2在8MR上发生解离吸附,缺陷环越大,越有利于氧还原反应的进行.
4 结 论
本文将B元素掺杂到CNT中得到BC3NT,利用BC3NT易产生缺陷的特点,使其作为混合系锂空气电池正极材料. 分析了缺陷的引入对BC3NT电子性质的影响以及氧气在BC3NT及其缺陷上的吸附性能. 研究发现:
(1)氧气在掺杂硼的碳纳米管上吸附更加稳定,且随着拓扑缺陷环的增大吸附能越大,在7MR、8MR上分别发生半解离、完全解离吸附,更有利于氧还原反应的进行.
(2)通过布居分析进一步研究电荷转移情况,随着缺陷环的增大,转移的电荷越来越多,氧气与纳米管的库伦作用越来越强.
(3)综合来看,掺杂硼的碳纳米管是很好的正极材料,同时起到催化剂的作用,其产生的拓扑缺陷环既会提升导电性能,又能使氧气更稳定地吸附,更有利于氧还原反应.
