哮喘抑制剂WHYAHNW的理性设计
2022-03-04李南星
张 麟,李南星
(天津大学化工学院,天津 300350)
哮喘是先天和适应性免疫系统细胞与上皮细胞共同作用,导致支气管超反应性、黏液分泌过多、气道壁重塑和气道狭窄的一种慢性支气管疾病[1-3].目前全球哮喘患者约有3亿[4],每年有25~35万人死于哮喘[5-6],导致对哮喘疾病的大量医疗支出.哮喘疾病对世界经济和社会发展造成极大负面影响,是人类社会面临的一个健康难题和挑战.
嗜酸性粒细胞炎症是哮喘中主要的炎症类型,约占全部严重哮喘的40%~60%[6-8].Galectin-10(Gal10)蛋白存在于人类嗜酸性粒细胞中[9-10],当嗜酸性粒细胞发生活化时,Gal10蛋白从细胞质中释放,经历相变成为CLCs晶体[11-12],引发嗜酸性粒细胞炎症从而诱发哮喘.
课题组前期基于蛋白质表界面研究[13],已设计开发多种抑制剂[14-18]和病毒相关配体[19-21],并以Gal10蛋白与溶晶抗体复合物[10]为基础进行分子动力学模拟及结合自由能分析确定其结合界面的关键氨基酸残基,构建亲和模型仿生设计多肽抑制剂,获得WHYAENWY等哮喘抑制剂[22].WHYAENWY抑制剂在分子动力学模拟中可以与Gal10蛋白结合,但抑制效果验证中与Gal10蛋白结合情况不佳.研究中发现WHYAENWY和Gal10蛋白结合界面处存在邻近的同种电荷氨基酸残基,如WHYAENWY的E5、Y8和Gal10蛋白D49、E43,因而其静电斥力不利于二者结合.因此,本文拟分析WHYAENWY与Gal10蛋白的结合作用表面,通过抑制剂的序列优化设计以改善结合界面处的静电相互作用,提高抑制剂与Gal10蛋白间的结合性能.
1 实验模型与方法
1.1 模 型
Gal10蛋白晶体结构来源于Protein Data Bank(PDB ID 6GLW,http://www.rcsb.org/pdb/)[10],多肽抑制剂的结构来源于课题组自编程序,程序采用C语言编写,可根据输入的序列和对应氨基酸结构生成多肽抑制剂的初始结构,分子动力学(molecular dynamics,MD)模拟过程优化可保证结构合理性.采用GROMOS96 43a1力场.模拟环境为生理盐水溶液,通过反离子平衡系统净电荷,水分子采用SPC/E模型.模拟体系盒子尺寸为10nm×8nm×7nm,包含17776个水分子、53个钠离子和51个氯离子.
1.2 分子动力学模拟
采用GROMACS 5.1.4(http://www.gromacs.org/)[23]进行20ns正则(NVT)系综MD模拟.系统温度通过velocity-rescale(v-rescale)[24]方法维持在 310.15K.使用LINCS(linear constraint solver)[25]算法限制共价键和键角的振动.使用三维周期性边界条件.静电相互作用通过PME(particle-mesh Ewald)[26]算法处理.相邻原子截断距离、库仑截断距离以及LJ(Lennard-Jones)势能截断距离都设定为1.2nm.粒子初始速度根据310.15K温度下的Maxwell分布获得.采用Verlet算法,积分步长设定为2fs.各体系于模拟开始前都经历能量最小化.模拟过程至少重复3次.
1.3 结合自由能分析
利用分子力学-泊松-玻耳兹曼方程表面积(molecular mechanics-Poisson-Boltzmann surface area,MM-PBSA)[27]自由能分析方法和g_mmpbsa[28]程序解析抑制剂与Gal10蛋白的结合界面的关键氨基酸.
1.4 多肽抑制剂分子对接
采用AUTODOCK VINA 1.1.2(http://vina.scripps.edu/)[29]进行分子对接以评估多肽抑制剂与Gal10蛋白结合情况.Gal10蛋白作为受体,多肽抑制剂作为配体.通过打分(EVINA)评估结合作用.
1.5 多肽抑制剂与Gal10蛋白的分子动力学模拟
利用MD模拟研究结合的动态过程及微观相互作用.MD模拟设置同第1.2节所述.使用editconf命令将多肽抑制剂与Gal10蛋白的最小距离调整为1.5nm作为初始结构,考察多肽抑制剂与Gal10蛋白的结合过程.
1.6 多肽抑制剂抑制效果验证
通过MD模拟考察Gal10蛋白、抗体、多肽抑制剂同时存在时抑制剂与Gal10蛋白的结合情况,以评估多肽抑制剂的抑制效果.采用20ns NVT系综模拟,计算分子间最小距离dmin、质心距离dcom、Coulomb势能(EC)、LJ势能(ELJ),评估分子间结合过程.
2 实验结果与讨论
2.1 结合自由能解析
利用MM-PBSA计算结合界面上各氨基酸残基对结合自由能的贡献,如图1所示.结果显示,Gal10蛋白的Y69、E119,多肽抑制剂WHYAENWY的W1、Y3、N6、W7、A4对结合有利,Y8与E5对结合不利.分析残基空间分布发现,Y8和E5与Gal10蛋白的D49和E43携带相同电荷,形成静电相斥而不利于结合.因此,拟通过WHYAENWY中的荷电残基序列优化以改善其结合性能.对于Y8,因其距离Gal10蛋白关键位点位置相对较远,直接删去.对于E5,使用H、K、R等带正电的氨基酸替换,得到新抑制剂序列WHYAHNW、WHYAKNW和WHYARNW.对新抑制剂序列中替换的氨基酸进行自由能分析,替换前E5的自由能贡献为(8.24±0.71)kJ/mol,替换后H5为(-9.33±0.38)kJ/mol,K5为(4.56±0.54)kJ/mol,R5为(1.59±0.84)kJ/mol.H5对结合产生有利影响,K5、R5减轻对结合的不利影响.

图1 Gal10蛋白与WHYAENWY的相互作用界面分析Fig.1 Molecular interface between Gal10 protein and WHYAENWY
2.2 多肽抑制剂的分子对接
利用AUTODOCK VINA将优化设计的多肽抑制剂与Gal10蛋白依次进行对接.对接结果显示多肽抑制剂与Gal10蛋白结合的EVINA都小于-30kJ/mol,表明多肽抑制剂与Gal10蛋白结合都能自发进行且都有较强结合作用(表1).具体结合界面如图2所示.

表1 分子对接分数Tab.1 Molecular docking scores
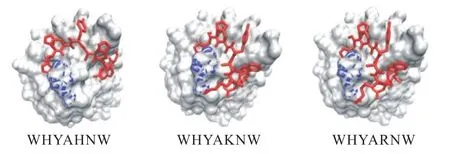
图2 多肽抑制剂与Gal10蛋白结合情况Fig.2 Binding of peptide inhibitors to Gal10 protein
2.3 多肽抑制剂的分子动力学模拟
多肽抑制剂与Gal10蛋白的结合情况如图3所示.在生理盐水环境下,WHYAHNW和Gal10蛋白的最小距离迅速减小,2ns后达到稳定波动,质心距离变化趋势类似,在6ns后达到稳定波动,表明抑制剂与Gal10蛋白结合迅速且稳定.相比而言,WHYAENWY和Gal10蛋白的最小距离和质心距离在7ns后达到稳定波动.且WHYAHNW的最小距离与质心距离呈现逐渐递减波动至稳定,不同于WHYAENWY经历较大波动后达到稳定.3次平行模拟后取轨迹稳定结合阶段进行分析,WHYAHNW与Gal10蛋白的最小距离为(0.18±0.01)nm,与WHYAENWY的(0.19±0.01)nm相当.WHYAHNW与Gal10蛋白的质心距离为(1.84±0.01)nm,略小于WHYAENWY的(2.04±0.22)nm.确证WHYAHNW与Gal10蛋白的结合紧密.同时,WHYAHNW的均方根偏差(root mean square deviation,RMSD)值为(0.53±0.04)nm,略小于WHYAENWY的(0.66±0.08)nm,表明WHYAHNW在结合过程中构象更加稳定.
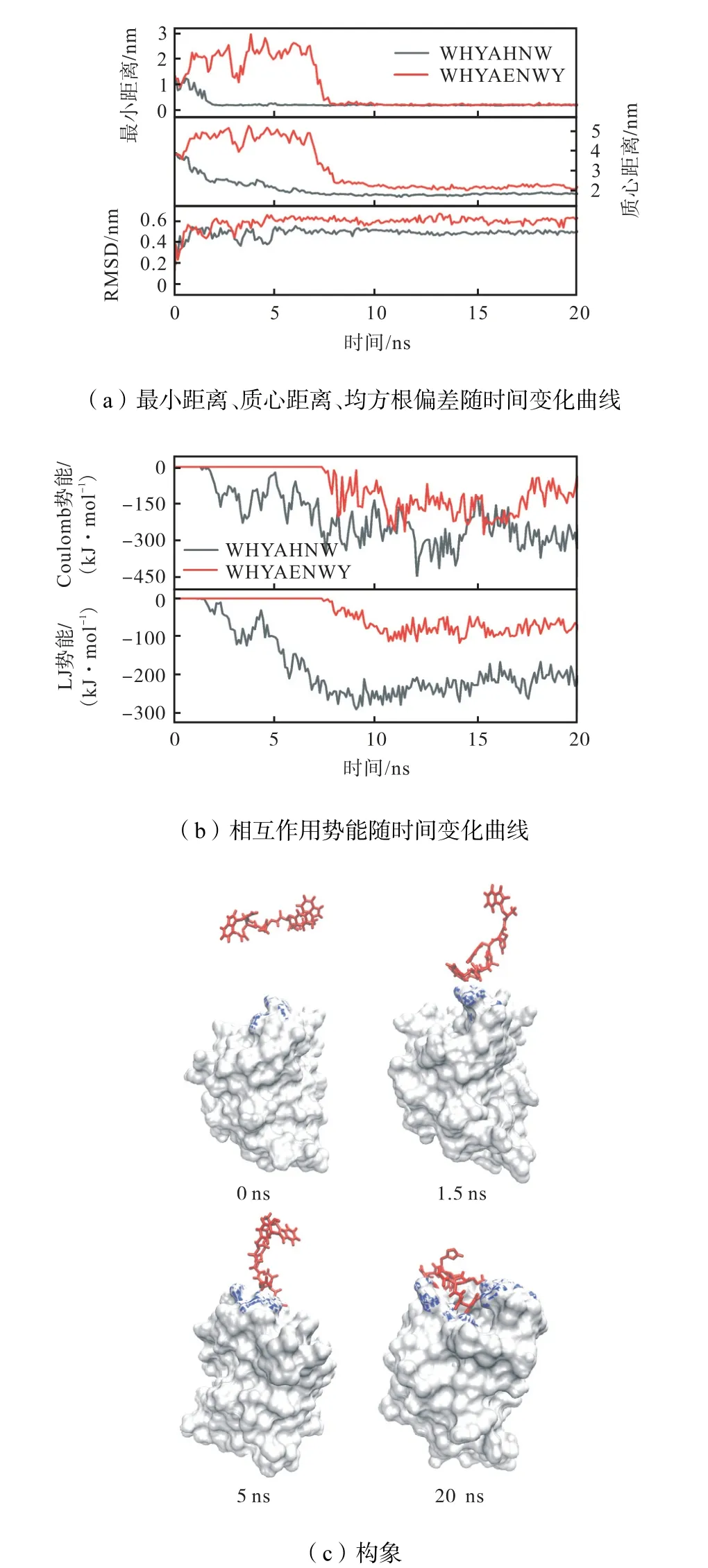
图3 Gal10蛋白与抑制剂相互作用情况Fig.3 Molecular interactions between Gal10 protein and inhibitors
从首次结合时间分析,WHYAHNW与Gal10蛋白发生结合的平均时间为(0.9±0.1)ns,小于WHYAENWY的(5.4±2.7)ns,表明WHYAHNW结合更迅速.
能量分析显示,Gal10蛋白和WHYAHNW间的Coulomb势能和LJ势能在2ns后开始降低为负值,表明Coulomb势能和LJ势能均利于其结合过程.3次模拟后取轨迹稳定结合阶段进行分析,WHYAHNW的Coulomb势能为(-211.66±86.55)kJ/mol,LJ势能为(-185.25±33.26)kJ/mol,分别低于WHYAENWY的Coulomb势能(-148.15±13.70)kJ/mol,LJ势能(-90.52±13.32)kJ/mol,确证WHYAHNW结合优于WHYAENWY.而且,结合构象(图3(c))表明WHYAHNW结合在Gal10蛋白的关键位点区域.
2.4 多肽抑制剂抑制效果验证
Gal10蛋白、抗体、多肽抑制剂同时存在时抑制剂与 Gal10蛋白的结合情况如图 4所示.WHYAHNW与Gal10蛋白间的最小距离波动后减小,2ns后达到0.1nm并保持在该值附近波动,质心距离变化趋势类似,表明WHYAHNW与Gal10蛋白迅速结合并达到稳定.相比而言,最小距离和质心距离显示WHYAENWY与Gal10蛋白在16ns后才达到稳定结合.3次模拟后取轨迹稳定结合阶段进行分析,WHYAHNW与Gal10蛋白的最小距离和质心距离分别为(0.17±0.01)nm和(2.10±0.06)nm,均小于WHYAENWY的(0.24±0.12)nm和(2.74±0.14)nm.首先表明,在抗体存在的情况下,本文设计的多肽抑制剂也能够结合到Gal10蛋白.其次,确证WHYAHNW与Gal10蛋白结合更好.

图4 Gal10蛋白、抑制剂与抗体相互作用情况Fig.4 Molecular interactions of Gal10 protein,inhibitors,and antibody
从首次结合时间分析,WHYAHNW与Gal10蛋白发生结合的平均时间为(0.5±0.9)ns,小于WHYAENWY的(3.8±6.5)ns,表明WHYAHNW的结合更迅速.
能量分析显示,WHYAHNW与Gal10蛋白间的Coulomb势能和LJ势能在2ns降低为负值,表明Coulomb势能和LJ势能均利于其结合过程.3次模拟后取轨迹稳定结合阶段进行分析,WHYAHNW的Coulomb势能为(-121.70±23.21)kJ/mol,LJ势能为(-125.87±17.90)kJ/mol,分别低于WHYAENWY的Coulomb 势能(-96.98±62.63)kJ/mol,LJ势能(-55.84±31.72)kJ/mol,确证WHYAHNW的结合优于WHYAENWY.因此,确证WHYAHNW相比于WHYAENWY进一步优化与Gal10蛋白的亲和作用.
3 结 语
以前期设计的多肽抑制剂WHYAENWY为基础,分析结合自由能及残基空间分布确定抑制剂中E5、Y8氨基酸残基由于和Gal10蛋白的D49、E43带有相同电荷,导致静电斥力从而对结合不利.本文通过序列重设计使用带有相反电荷的氨基酸替代E5,删去Y8,筛选后得到新抑制剂WHYAHNW.WHYAHNW分子对接EVINA=-35.6kJ/mol,与Gal10蛋白具有较强相互作用.在分子动力学模拟和抑制效果验证中,WHYAHNW与Gal10蛋白结合更迅速稳定,优于序列改造前抑制剂WHYAENWY,有望作为具有高亲和力的哮喘抑制剂为后续哮喘药物的设计与开发奠定基础.
