表达的影响
2022-03-04许方方李建玲
许方方,张 珊,李建玲,蒋 淼
认知功能障碍是阿尔茨海默病(Alzheimer′s disease,AD)特征性的临床表现。人参皂苷Rb1是人参主要活性成分,通过抑制炎症反应、激活抗凋亡相关通路,从而保护脑细胞功能、改善学习记忆[1-2]。研究发现,临床常用的吸入性麻醉药物以及手术创伤刺激可以加重或诱发AD临床前期、临床期病人的认知功能障碍[3-5]。本研究通过围术期给药,观察人参皂苷Rb1对APPswe/PS1dE9双转基因AD模型小鼠肝叶部分切除术后认知功能以及海马内突触后致密蛋白-95(postsynaptic density proteinP-95,PSD-95)、神经元尼氏体表达的影响。
1 材料与方法
1.1 实验动物 3月龄APPswe/PS1dE9双转基因雄性小鼠,体质量30 g,由南京大学动物模式中心提供,许可证号:SCXK(苏)2015-0001。
1.2 主要试剂和仪器 Morris水迷宫装置(上海吉量软件科技有限公司);人参皂甙Rb1(纯度>95%,批号:17080421)购自上海同田生物技术有限公司,经生理盐水稀释后备用;小鼠单克隆PSD抗体(1∶1 000,Abcam);辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG(1∶1 000,Aggen)。
1.3 分组 本实验已经通过上海市宝山区仁和医院伦理委员会的伦理论证(编号:201812),并在其监督下进行。将3月龄APPswe/PS1dE9双转基因小鼠120只随机分为3组,每组40只,手术组(S组):小鼠腹腔注射0.1%戊巴比妥 0.3 mg/kg,麻醉后行肝叶部分切除术;人参皂甙Rb1 组(Rb1 组):术前5 d注射人参皂甙60 mg/kg;对照组(N组):术前5 d注射同体积的生理盐水。从以上各组中随机抽取8只小鼠,采用Morris水迷宫检测术后1 d、3 d、7 d、14 d、21 d、28 d学习记忆能力。剩余APPswe/PS1dE9双转基因小鼠同样在术后3 d、7 d、14 d、21 d、28 d时间点取标本行蛋白免疫印迹法(Western Blot)检测海马内PSD-95的表达及尼氏染色分析尼氏体累积光密度值(IOD)。
1.4 Morris水迷宫行为学测试 实验程序包括:①定位航行实验(place navigation)用于测量小鼠获取空间学习记忆的能力。将小鼠从4个入水点随机放入水中,通过自动录像系统记录小鼠90 s内找到平台的时间(逃避潜伏期,escape latency)。②空间探索实验(spatial probe test)用于测量小鼠对平台空间位置记忆的能力。拆除平台,将小鼠从离平台最远的象限放入水中,记录90 s内小鼠在原目标象限的时间百分比。
1.5 手术处理 小鼠翻正反射消失后,消毒,在剑突下腹部正中线切开,进入腹腔游离肝脏左侧叶,在远端蒂部用一号丝线结扎切除肝左侧叶。
1.6 尼氏染色 腹腔注射戊巴比妥深度麻醉小鼠,迅速开胸暴露心脏,经左心室向主动脉插管,剪开右心房,甲醛50 mL经升主动脉快速冲洗,断头,液氮速冻组织切片(5 μm)4 ℃丙酮固定15 min,纯蒸水冲洗3次,每次5 min,用1%甲苯胺蓝水溶液置50 ℃温箱中染色30 min,纯蒸水冲洗3次,每次5 min,95%乙醇迅速分化,无水乙醇脱水,二甲苯透明,中性树胶封固,显微镜下观察拍照分析,并用Image-Pro Plus 6.0 软件分析尼氏体IOD值。
1.7 Western Blot检测 在各时间点将小鼠麻醉后断头,冰上取海马组织,经0.01 mol/L磷酸缓冲盐溶液(PBS)清洗后,置于含有蛋白酶抑制剂的蛋白裂解液(RIPA裂解液)中裂解,离心后取上清液,部分上清液用于蛋白质浓度的测定(BCA法测定),余上清液置100 ℃煮沸变性结束后,上样行聚丙烯酰胺凝胶电泳,转膜、加一抗孵育过夜,HRP标记二抗处理。ECL发光液孵育、胶片曝光、显影、定影。用BIO-RAD Quantity One 4.5.0软件检测目的蛋白PSD-95的条带及内参β-acting条带的灰度值,将目的蛋白灰度值和内参灰度值的比值作为目的蛋白表达的相对水平。

2 结 果
2.1 水迷宫实验结果 与Rb1组比较,S组和N组术后3 d、7 d、14 d、21 d、28 d平均逃避潜伏期延长(P<0.05);S组和N组术后各时间点平均逃避潜伏期比较,差异均无统计学意义(P>0.05),详见图1A。与Rb1组比较,S组和N组术后3 d、7 d、14 d、21 d、28 d目标象限时间百分比及游泳距离明显缩短(P<0.05),详见图1B、图1C。各组之间小鼠游泳速度比较,差异均无统计学意义(P>0.05),详见图1D。

与S组同时间点比较,# P<0.05;与N组同时间点比较,* P<0.05。
2.2 尼氏染色结果 Rb1组小鼠术后7 d、14 d、21 d、28 d海马CA1区神经细胞排列密集,胞浆中尼氏体丰富;与Rb1组比较,S组和N组术后21 d、28 d神经元内尼氏小体部分溶解或消失,胞浆着色变淡神经元细胞排列紊乱,尼氏体表达明显减少,差异均有统计学意义(P<0.05)。详见图2、图3。
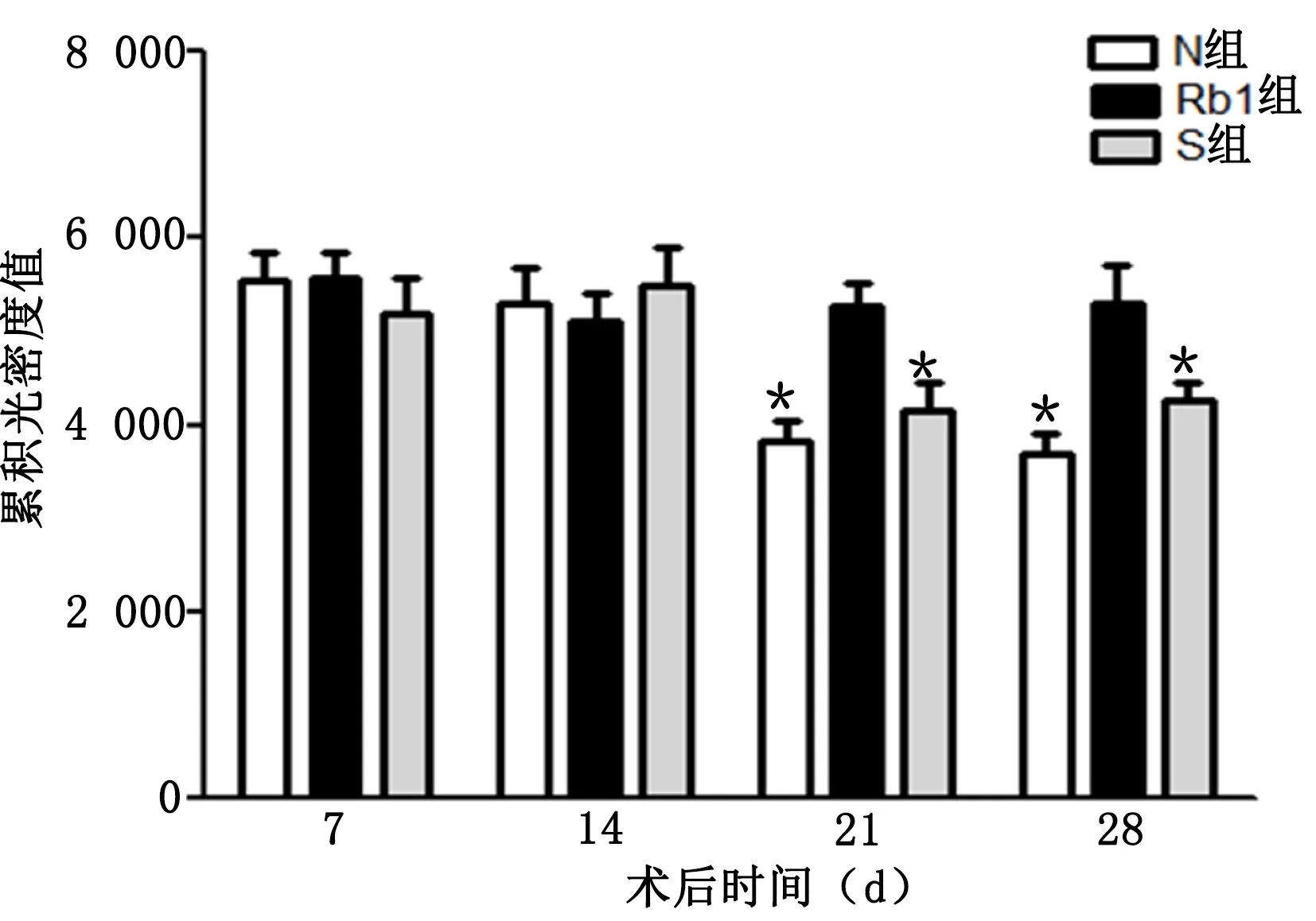
与Rb1组同时间点比较,* P<0.05。
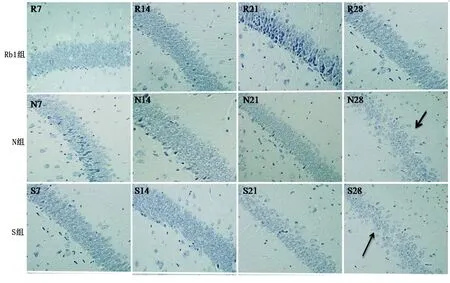
图2 APPswe/PS1dE9双转基因小鼠术后海马CA1区尼氏染色结果(×400)
2.3 Western Blot检测3组PSD-95蛋白表达 与Rb1组比较,S组和N组术后3 d、7 d、14 d 、21 d、28 d PSD-95蛋白表达逐渐降低,差异均有统计学意义(P<0.05);S组和N组比较,术后3 d、7 d、14 d 、21 d、28 d PSD-95蛋白表达,差异均无统计学意义(P>0.05)。详见图4。

与Rb1组同时间点比较,* P<0.05。
3 讨 论
β-淀粉样蛋白(amyloid-β protein,Aβ)的沉积,tau 蛋白高磷酸化是AD特征性病理改变。研究发现,手术创伤刺激引起的中枢神经系统炎性因子高表达可以诱发和加剧Aβ的异常聚集[5]。挥发性麻醉药物(异氟醚、地氟烷)通过上调Aβ前体蛋白切割酶β分泌酶(BACE)的活性,促进Aβ寡聚化进而诱导神经细胞凋亡[6-7]。围术期低温使神经元骨架蛋白tau蛋白过度磷酸化,造成神经元丢失,进而提示手术麻醉有可能是诱发和加剧AD高风险人群发病的潜在因素[8]。在本实验中,手术组及对照组AD模型小鼠术后3 d、7 d、14 d、21 d、28 d逃避潜伏期逐渐延长、目的象限时间百分比缩短,提示术后认知功能异常。人参皂苷是人参的生物活性成分之一,已发现大约有50多种,其中Rb1主要作用在中枢神经系统,对免疫细胞、细胞因子、一氧化氮、活性氧(ROS)等炎症介质均有抑制作用,通过多种途径不同环节在增强免疫力、活血、抗氧化、延缓衰老等方面发挥着重要的药理作用[9-13]。研究发现,人参皂苷Rb1通过改变β-淀粉样前体蛋白(β-amyloid precursor protein,APP)裂解途径,减少Aβ的生成,抑制Aβ诱导的神经毒性反应[14];通过抑制细胞凋亡因子Bax、Caspase-3表达,激活抗细胞凋亡因子Bcl-2,保护神经元细胞从而改善痴呆鼠的认知功能[2]。因此,从理论上讲,人参皂甙Rb1有可能成为治疗AD病人术后认知功能下降的潜在药物。既往研究显示,人参皂甙Rb1在60 mg/kg时可以有效改善老年鼠术后认知功能下降[15]。本研究结果显示,与手术组及对照组同时间点比较,人参皂甙Rb1组小鼠术后3 d、7 d、14 d、21 d、28 d找到安全平台的逃避潜伏期明显缩短,提示通过围术期给药,人参皂甙Rb1可以改善AD模型小鼠术后的记忆功能。
学习记忆与海马内突触相关蛋白表达水平密切相关,PSD-95位于突触后膜与F-actin骨架蛋白、神经递质受体和信号蛋白分子共同形成复合物参与突触后信号的转导和整合[16]。因此,本实验采用Western Blot检测海马内PSD-95的表达水平,结果显示,与Rb1组比较,手术组及对照组术后3 d、7 d、14 d、21 d、28 d PSD-95蛋白条带密度逐渐变小变浅,差异均有统计学意义(P<0.05),提示人参皂甙Rb1在保护突触功能及防止突触丢失中起重要作用。
神经元尼氏小体是反映神经元功能变化的重要指标,当神经元功能受损时,尼氏小体会溶解甚至消失。研究发现,人参皂甙Rb1可以通过上调神经元周期蛋白D1(Cyclin D1)表达、激活非磷脂酰肌醇3激酶(PI3K)依赖的蛋白激酶B(Akt)信号转导通路,进而保护神经元细胞的活性[17-18]。在本实验中,尼氏染色结果显示,人参皂甙Rb1组小鼠术后7 d、14 d、21 d、28 d海马CA1区神经元细胞排列密集、整齐,胞浆中尼氏体丰富,提示神经元活性功能正常,而手术组与对照组术后21 d、28 d小鼠海马CA1区神经元细胞排列紊乱,尼氏体表达减少。据此推测,人参皂苷Rb1通过诱导尼氏体的表达,进而维持神经元细胞形态和功能的稳定性。
综上所述,人参皂甙Rb1可能通过诱导突触相关蛋白PSD-95及神经元尼氏体的表达,改善突触结构,保护神经元活性,提高AD模型小鼠术后学习记忆能力。
