微小RNA-134靶向调控环腺苷酸应答元件结合蛋白/脑源性神经营养因子通路对脑卒中后抑郁海马神经细胞的影响
2022-03-04胡雅坤王志强梁家辉
胡雅坤,王志强,梁家辉
脑卒中后抑郁是急性脑血管损伤后发生的一种情感障碍性疾病,是脑卒中最常见的并发症之一,严重影响患者生活质量,提高了脑卒中的致残、病死率[1-2]。研究[3-4]显示,卒中会增加抑郁的风险,31%的脑卒中患者卒中后5年内会出现抑郁,脑卒中后抑郁已成为严重的社会公共健康问题。因此,探索脑卒中后抑郁发病机制及治疗方法是目前亟需解决的问题。微小RNA(miRNA)是一种长约22个核苷酸的小分子非编码RNA,可结合靶向mRNA的3′-UTR影响靶基因表达。研究[5]显示,miR-134在调节大鼠慢性应激诱导的结构可塑性和抑郁样行为方面发挥重要作用。环腺苷酸应答元件结合蛋白(CREB)是一种转录因子,应激后发生磷酸化,调控下游靶基因脑源性神经营养因子(BDNF)的转录,在神经元生长、突触形成等方面发挥重要调节作用[6-7]。有研究[8]发现,CREB/BDNF通路参与栀子果实油脂发挥抗抑郁作用的信号传导过程。本研究将建立脑卒中后抑郁大鼠模型,检测大鼠海马中miR-134表达水平,并进一步通过下调miR-134表达,探究其对海马神经细胞增殖、凋亡的影响及相关机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 SD大鼠购自广州永诺生物科技有限公司[许可证号:SYXK(粤)2018-0186],质量(250±5)g。
1.1.2 试剂与仪器 胎牛血清(货号:FBS500-S)购自澳大利亚AusGeneX公司;DMEM培养基(货号:GMS12322.1)购自美国GENMED公司;Lipofectamine 2000转染试剂(货号:11668019)购自美国Invitrogen公司;SYBR Green实时荧光定量PCR(qRT-PCR)试剂盒(货号:4472908)购自美国Applied Biosystems公司;miRNA NC、miR-134 siRNA、miR-134阴性对照序列(negative control-miR-134)、miR-134模拟物(miR-134 mimic)及miR-134、CREB1、BDNF、U6、GAPDH引物均由生工生物工程(上海)股份有限公司合成;p-CREB1抗体、CREB1抗体、BDNF抗体、GAPDH抗体、羊抗兔lgG(货号:ab254107、ab178322、ab226843、ab181602、ab6721)购自abcam公司;CCK-8试剂(货号:CK-04)购自日本同仁化学研究所;AnnexinV-FITC/PI细胞凋亡检测试剂盒(货号:S0185)购自哈尔滨新海基因检测有限公司;双荧光素酶报告基因检测试剂盒(货号:556547)购自美国BD公司。恒温培养箱(型号:MIR-162-PC/MIR-262-PC)购自日本松下公司;荧光定量PCR仪(型号:ABI 7500)购自美国Applied Biosystems公司;酶标仪、化学发光成像系统(型号:MODEL550、ChemiDocXRS)购自美国Bio-Rad公司;流式细胞仪(型号:Guauasoft 6 L)购自美国Millipor公司。
1.2 方法
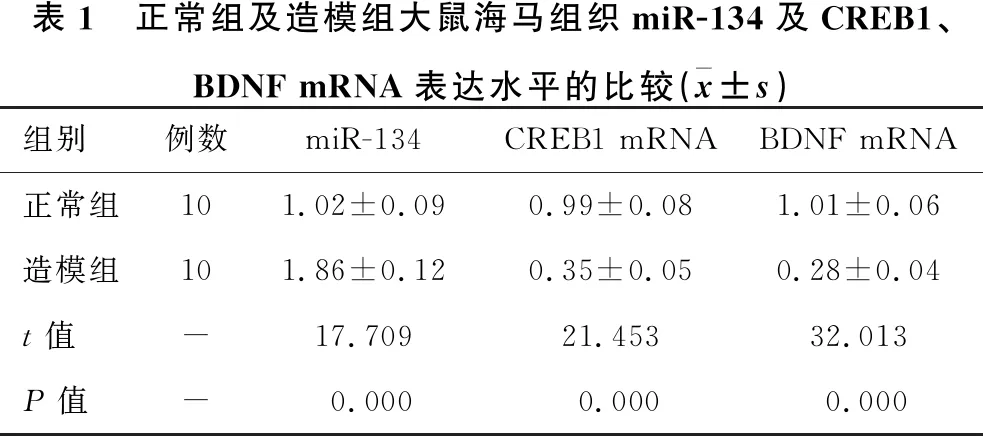
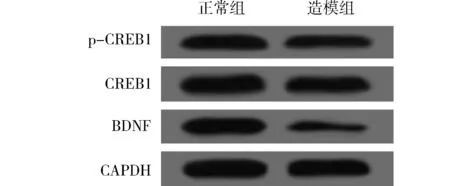
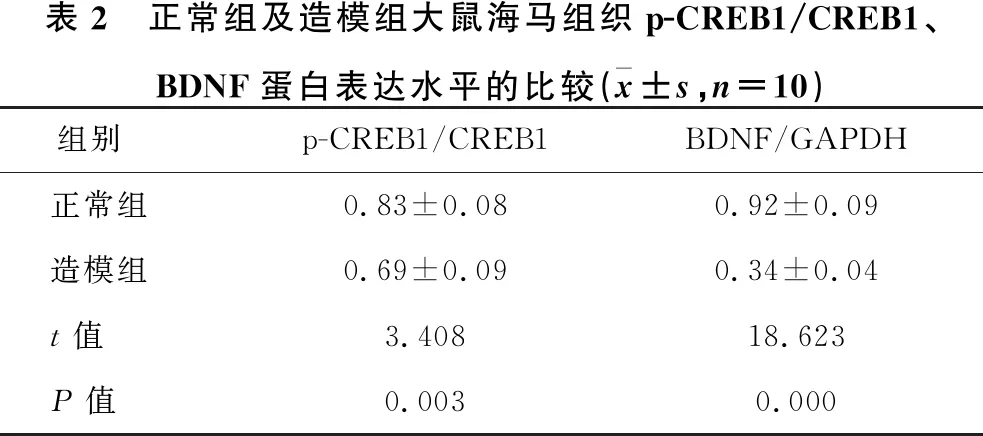
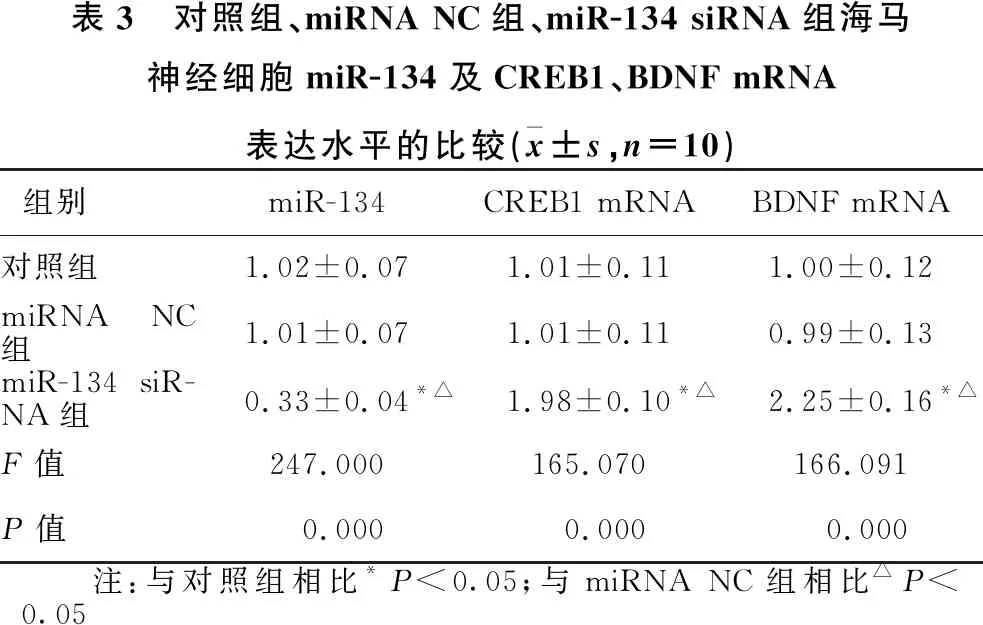
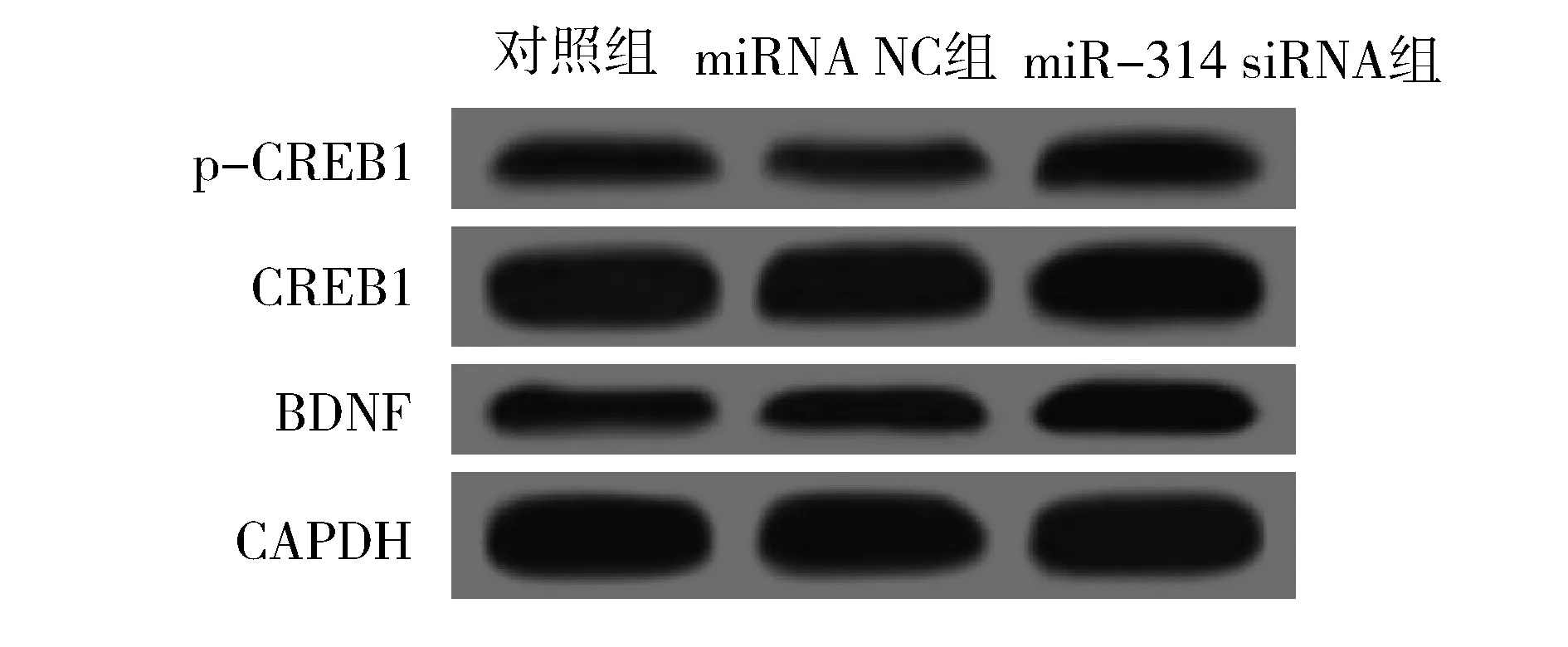
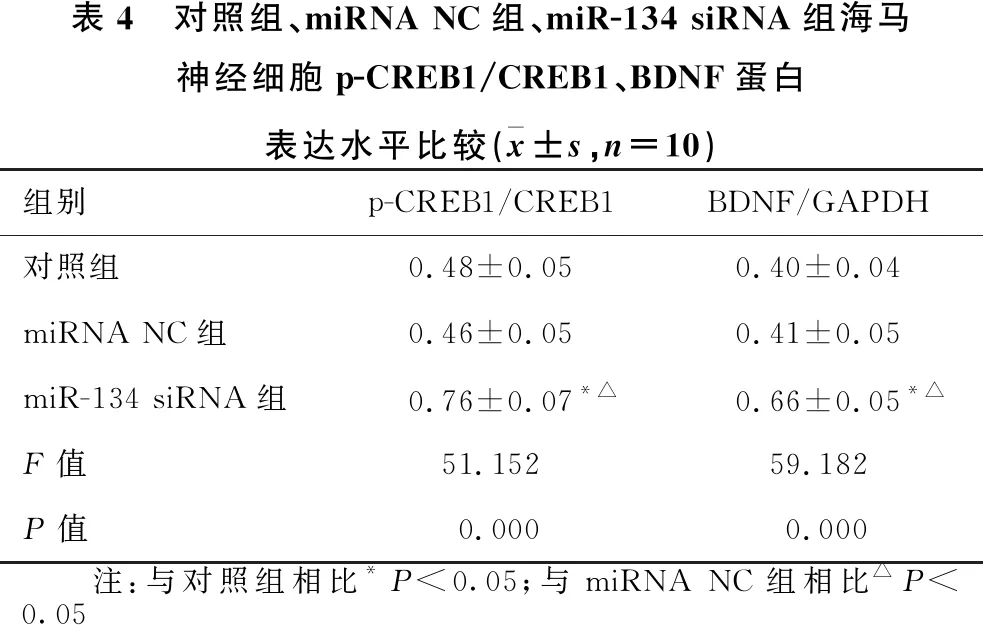
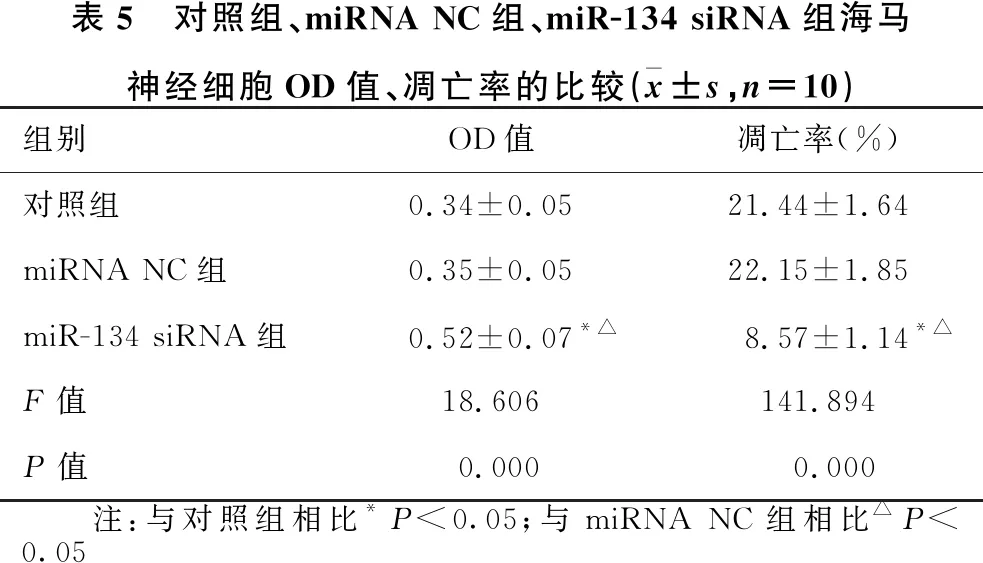
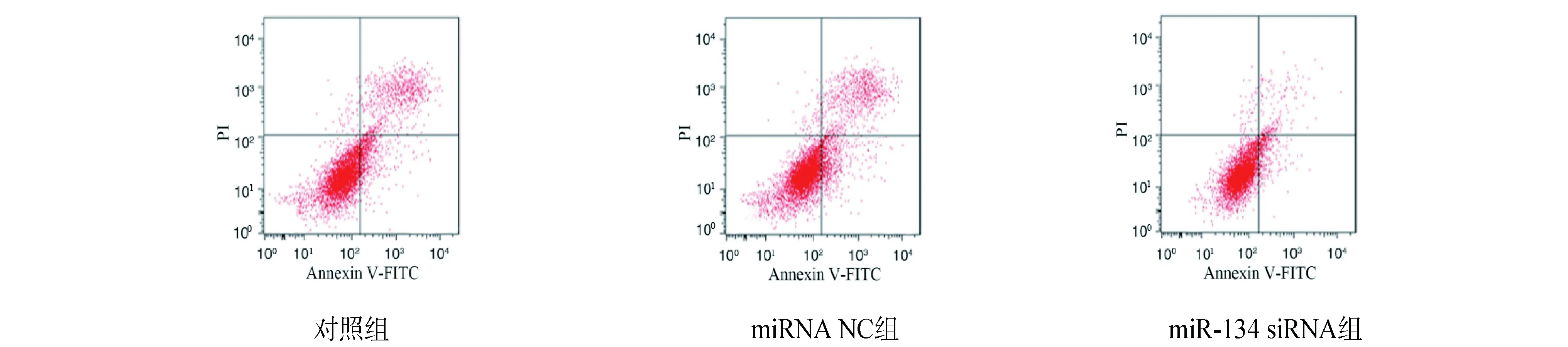
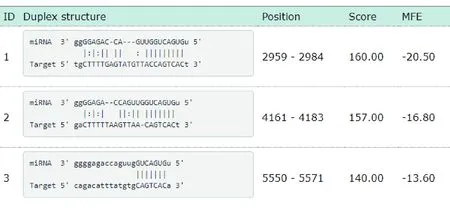
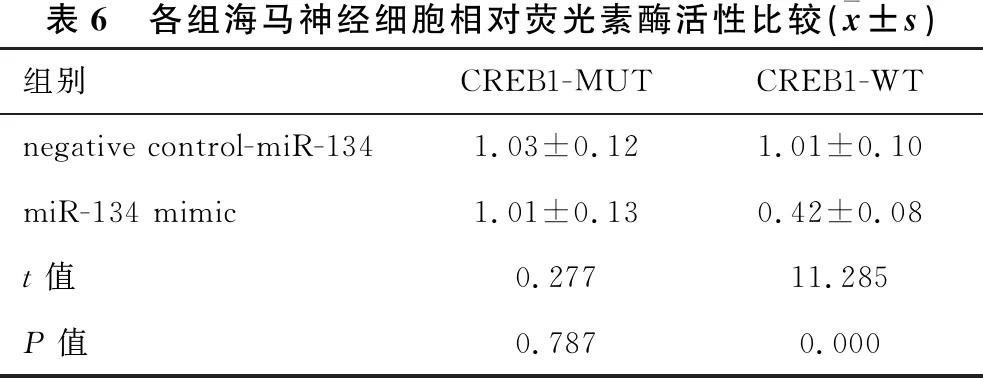
1.2.1 动物分组及造模 30只SD大鼠随机分为正常组(10只)和造模组(20只)。造模组采用大脑中动脉闭塞(MCAO)法建立脑卒中模型,1分 1.2.2 样本采集、细胞培养及分组 水合氯醛麻醉后处死大鼠,取脑分离海马组织,其中正常组10只大鼠海马组织与造模组10只大鼠海马组织用于mRNA及蛋白水平检测。造模组剩余10只大鼠海马用组织剪成1 mm×1 mm×1 mm小块,用胰酶消化,组织块消失后加胎牛血清终止消化,离心分离细胞。获得的海马神经细胞沉淀用含10%胎牛血清的DMEM培养基,置于37 ℃、5% CO2、饱和湿度的恒温培养箱中培养,隔天更换培养基。 将海马神经细胞接种于6孔或96孔培养板,分为对照组、miRNA NC组和miR-134 siRNA组,miRNA NC组、miR-134 siRNA组细胞用Lipofectamine 2000转染试剂分别转染miRNA NC、miR-134 siRNA。 1.2.3 实时荧光定量RT-PCR法检测miR-134及CREB1、BDNF mRNA表达水平 将1.2.2中各组细胞培养48 h,使用TRIzol试剂提取海马组织及细胞总RNA,逆转录合成cDNA,按照实时荧光定量RT-PCR试剂盒说明书检测miR-134、CREB1 mRNA、BDNF mRNA表达水平。采用2-ΔΔCt法计算目的基因表达量,内参基因为U6、GAPDH。反应程序:95 ℃ 60 s;95 ℃ 40 s,55 ℃ 35 s,72 ℃ 90 s,循环40次。miR-134上游引物:5′-GGG TGT GAC TGG TTG ACC-3′,下游引物:5′-CAG TGC GTG TCG TGG AGT-3′;CREB1上游引物:5′-AGA AGC AGC ACG AAA GAG AG-3′,下游引物:5′-CAC TGC CAC TCT GTT CTC TAA A-3′;BDNF上游引物:5′-GGT ATC CAA AGG CC AAC TGA-3′,下游引物:5′-CTT ATG AAT CGC CAG CCA AT-3′;内参U6上游引物:5′-GCT TGC GCA CGA GAT ATA GTA AAA T-3′,下游引物:5′-CCG TTG AGC AAT TTG CCT GTG AT-3′;内参GAPDH上游引物:5′-AGG TCG GTG TGA ACG GAT TTG-3′,下游引物:5′-TGT AGA CCA TGT AGT TGA GGT CA-3′。 1.2.4 Western blotting法检测p-CREB1、CREB1、BDNF蛋白表达 将1.2.2中各组细胞培养48 h,使用蛋白提取试剂盒提取海马组织及细胞总蛋白,BCA法定量。电泳分离、转膜、脱脂奶粉封闭后,加入p-CREB1抗体、CREB1抗体、BDNF抗体、GAPDH抗体(1∶500),4 ℃孵育过夜,TBST洗涤3次,加辣根过氧化物酶标记的羊抗兔二抗(1∶2 000),室温孵育1 h,TBST洗涤3次,化学发光法显色、显影,蛋白条带采用化学发光成像系统进行分析。 1.2.5 CCK-8法检测细胞增殖情况 将1.2.2中各组细胞培养48 h,加入CCK-8试剂继续培养2 h,在450 nm处检测各孔吸光度(OD)值。 1.2.6 细胞凋亡情况的检测 将1.2.2中各组细胞培养48 h,收集细胞,胰酶消化、洗涤,调整细胞浓度为1×106个/ml,依次加入Annexin V-FITC、PI各5 μl,避光孵育1 h,使用流式细胞仪检测细胞凋亡率。 1.2.7 双荧光素酶报告基因实验验证miR-134与CREB1的靶向作用关系 利用miRTarBase软件预测miR-134与CREB1的结合位点。构建CREB1基因的野生型和突变型3′UTR-CREB1荧光素酶表达载体(CREB1-WT和CREB1-MUT),采用脂质体转染技术分别与negative control-miR-134、miR-134 mimic共同转入海马神经细胞中。使用双荧光素酶报告基因检测试剂盒测定荧光素酶活性。 2.1 正常组及造模组大鼠海马组织miR-134及CREB1、BDNF mRNA表达水平的比较 见表1。与正常组相比,造模组大鼠海马组织中miR-134表达水平显著升高,CREB1、BDNF mRNA表达水平显著降低(均P<0.05)。 表1 正常组及造模组大鼠海马组织miR-134及CREB1、BDNF mRNA表达水平的比较(x±s)组别例数miR-134CREB1 mRNABDNF mRNA正常组101.02±0.090.99±0.081.01±0.06造模组101.86±0.120.35±0.050.28±0.04t值-17.70921.45332.013P值-0.0000.0000.000 2.2 正常组及造模组大鼠海马组织p-CREB1/CREB1、BDNF蛋白表达的比较 见图1、表2。与正常组相比,造模组大鼠海马组织中p-CREB1/CREB1、BDNF蛋白表达水平显著降低(均P<0.05)。 2.3 对照组、miRNA NC组、miR-134 siRNA组海马神经细胞CREB1、BDNF mRNA表达水平的比较 见表3。对照组与miRNA NC组海马神经细胞CREB1、BDNF mRNA表达水平差异无统计学意义(均P>0.05)。与对照组、miRNA NC组相比,miR-134 siRNA组海马神经细胞中CREB1、BDNF mRNA表达水平显著升高(均P<0.05)。 图1 正常组及造模组大鼠海马组织p-CREB1、CREB1、BDNF蛋白表达情况 表2 正常组及造模组大鼠海马组织p-CREB1/CREB1、BDNF蛋白表达水平的比较(x±s,n=10)组别p-CREB1/CREB1BDNF/GAPDH正常组0.83±0.080.92±0.09造模组0.69±0.090.34±0.04t值3.40818.623P值0.0030.000 表3 对照组、miRNA NC组、miR-134 siRNA组海马神经细胞miR-134及CREB1、BDNF mRNA表达水平的比较(x±s,n=10)组别miR-134CREB1 mRNABDNF mRNA对照组1.02±0.071.01±0.111.00±0.12miRNA NC组1.01±0.071.01±0.110.99±0.13miR-134 siR-NA组0.33±0.04*△1.98±0.10*△2.25±0.16*△F值247.000165.070166.091P值0.0000.0000.000 注:与对照组相比*P<0.05;与miRNA NC组相比△P<0.05 2.4 对照组、miRNA NC组、miR-134 siRNA组海马神经细胞p-CREB1/CREB1、BDNF蛋白表达的比较见图2、表4。对照组与miRNA NC组海马神经细胞中p-CREB1/CREB1、BDNF蛋白表达水平差异无统计学意义(均P>0.05);与对照组、miRNA NC组相比,miR-134 siRNA组海马神经细胞中p-CREB1/CREB1、BDNF蛋白表达水平显著升高(均P<0.05)。 图2 对照组、miRNA NC组、miR-134 siRNA组海马神经细胞p-CREB1、CREB1、BDNF蛋白表达情况 2.5 对照组、miRNA NC组、miR-134 siRNA组海马神经细胞增殖情况 见表5。对照组与miRNA NC组海马神经细胞OD值差异无统计学意义(P>0.05)。与对照组、miRNA NC组相比,miR-134 siRNA组海马神经细胞OD值显著升高(均P<0.05)。 表4 对照组、miRNA NC组、miR-134 siRNA组海马神经细胞p-CREB1/CREB1、BDNF蛋白表达水平比较(x±s,n=10)组别p-CREB1/CREB1BDNF/GAPDH对照组0.48±0.050.40±0.04miRNA NC组0.46±0.050.41±0.05miR-134 siRNA组0.76±0.07*△0.66±0.05*△F值51.15259.182P值0.0000.000 注:与对照组相比*P<0.05;与miRNA NC组相比△P<0.05 2.6 对照组、miRNA NC组、miR-134 siRNA组海马神经细胞凋亡情况的比较 见表5、图3。对照组与miRNA NC组海马神经细胞凋亡率差异无统计学意义(P>0.05);与对照组、miRNA NC组相比,miR-134 siRNA组海马神经细胞凋亡率显著降低(均P<0.05)。 表5 对照组、miRNA NC组、miR-134 siRNA组海马神经细胞OD值、凋亡率的比较(x±s,n=10)组别OD值凋亡率(%)对照组0.34±0.0521.44±1.64miRNA NC组0.35±0.0522.15±1.85miR-134 siRNA组0.52±0.07*△8.57±1.14*△F值18.606141.894P值0.0000.000 注:与对照组相比*P<0.05;与miRNA NC组相比△P<0.05 图3 各组对照组、miRNA NC组、miR-134 siRNA组海马神经细胞凋亡情况 2.7 miR-134与CREB1的靶向作用关系验证 见图4、表6。miRTarBase网站预测显示,miR-134与CREB1基因存在结合位点。双荧光素酶报告基因实验结果显示,共转染CREB1-MUT、negative control-miR-134与共转染CREB1-MUT、miR-134 mimic的细胞荧光素酶活性差异无统计学意义(P>0.05);与共转染CREB1-WT、negative control-miR-134相比,共转染CREB1-WT、miR-134 mimic的细胞荧光素酶活性显著降低(P<0.05)。 图4 生物信息学分析miR-134与CREB1的结合位点 表6 各组海马神经细胞相对荧光素酶活性比较(x±s)组别CREB1-MUTCREB1-WTnegative control-miR-1341.03±0.121.01±0.10miR-134 mimic1.01±0.130.42±0.08t值0.27711.285P值0.7870.000 脑卒中是常见的脑血管疾病,发病率、致残率、致死率均处于较高水平,且其发病率随年龄增加而增高[10]。脑卒中后抑郁是脑卒中发生后的常见并发症,主要表现为自责、悲伤、睡眠障碍、疲乏、情绪低落、兴趣下降甚至产生自杀企图等,在脑卒中的急性期、恢复期等阶段均可发生[11]。脑卒中后抑郁会减慢患者神经功能的恢复程度,影响患者生活质量及预后结局,但其具体发病机制尚不明确,临床治疗也缺乏稳定有效的方案。海马是与认知功能相关的经典脑区,在机体遭受急性创伤应激后发生病理生理改变,进而影响大脑认知功能。本研究采用MCAO法、CUMS法建立大鼠脑卒中后抑郁模型,初步探讨在脑卒中后抑郁大鼠海马中差异表达的分子,并通过体外培养海马神经细胞,探讨影响海马神经细胞增殖、凋亡的因素及相关机制。 miRNA是一类非编码小分子RNA,具有调控功能,广泛存在于动植物中,长约18~25个核苷酸,通过互补配对与靶基因的3′-UTR结合,进而抑制靶基因翻译或诱导靶基因降解,在癌症、卒中等多种疾病的发生发展过程中发挥重要作用[12]。越来越多的证据[13]表明,miR-134参与神经功能的调节。研究[14]报道,miR-134是大脑特异性的miRNA,在缺血/再灌注损伤过程中参与诱导神经细胞死亡。Fiore等[15]研究表明,miR-134依赖性调节在稳态突触抑制过程中是不可或缺的。而Fan等[5]通过建立大鼠抑郁模型发现,miR-134介导的神经元结构可塑性失调可能与应激大鼠抑郁样行为的表现有关。本研究检测大鼠海马区miR-134表达发现,其在脑卒中后抑郁模型大鼠海马组织中显著升高,提示miR-134上调可能与大鼠发生脑卒中后抑郁有关。体外培养脑卒中后抑郁模型大鼠海马组织中神经细胞,通过转染siRNA下调miR-134表达发现,海马神经细胞增殖水平随之升高,凋亡水平降低,提示miR-134表达水平可影响海马神经细胞的增殖、凋亡过程,可能通过影响细胞生物学进程在大鼠发生脑卒中后抑郁过程中发挥作用,但具体机制尚不知晓。 CREB是一种与应激相关的重要核蛋白,存在于CNS内,在应激发生后磷酸化激活,调控下游信号通路,从而发挥生物学效应[16]。BDNF是一个与神经损伤修复有关的分子,参与抑郁症病理生理发生过程,在抑郁症大鼠海马区表达下调,上调其表达可减轻大鼠海马神经元皮质酮损伤[17]。Liu等[18]研究表明,CREB激活后能促进BDNF表达,激活BDNF相关信号通路,恢复脑卒中导致的神经功能损伤。本研究结果显示,脑卒中后抑郁模型大鼠海马组织中CREB1、BDNF mRNA表达水平及p-CREB1/CREB1、BDNF蛋白表达水平均显著降低,提示CREB/BDNF通路受到抑制可能与脑卒中后抑郁发生有关。Shen等[19]研究发现,白藜芦醇治疗改善CUMS诱发的抑郁样行为、认知缺陷的潜在机制与CREB磷酸化、BDNF水平升高及miR-134水平降低有关。本研究显示,下调miR-134在海马神经细胞中的表达后,CREB1、BDNF mRNA表达水平及p-CREB1/CREB1、BDNF蛋白表达水平均显著升高。而生物信息学分析及双荧光素酶报告基因实验结果显示,miR-134与CREB1基因存在结合位点,miR-134可在海马神经细胞中靶向CREB1表达。Yang等[20]研究发现,miR-134在心肌细胞凋亡过程中通过抑制CREB1表达发挥作用。Huang等[14]研究显示,miR-134通过下调CREB表达在缺血/再灌注损伤过程中诱导神经细胞死亡。由此推测,miR-134可能通过下调CREB表达并抑制其磷酸化,导致BDNF表达水平降低,进而导致脑卒中后抑郁发生。 综上所述,脑卒中后抑郁大鼠海马miR-134表达上调,CREB1、BDNF表达下调,抑制海马神经细胞miR-134表达可导致CREB1、BDNF表达上调,并促进细胞增殖,减少细胞凋亡,推测miR-134可能通过抑制CREB/BDNF通路参与脑卒中后抑郁发生过程。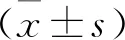
2 结 果
3 讨 论
