1-甲基-4-苯基-1,2,3,6-四氢吡啶制备的帕金森病模型小鼠对帕金森病自主神经功能障碍的适用性研究
2022-03-04汪烨姜雯雯吴晶程越张克忠
汪烨,姜雯雯,吴晶,程越,张克忠
帕金森病(PD)是继Alzheimer’s病后最常见的神经退行性疾病。PD患者黑质致密部(SNpc)中多巴胺能神经元死亡,基底神经节内多巴胺缺乏导致经典运动障碍,包括运动迟缓、肌强直、静止性震颤以及姿势和步态障碍[1]。随着对PD研究的不断深入,认知功能障碍、焦虑抑郁、感觉障碍、自主神经功能障碍等非运动症状越来越受到重视。自主神经系统功能障碍是一种常见且重要的非运动症状,且有证据[2]表明,PD患者运动功能障碍出现前几年甚至几十年可能就存在自主神经功能障碍,其形式不一,涉及多个系统及器官,以胃肠功能、膀胱功能、心血管功能障碍多见。有研究[3]发现,自主神经功能障碍出现越早,疾病进展越快,患者的生存期越短。目前关于PD自主神经功能障碍的机制研究较少,且缺乏经典实验模型。1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)小鼠PD模型能够模拟PD的病理表现,被广泛用于PD运动功能障碍研究[4]。本文通过评估MPTP小鼠模型不同时程各内脏系统的自主神经功能变化,探讨MPTP小鼠模型在PD自主神经功能障碍机制研究中的适用性,为PD自主神经功能障碍研究提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 2月龄SPF级野生型(WT)雄性C57BL/6J小鼠20只,质量24~29 g,购自南京医科大学医药实验动物中心。
1.1.2 常用试剂与仪器 MPTP(Sigma-Aldrich,St. Louis,MO),丙磺舒(#57-66-9,济南尚圣化工有限公司),二甲基亚砜(DMSO,30072418,国药集团化学试剂有限公司),生理盐水,鼠抗酪氨酸羟化酶多克隆抗体(TH,T1299,Sigma-Aldrich),过氧化物酶标记山羊抗小鼠IgG(H+L)(33201ES60,上海翊圣生物科技有限公司),DAB显色液(江苏凯基生物技术股份有限公司)。PowerLab 26T多导生理记录仪,分离代谢笼,JLBehv-RRTG-5通用转棒实验分析系统(上海吉量软件科技有限公司),Leica CM 950冰冻切片机,Bio-Rad仪器,Tanon 5200自动化学发光成像分析系统,蔡司AXIO显微镜。
1.2 方法
1.2.1 慢性PD小鼠模型的制备及实验设计 将20只雄性C57BL/6J小鼠随机分为对照组(n=10)和MPTP组(n=10),所有动物在造模前先适应1周。对照组皮下注射无菌生理盐水0.1 ml/10 g,1 h后腹腔注射以DMSO溶解浓度为250 mg/ml的丙磺舒溶液10 μl/10 g;MPTP组皮下注射浓度为2 mg/ml的MPTP生理盐水溶液0.1 ml/10 g,1 h后腹腔注射丙磺舒溶液10 μl/10 g。注射频率均为2次/周,持续5周[5]。在造模期不同时间行胃肠功能、泌尿功能、心血管功能及运动功能评估,造模结束后取材进行病理学评估,具体实验流程见图1。所有实验步骤及处理均通过南京医科大学动物保护与伦理委员会批准。
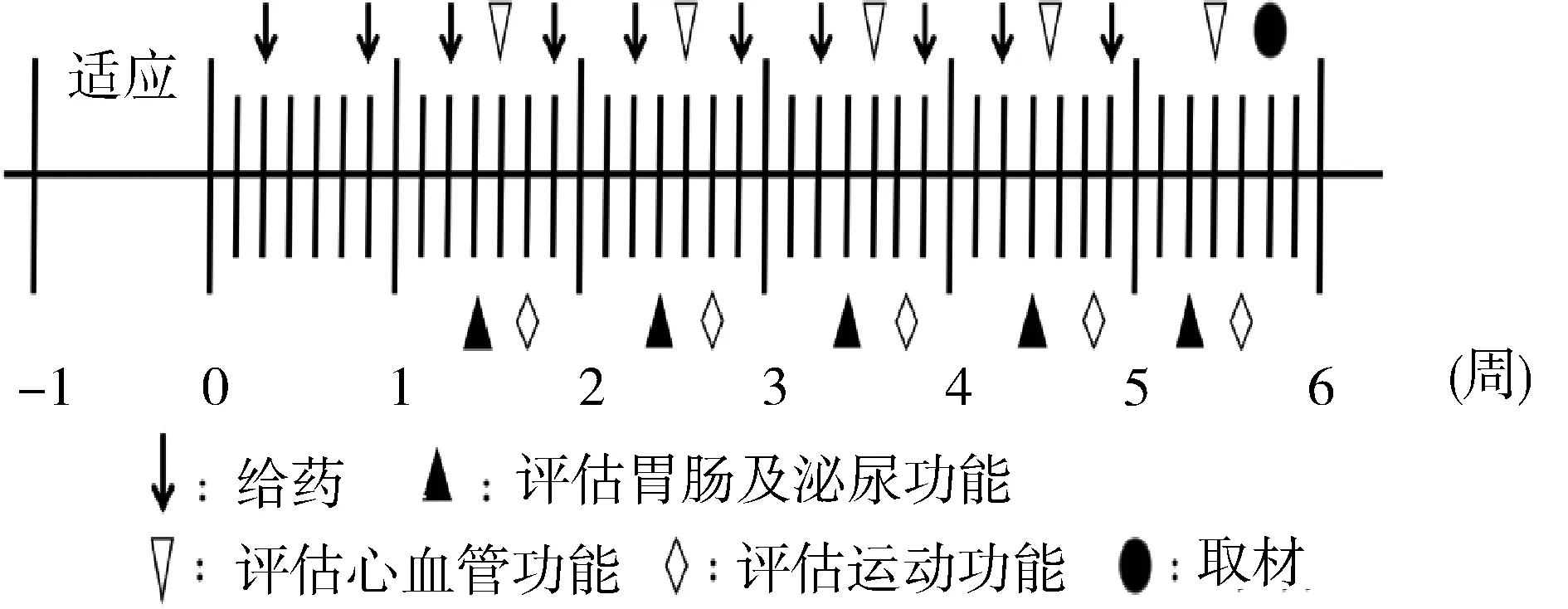
图1 实验流程图
1.2.2 胃肠功能评估 于第2~6周记录小鼠的1 h排便颗粒数及粪便含水量。小鼠禁食过夜,在测试前2 h给予充足食物。将小鼠放在干净的分离代谢笼中1 h,收集粪便,计数并称重,经65 ℃烘干过夜再次称重。粪便含水量=(粪便湿重-粪便干重)/粪便湿重×100%[6]。
1.2.3 泌尿功能评估 于第2~6周评估小鼠的泌尿功能。在清洁干燥的桌面上放好滤纸,用2 000 ml的烧杯将小鼠扣在滤纸上,持续1 h。在小鼠排尿滤纸充分吸收尿液后更换滤纸,并标记好尿液浸润的面积,同时记录1 h内小鼠排尿次数。滤纸风干48 h后剪下标记好的部分,称重。将0.05 ml、0.10 ml、0.15 ml、0.20 ml、0.25 ml、0.30 ml、0.35 ml、0.40 ml的生理盐水分别滴在滤纸上,标记浸润的面积,待48 h风干后剪下称重,并计算盐水体积与滤纸干重的线性方程[小鼠平均单次排尿量(ml)=0.8088×吸收尿液的滤纸平均干重-0.0036],其中相关系数r=0.9994[7]。
1.2.4 心血管功能评估 腹腔注射4%水合氯醛(0.1 ml/10 g)麻醉小鼠,通过保温垫将体温维持在37 ℃,使用生物电势电极监测ECG,使用powerlab 26T数据采集系统收集图像。截取基线平稳持续3 min的ECG图像,通过labchart软件分析小鼠心率及心率变异性。在时域中以连续RR间隔差的均方根(RMSSD)(ms2)表示的自主性指标进行测量。
1.2.5 运动功能评估 (1)转棒测试:于第2~6周采用转棒实验评估MPTP组运动协调能力。将小鼠放于仪器的转动滚筒上,转轴可加速。仪器自动记录小鼠在转棒上的停留时间,参数:低速≥5 r/min,高速≤25 r/min;加速时间2 min,持续时间5 min。每只小鼠进行3次测试,结果取平均值。(2)爬竿测试:于第2~6周采用爬竿测试检测小鼠的运动能力。制作一根直径1.2 cm、高 50 cm的直爬杆,顶部有一外面覆盖纱布的木球。将小鼠头部向上放置于杆顶端,记录转头时间(从开始运动到完全转为头向下的时间)及爬竿时间(转头后向下爬并到达底端的时间)。每只小鼠检测3次,取最短时间记录。每次测量前用酒精消毒去除残留气味,以免影响结果。
1.2.6 中脑黑质多巴胺能神经元的检测 运动功能及自主神经功能检测结束后,对黑质区域行TH免疫组化染色。采用4%的水合氯醛进行麻醉,行心脏灌注,取脑后固定并脱水,将厚度20 μm的冰冻中脑切片放置PBS中清洗3次,3% H2O2灭活,5% BSA封闭,一抗过夜,二抗室温敷育2 h,DAB显色液显色,过梯度乙醇、二甲苯脱水,中性树胶封片。每只小鼠选5张部位一致的中脑切片进行观察,高倍镜下随机选取5个视野进行阳性细胞计数。计算平均值后,将两组数据进行归一化比较,以对照组作为阴性对照。
1.2.7 小鼠TH表达的检测 采用Western blotting法检测小鼠中脑的TH表达。取小鼠的中脑黑质称重,加入RIPA裂解液,冰上超声匀浆后裂解30 min,以16 000g在4 ℃离心机中离心分离15 min,收集上层透明液体于EP管中。用BCA方法测蛋白浓度。将蛋白样品加入提前制好的凝胶中,通过电泳、电转将蛋白转到PVDF膜上,再经封闭、敷一抗、二抗、漂洗。用显色液发光检测,自动化学发光成像分析系统显影,应用Image J软件分析条带灰度值,以待测目的蛋白与内参蛋白的灰度值之比表示蛋白的相对表达量。
2 结 果
2.1 对照组与MPTP组胃肠功能的比较 见表1。与对照组相比,MPTP组第4~6周排便颗粒数显著减少(P<0.05~0.01),第5~6周粪便含水量显著降低(均P<0.05)。
2.2 对照组与MPTP组泌尿功能的比较 见表2。与对照组相比,MPTP组第5~6周1 h排尿次数显著增多(均P<0.01),平均单次尿量显著下降(均P<0.01)。
2.3 对照组与MPTP组小鼠心率变异性的比较 见表3。与对照组相比,MPTP组小鼠心率及RMSSD在各时间点差异均无统计学意义(均P>0.05)。
2.4 对照组与MPTP组运动功能的比较 见表4。对照组与MPTP组小鼠第2~5周运动功能差异无统计学意义,第6周MPTP组小鼠转头时间及爬杆时间显著延长(均P<0.05),转棒时间显著减少(均P<0.05)。
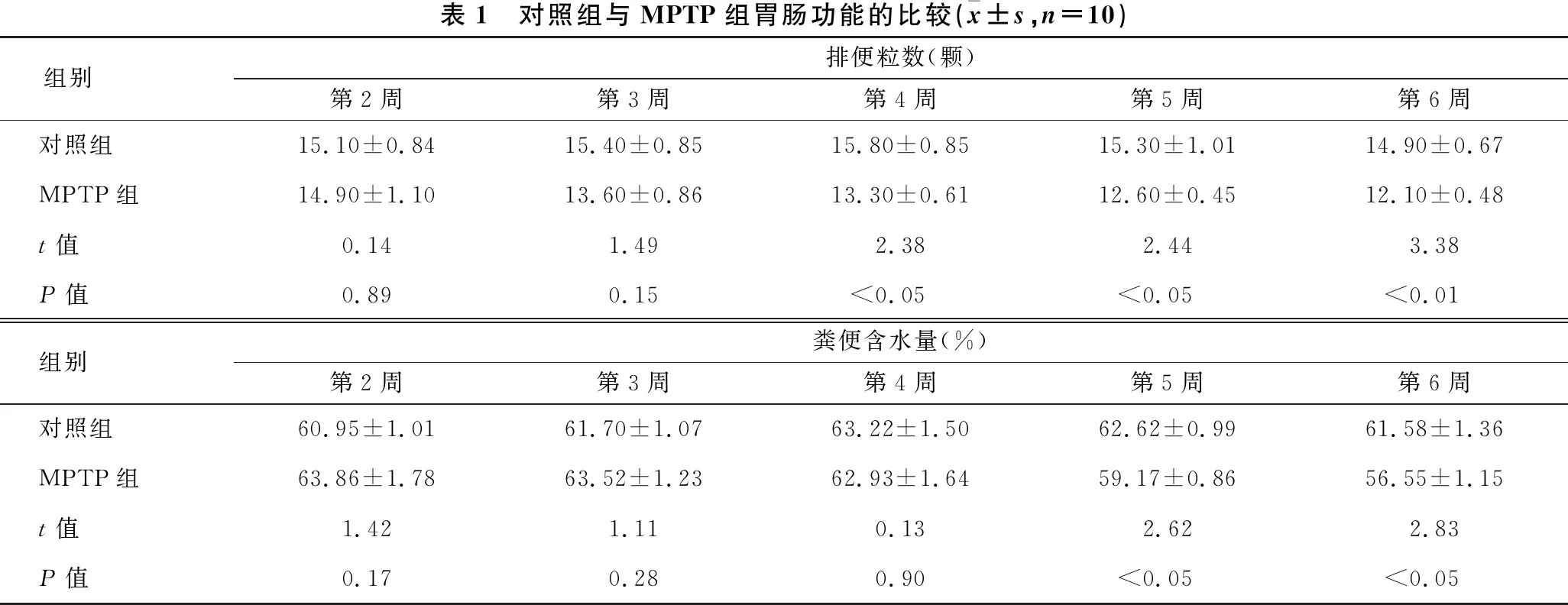
表1 对照组与MPTP组胃肠功能的比较(x±s,n=10)组别排便粒数(颗)第2周第3周第4周第5周第6周对照组15.10±0.8415.40±0.8515.80±0.8515.30±1.0114.90±0.67MPTP组14.90±1.1013.60±0.8613.30±0.6112.60±0.4512.10±0.48t值0.141.492.382.443.38P值0.890.15<0.05<0.05<0.01组别粪便含水量(%)第2周第3周第4周第5周第6周对照组60.95±1.0161.70±1.0763.22±1.5062.62±0.9961.58±1.36MPTP组63.86±1.7863.52±1.2362.93±1.6459.17±0.8656.55±1.15t值1.421.110.132.622.83P值0.170.280.90<0.05<0.05
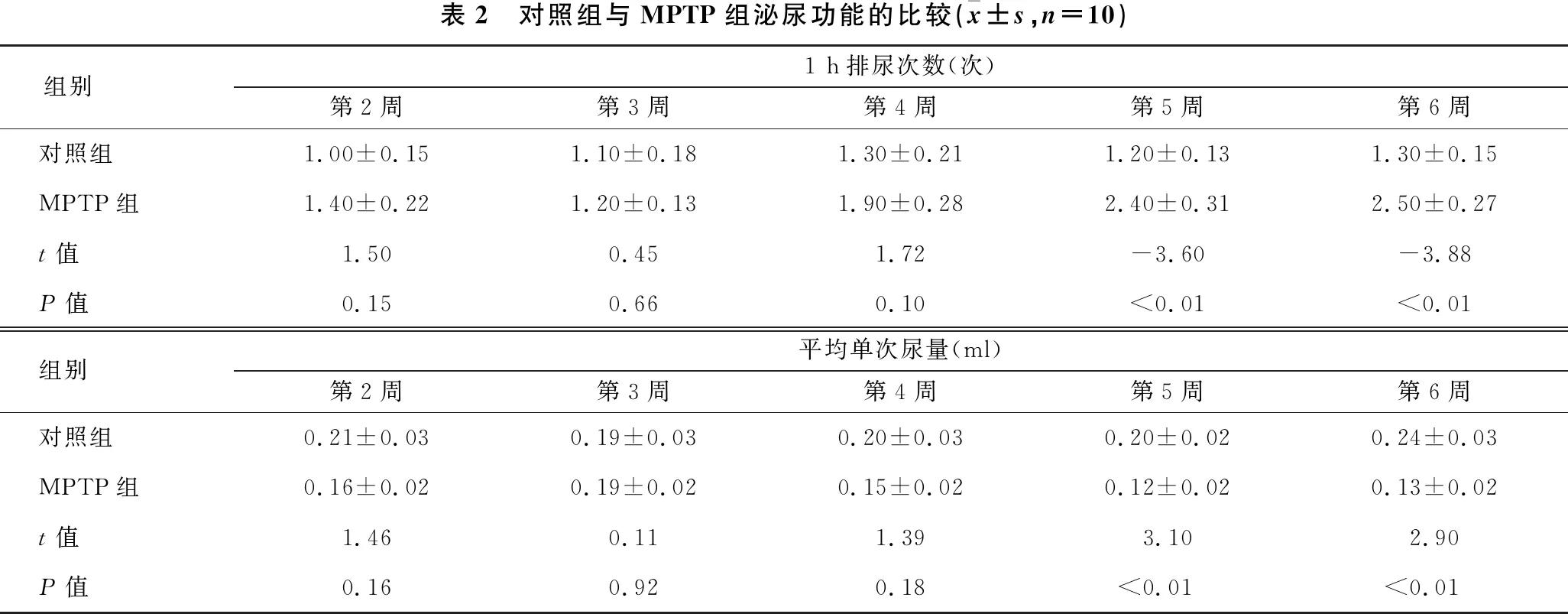
表2 对照组与MPTP组泌尿功能的比较(x±s,n=10)组别1 h排尿次数(次)第2周第3周第4周第5周第6周对照组1.00±0.151.10±0.181.30±0.211.20±0.131.30±0.15MPTP组1.40±0.221.20±0.131.90±0.282.40±0.312.50±0.27t值1.500.451.72-3.60-3.88P值0.150.660.10<0.01<0.01组别平均单次尿量(ml)第2周第3周第4周第5周第6周对照组0.21±0.030.19±0.030.20±0.030.20±0.020.24±0.03MPTP组0.16±0.020.19±0.020.15±0.020.12±0.020.13±0.02t值1.460.111.393.102.90P值0.160.920.18<0.01<0.01
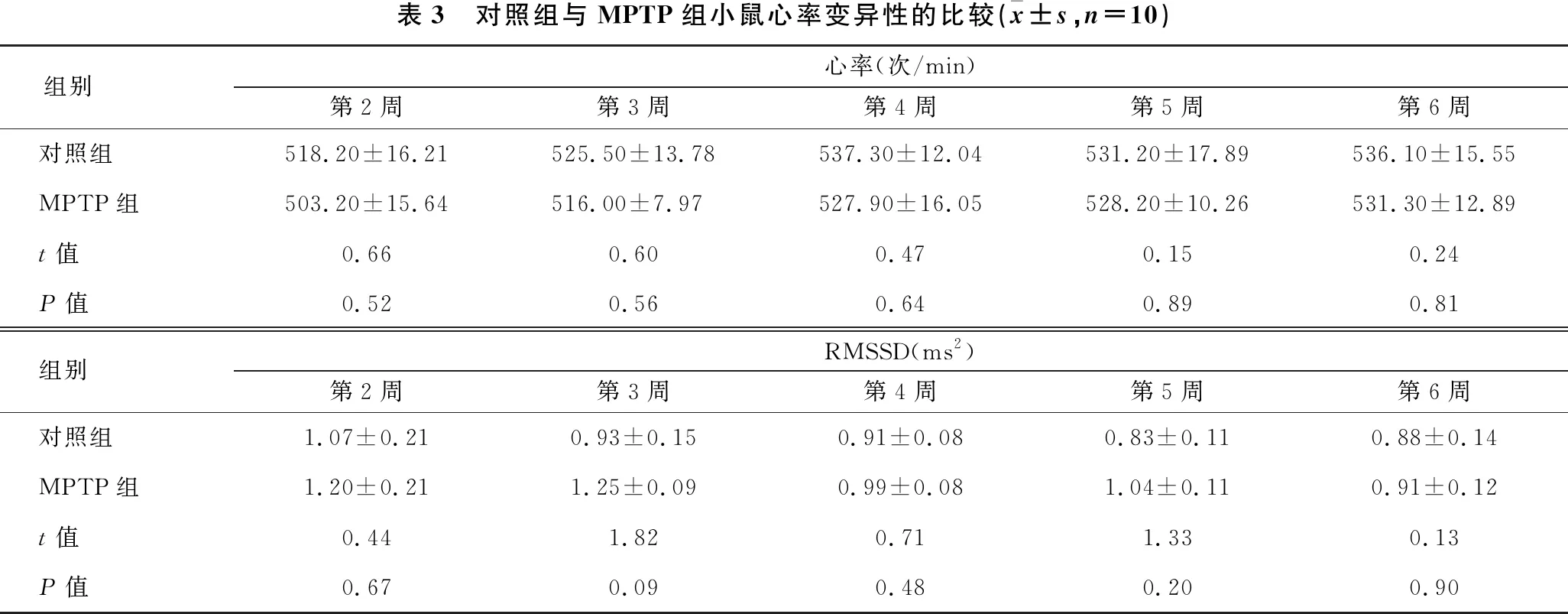
表3 对照组与MPTP组小鼠心率变异性的比较(x±s,n=10)组别心率(次/min)第2周第3周第4周第5周第6周对照组518.20±16.21525.50±13.78537.30±12.04531.20±17.89536.10±15.55MPTP组503.20±15.64516.00±7.97527.90±16.05528.20±10.26531.30±12.89t值0.660.600.470.150.24P值0.520.560.640.890.81组别RMSSD(ms2)第2周第3周第4周第5周第6周对照组1.07±0.210.93±0.150.91±0.080.83±0.110.88±0.14MPTP组1.20±0.211.25±0.090.99±0.081.04±0.110.91±0.12t值0.441.820.711.330.13P值0.670.090.480.200.90
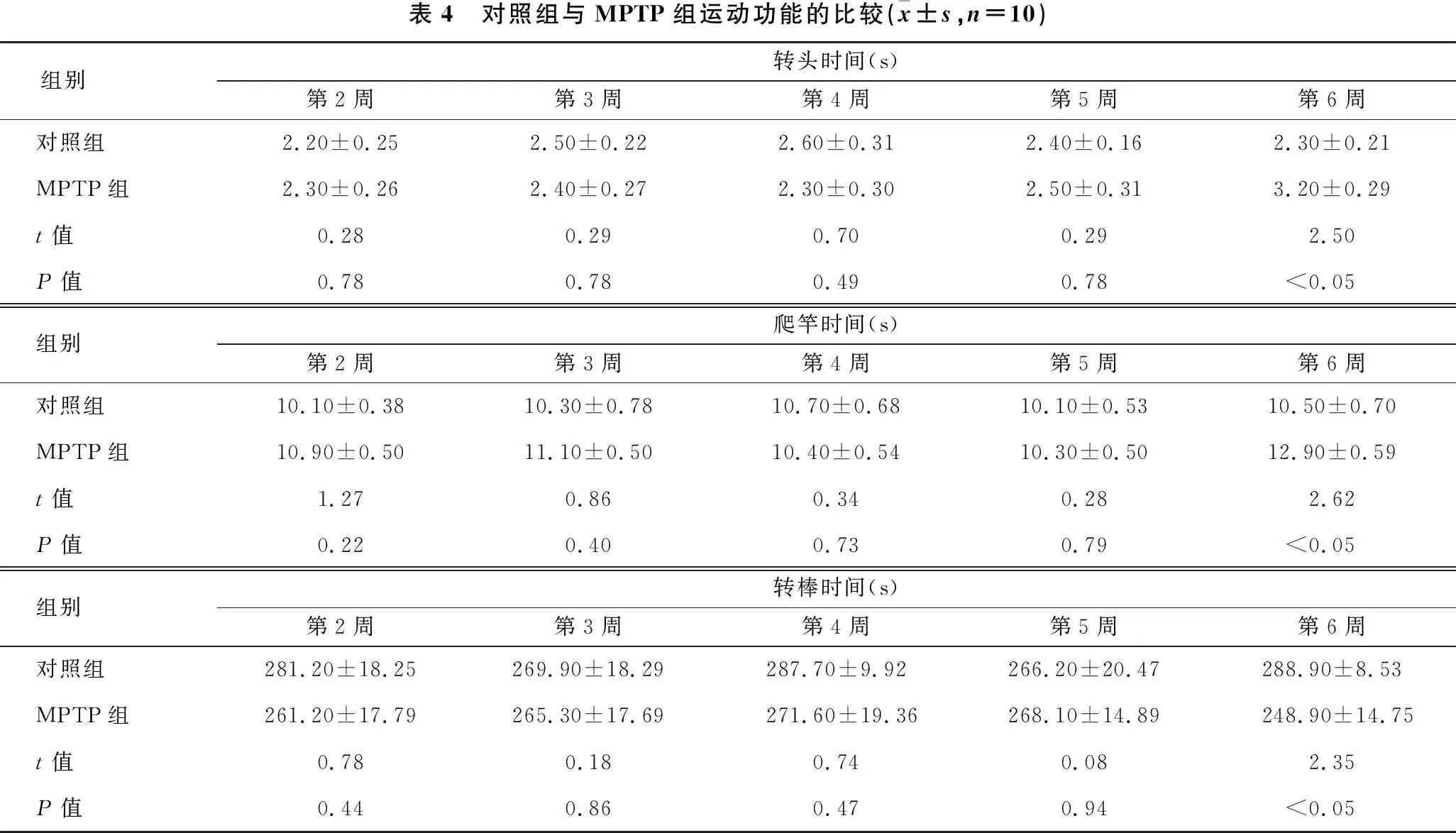
表4 对照组与MPTP组运动功能的比较(x±s,n=10)组别转头时间(s)第2周第3周第4周第5周第6周对照组2.20±0.252.50±0.222.60±0.312.40±0.162.30±0.21MPTP组2.30±0.262.40±0.272.30±0.302.50±0.313.20±0.29t值0.280.290.700.292.50P值0.780.780.490.78<0.05组别爬竿时间(s)第2周第3周第4周第5周第6周对照组10.10±0.3810.30±0.7810.70±0.6810.10±0.5310.50±0.70MPTP组10.90±0.5011.10±0.5010.40±0.5410.30±0.5012.90±0.59t值1.270.860.340.282.62P值0.220.400.730.79<0.05组别转棒时间(s)第2周第3周第4周第5周第6周对照组281.20±18.25269.90±18.29287.70±9.92266.20±20.47288.90±8.53MPTP组261.20±17.79265.30±17.69271.60±19.36268.10±14.89248.90±14.75t值0.780.180.740.082.35P值0.440.860.470.94<0.05
2.5 病理学评估
2.5.1 对照组与MPTP组中脑黑质多巴胺能神经元的比较 见图2。MPTP组小鼠黑质区域多巴胺能神经元数量(0.60±0.01)显著少于对照组(1.00±0.02)(t=19.00,P<0.001),在组织学上可认定PD模型制作成功。
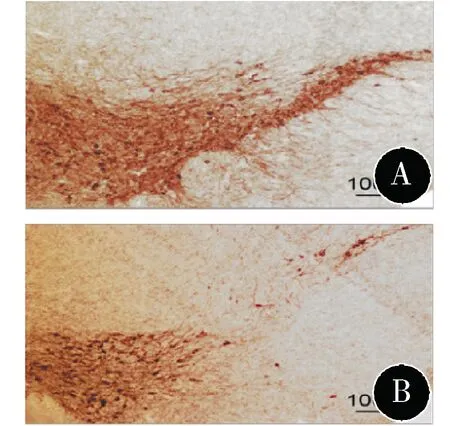
图2 小鼠中脑黑质区域TH免疫组化染色图 A:对照组;B:MPTP组
2.5.2 对照组与MPTP组小鼠中脑TH表达的比较 见图3。与对照组(1.06±0.10)相比,MPTP组中脑TH表达下降(0.58±0.08),差异有统计学意义(t=3.67,P<0.01),可进一步认定PD模型制作成功。
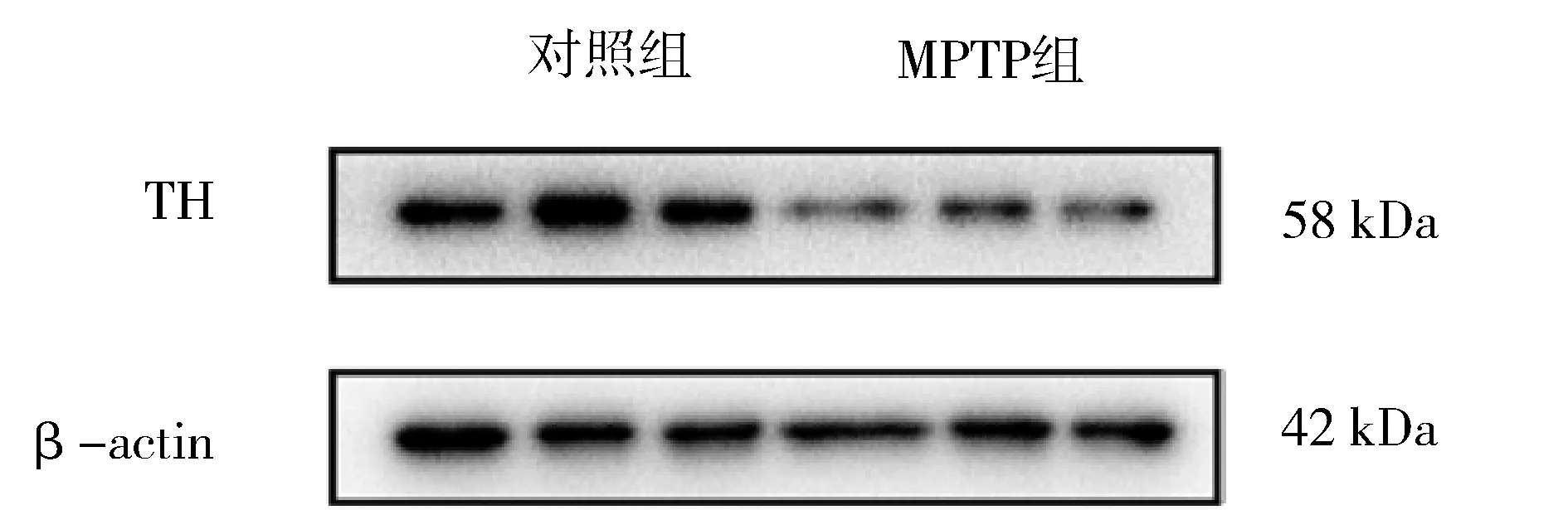
图3 对照组与MPTP组小鼠中脑TH表达水平
2.6 MPTP组小鼠中脑黑质区域多巴胺能神经能数量与胃肠功能、泌尿功能相关性分析 见图4。MPTP组小鼠中脑多巴胺能神经元数量与排便颗粒数、粪便含水量以及平均单次尿量呈正相关(r=0.6930,P<0.05;r=0.6718,P<0.05;r=0.8149,P<0.05),与1 h排尿次数呈负相关(r=-0.7155,P<0.05)。
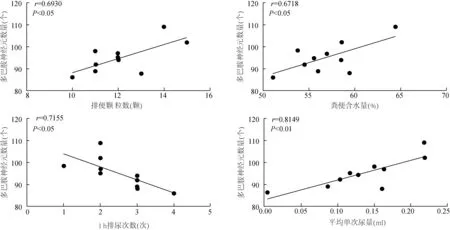
图4 MPTP组小鼠中脑多巴胺能神经元数量与胃肠功能、泌尿功能相关性分析
3 讨 论
自主神经功能障碍是PD重要的非运动症状之一[8-9],主要包括胃肠道功能不全、心血管功能失调、泌尿系统疾病、性功能障碍、瞳孔调节异常等。自主神经功能障碍可出现在运动障碍前数十年,且与患者生存期有密切关系[3]。但目前PD自主神经功能障碍机制尚未完全明确,且缺乏经典的实验模型。MPTP是一种神经毒素,被广泛用于制作PD动物模型,主要通过氧化损伤和抑制线粒体呼吸链复合物造成中枢和周围神经系统儿茶酚胺能丧失,能够模拟PD的病理表现,病变的严重程度和稳定性取决于给药方案。常用的MPTP小鼠模型根据给药剂量和给药时间不同分为急性、亚急性、慢性模型,其中急性模型、亚急性模型诱导的黑质纹状体的病变具有显著可逆性,慢性低剂量模型引起的症状及病理改变呈进行性发展[4],可模拟PD疾病进行性发展过程,因此本研究通过对MPTP慢性诱导的PD模型小鼠进行多个时间点、多个自主神经系统功能评估,探讨MPTP制备的慢性PD模型小鼠对PD自主神经功能障碍研究的适用性。
据报道[2],88.9%的PD患者在运动症状发作前会出现胃肠道症状,其中排便障碍的患病率为77%。既往研究[6,10-11]显示,给予腹膜内急性注射MPTP[60 mg/(kg·d),4次/d,每次间隔2 h]2~3 d后,小鼠结肠运动短暂增加,7 d后出现肠道延迟转运和便秘,第18 d出现排便频率显著降低,大便质量未见改变。目前关于胃肠功能的研究结果不一致,可能与MPTP给药时间、给药剂量不同有关。但是,相对于急性、亚急性模型,慢性MPTP模型中发现的运动衰退及病理变化更加近似于人类PD的主要改变[12]。为此,本研究采用MPTP慢性注射的方法评估两组小鼠的胃肠功能,结果发现MPTP组小鼠在第4周开始出现1 h排便颗粒数下降,第5周、第6周排便颗粒数及粪便含水量均明显下降,提示慢性MPTP注射可引起小鼠早期胃肠功能障碍,可用于PD伴胃肠道功能的相关研究,并且制备该模型所需的时间相对较短,其症状表型较为稳定。
27%~85%的PD患者出现刺激性排尿障碍,表现为夜尿症、尿频、尿急或膀胱排空不良[2]。既往有研究[13]对MPTP处理的猴模型的泌尿功能进行评估,其膀胱逼尿肌也出现收缩增加。另一项研究[14]显示,过表达人α-突触核蛋白的转基因小鼠也表现为膀胱排尿反射亢进、排尿频率增加、单次排尿量减少;在GM2合酶敲除的PD小鼠模型中同样观察到膀胱功能亢进的症状[15]。但既往尚无研究评估MPTP模型对小鼠泌尿功能的影响,本研究系首次进行该项研究。研究结果显示,MPTP组小鼠在第5周、第6周排尿次数明显增加,平均单次尿量明显下降,提示慢性MPTP注射也可导致小鼠膀胱逼尿肌反射亢进,表现出类似PD患者的刺激性排尿障碍症状,相对于猴模型或转基因小鼠,制备该模型过程较简单,所需的实验药品及实验动物易获得,可用于PD泌尿功能的评估及相关病理机制的研究。
此外,研究[16]显示,PD患者心血管自主神经功能障碍与周围神经的去甲肾上腺素能神经支配丧失有关,心脏交感神经纤维也存在严重耗竭。亚急性MPTP中毒使猴子的交感神经末梢系统受到影响,实验中发现其心外膜神经束中表达酪氨酸羟化酶的轴突数量显著减少[17],与上述研究一致。然而,MPTP治疗后的小鼠心肌神经纤维未见明显异常[18],这可能与物种差异有关。另有研究[19]发现,在腹膜内注射MPTP[10 mg/(kg·d),连续4 d]小鼠表现出心率升高以及RMSSD显著下降的特征。本研究同样对小鼠的心血管相关指标进行评估,以明确慢性MPTP注射是否对小鼠造成外周心血管系统的影响。结果显示,两组小鼠心率及心率变异性相关指标无明显差异。曾有研究[20]指出,MPTP对啮齿类动物心脏损伤的影响是暂时的。本研究小组推测,药物剂量和给药间隔时间也可能是造成这些研究结果不同的原因,慢性MPTP间隔给药的方式可能使得模型小鼠心功能损伤相对不明显。既往有研究[21]采用MPTP皮下泵诱发小鼠PD样症状。持续缓慢给药的方式或许可以解决这一缺陷,这值得在未来的科学研究中进一步探索。
本研究发现,经MPTP处理的小鼠于第6周出现运动功能受损,两组小鼠中脑免疫组化染色及蛋白质免疫印迹的结果均提示MPTP诱导的PD慢性小鼠模型中脑多巴胺神经元显著减少,再现了PD运动症状和神经病理特征,提示慢性MPTP皮下注射可成功诱导出PD小鼠模型。既往有研究[22]发现,大鼠黑质多巴胺能神经元损耗导致升结肠乙酰胆碱水平降低,多巴胺水平增加以及多巴胺D1和D2受体减少,可引起胃肠运动障碍。另有研究[23]显示,与单侧黑质多巴胺能神经元退化相比,双侧受损的PD大鼠表现出更广泛的行为缺陷和尿动力学变化。本研究相关分析结果显示,MPTP组小鼠胃肠功能及泌尿功能障碍与多巴胺能神经元受损也存在一定的相关性,与上述研究一致,均提示脑内多巴胺能神经元丢失可能是PD伴胃肠功能、泌尿功能障碍的原因之一,但具体相关机制有待更多研究来揭示。
PD自主神经功能障碍的症状复杂多变,涉及系统较多,考虑到不同动物模型的局限性对实验设计至关重要,本研究在多个时间点对慢性低剂量MPTP制备的PD模型小鼠自主神经功能进行了评估,以验证该模型对PD自主神经功能障碍研究的适用性。目前关于PD动物模型多系统横向比较的研究分析较少,多数研究仅针对单一系统进行分析。本研究通过对多个自主神经系统进行动态分析发现,MPTP处理小鼠的胃肠功能、泌尿功能障碍均在运动症状之前出现,且胃肠功能障碍发生在泌尿功能障碍之前,心血管功能未见明显损害,中脑多巴胺能神经元受损与胃肠功能、泌尿功能障碍存在着相关性关系,即慢性MPTP皮下注射制备的PD小鼠模型可诱导部分自主神经功能受损,可用于PD早期胃肠及泌尿系统功能的研究,但不适用于心血管功能的研究。本研究也存在一些局限性。首先,本研究未能持续评估更长时间,以观察后期症状是否发生改变;其次,本研究也未能同步观察脑中多巴胺能神经元数量,为全面分析症状与脑内多巴胺能神经元受损的相关性提供综合性依据。因此,今后的研究可以此为基础,进一步探索并构建更加完善的PD伴自主神经功能障碍的动物模型,以帮助进行PD自主神经功能的相关研究。
