癫痫性痉挛的电-临床特征与结构性病变的关系
2022-03-04陈新江卫沙飞
陈新,江卫,沙飞
癫痫性痉挛(ES)是一种婴幼儿时期多见的癫痫发作类型,是儿童难治性癫痫或癫痫性脑病的常见表型之一[1],其特殊发作期表现和不良预后一直是临床关注的重点。随着现代诊断技术的进步,人们对ES的复杂性及多样性有了更多认识。本研究收集我院2018—2020年经视频EEG(VEEG)监测证实有ES发作的患儿144例,对其临床资料进行分析,探讨不同病因和不同年龄段ES患儿的电-临床特征。
1 对象与方法
1.1 对象 选取2018年1月至2020年6月我院经VEEG监测证实有ES发作的患儿144例,发作期临床表现和VEEG均符合国际抗癫痫联盟(ILAE)定义的ES特征。男性81例(56.25%),女性63例(43.75%);年龄6 d至13岁,中位数为1岁7个月;起病年龄为3 d至11岁,中位数为7个月15 d;起病年龄<3个月26例,3~11个月66例,1~2岁16例,>2岁36例。64例未服用抗癫痫药物;80例服用抗癫痫药物,其中服用1种35例,2种27例,3种14例,4种4例。130例(90.3%)精神发育迟滞或发育倒退,14例(9.7%)正常。
1.2 方法
1.2.1 临床资料的收集 收集患儿的临床资料,包括性别、年龄、药物服用情况、临床表现、影像学检查结果。根据影像学检查结果,将患者分为非结构性异常(含正常及非特异性异常)及结构性异常。根据起病年龄将患者分为早发性痉挛(痉挛起病年龄<3个月)、经典型痉挛(痉挛起病年龄3~24个月)及晚发性痉挛(痉挛起病年龄>24个月)[2]。
1.2.2 VEEG检查 所有患儿于入院后使用日本光电数字化视频EEG-1100K EEG仪进行VEEG检查。按10-20系统安放19导电极,双耳电极为参考电极,同步检测心电、四肢肌电,监测时间为2 h。监测时间包括清醒-睡眠-清醒全过程,至少监测到1次明确的ES发作。
1.2.3 统计学方法 应用SPSS 19.0统计软件进行处理。计数资料采用率表示。组间比较应用χ2或Fisher精确概率法检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 影像检查结果 MRI/CT正常43例(29.9%),异常101例(70.1%)。发育相关的非特异性异常(侧脑室饱满、脑外间隙增宽)36例(25.0%);结构性异常65例(45.1%),其中脑软化脑萎缩33例、脑发育不良(脑裂畸形、脑回缩小、结构简单、灰质增厚、巨脑回)14例、局灶性异常信号18例。
2.2 发作期临床特征
2.2.1 发作期临床表现 144例患儿中,27例(18.8%)仅为成串痉挛发作,48例(33.3%)仅为孤立性痉挛发作,69例(47.9%)既有成串痉挛发作又有孤立性痉挛发作;清醒期发作56例(38.9%),睡眠期发作29例(20.1%),59例(41%)睡眠期、清醒期均有发作;对称性痉挛发作100例(69.4%),不对称痉挛发作44例(30.6%),表现为以单侧或局灶肢体为主痉挛发作,且同步EMG不对称爆发。
2.2.2 发作类型 监测过程中仅表现为痉挛发作97例(67.4%),痉挛合并其他一种或多种发作47例(32.6%)。其中27例合并1~3种全面性发作(肌阵挛、失神、失张力、肌阵挛-失张力、强直),18例患儿合并局灶性发作,2例痉挛合并全面及局灶性发作。
2.3 VEEG特征
2.3.1 发作间期VEEG 所有患儿的背景活动均异常,典型高度失律47例(32.6%),无典型高度失律97例(67.4%),包括广泛性和/或多灶性痫样放电、局灶性或弥漫性慢波、阵发性慢波或快波爆发。67例(46.5%)发作间期出现一侧性或恒定不对称放电,或高度失律背景中见固定持续局灶放电。
2.3.2 发作期VEEG 所有患儿均监测到痉挛发作,VEEG表现为广泛性高波幅慢波复合快波或棘波节律、广泛性高波幅慢波或多位相慢波阵发,随后可伴弥漫性电压衰减数秒。发作期VEEG双侧基本对称124例(86.1%),放电以一侧或局灶为主,或痉挛之前存在前导性棘波和快波活动20例(13.9%)。
2.4 年龄与发作间期VEEG关系 见表1。<1岁患儿的发作间期背景为典型高度失律比率最高(56.6%),其后典型高度失律比率随着年龄增加逐渐减低。不同年龄组患儿背景无典型高度失律的比率差异有统计学意义(χ2=29.718,P<0.001)。
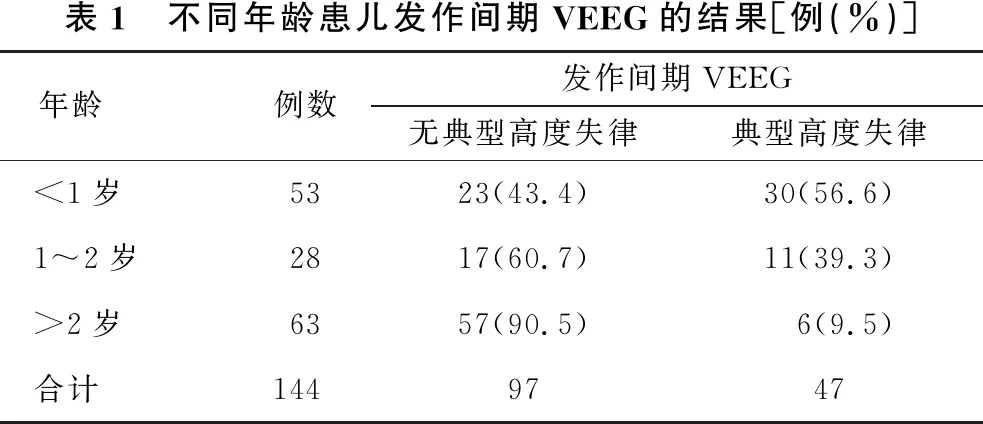
表1 不同年龄患儿发作间期VEEG的结果[例(%)]年龄例数发作间期VEEG无典型高度失律典型高度失律<1岁5323(43.4)30(56.6)1~2岁2817(60.7)11(39.3)>2岁6357(90.5)6(9.5)合计1449747
2.5 痉挛类型及发作类型与影像学结构性异常的关系 根据起病年龄将患者分为早发性痉挛26例、经典型痉挛82例及晚发性痉挛36例。晚发型痉挛、早发型痉挛及经典型痉挛患儿影像结构性异常率差异有统计学意义(χ2=15.612,P<0.001)(表2)。不同发作类型患儿的结构性异常率无统计学意义(χ2=4.218,P=0.239)(表3)。
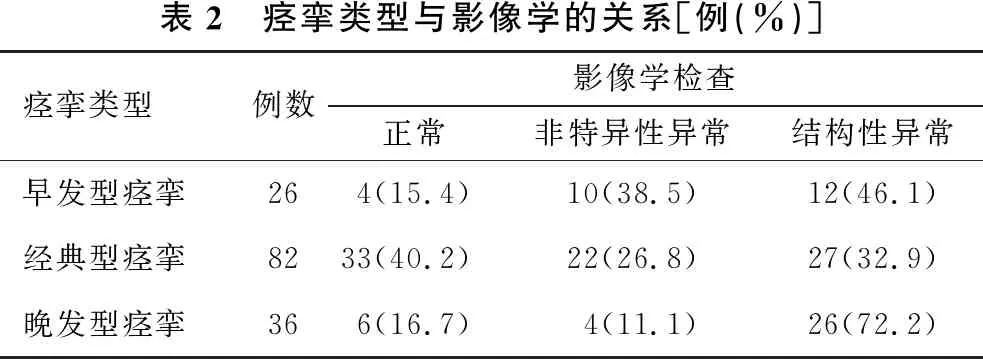
表2 痉挛类型与影像学的关系[例(%)]痉挛类型例数影像学检查正常非特异性异常结构性异常早发型痉挛264(15.4)10(38.5)12(46.1)经典型痉挛8233(40.2)22(26.8)27(32.9)晚发型痉挛366(16.7)4(11.1)26(72.2)
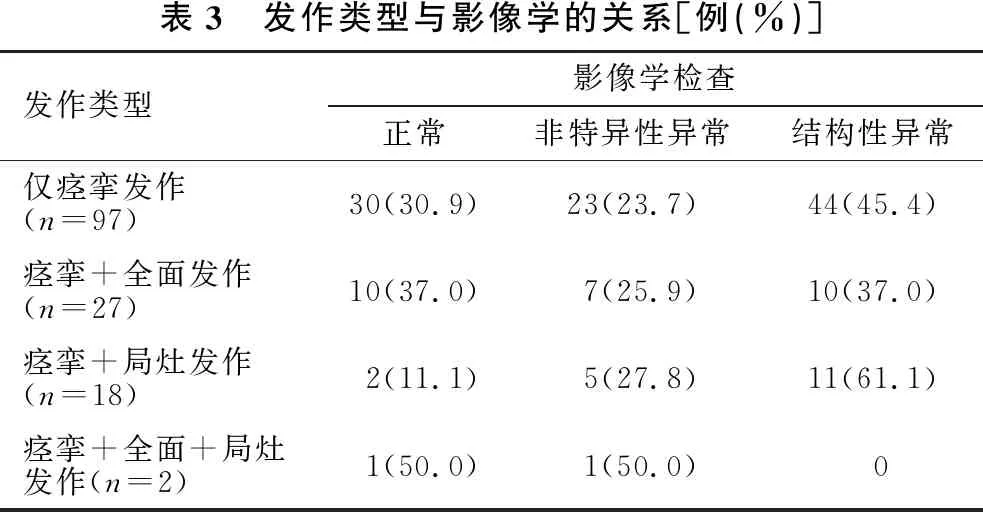
表3 发作类型与影像学的关系[例(%)]发作类型影像学检查正常非特异性异常结构性异常仅痉挛发作(n=97)30(30.9)23(23.7)44(45.4)痉挛+全面发作(n=27)10(37.0)7(25.9)10(37.0)痉挛+局灶发作(n=18)2(11.1)5(27.8)11(61.1)痉挛+全面+局灶发作(n=2)1(50.0)1(50.0)0
2.6 发作间期及发作期电-临床特征与影像关系 见表4、5。发作间期VEEG局灶性放电、发作期不对称放电及不对称性痉挛的患儿影像检查结构性异常率分别高于发作间期VEEG为非局灶性放电、发作期放电及痉挛发作为对称的患儿(χ2=27.985,P<0.001;χ2=14.902,P<0.001;χ2=4.981,P<0.05)。
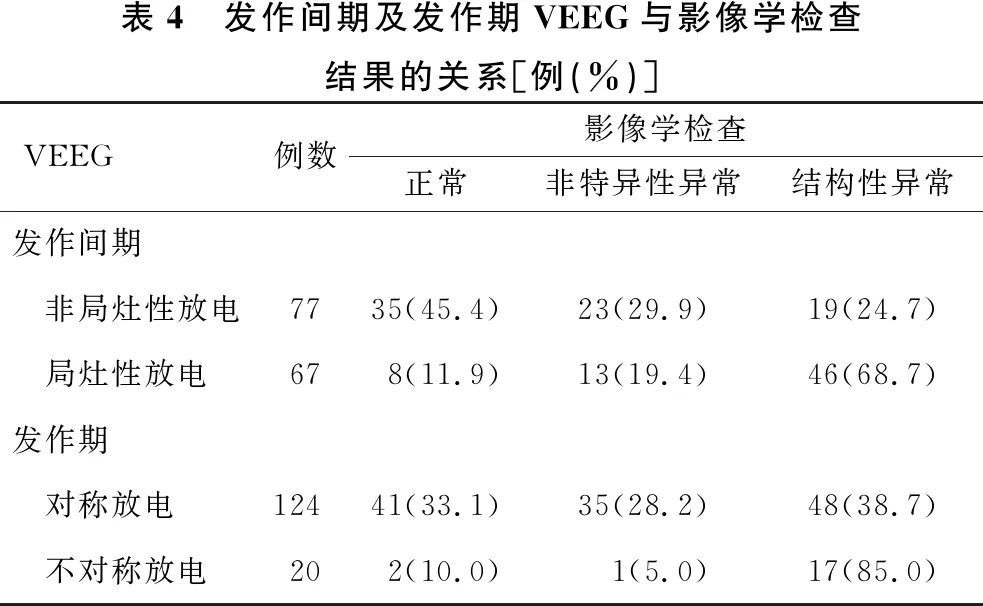
表4 发作间期及发作期VEEG与影像学检查结果的关系[例(%)]VEEG例数影像学检查正常非特异性异常结构性异常发作间期 非局灶性放电7735(45.4)23(29.9)19(24.7) 局灶性放电678(11.9)13(19.4)46(68.7)发作期 对称放电12441(33.1)35(28.2)48(38.7) 不对称放电202(10.0)1(5.0)17(85.0)
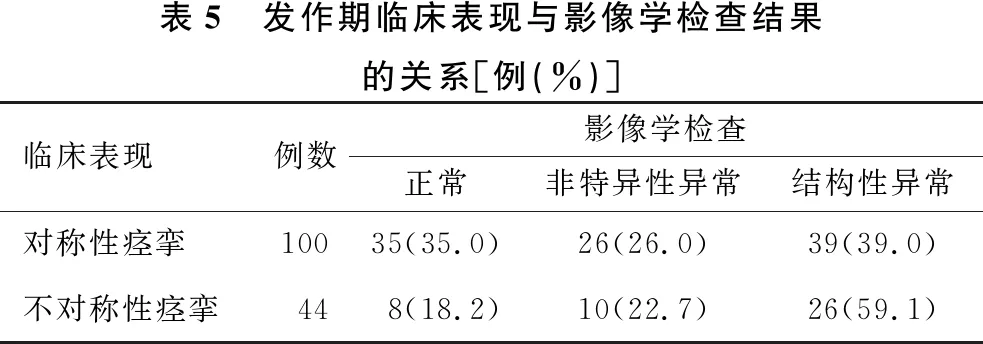
表5 发作期临床表现与影像学检查结果的关系[例(%)]临床表现例数影像学检查正常非特异性异常结构性异常对称性痉挛10035(35.0)26(26.0)39(39.0)不对称性痉挛448(18.2)10(22.7)26(59.1)
3 讨 论
ES是一种独立的癫痫发作类型,占婴儿期癫痫的13%~45.5%[3]。目前研究[4]发现本病病因多达二百余种,不仅涉及围产期脑损伤、先天性脑发育异常、脑外伤、颅内出血、结节性硬化症等各种先天性或获得性脑损伤,还和多种与神经发育相关的基因异常和突变有密切关系。本文通过分析不同病因和不同年龄段ES的电-临床特征,探讨儿童ES与结构性病变的关系,以期协助指导精准治疗及预后判断。
典型高度失律脑波表现为弥散性不规则高波幅慢波,夹杂大量多灶杂乱的棘波、尖波发放,棘波、尖波与慢波多无固定关系[2],是严重性弥漫性脑功能异常的表现。高度失律对诊断ES有重要的临床意义,但并不是所有的ES都伴有高度失律[5],高度失律也并非都见于婴儿痉挛。本组144例患儿中47例发作间期(32.6%)出现典型高度失律,97例(67.4%)无典型高度失律,表现为广泛、多灶性痫样放电或慢波活动,因此不能以高度失律作为诊断或排除ES的标准。
本组<1岁患儿背景为典型高度失律比率最高(56.6%),并且典型高度失律比率随着年龄的增加逐渐降低。绝大多数(90.5%)>2岁的患儿背景无典型高度失律,与<1岁(43.4%)及1~2岁患儿(60.7%)相比差异有统计学意义。罗序峰等[6]报道了8例间期表现为高度失律的ES患儿,随访13~26个月后4例转变为非典型高度失律。一项纳入63例ES转型期患儿的研究[7]也显示,患儿典型的高度失律图形随着病程推移逐渐演变为非典型高度失律图形。Eisermann等[8]报道了一组晚发型ES患儿,其发作间期EEG均无高度失律表现,可能与婴儿期ES的发生机制与脑发育不成熟有关。低龄ES患儿皮质广泛性兴奋性增高[2],任何部位的致痫性病变均可引发皮质和皮质下结构的相互作用,EEG出现高度失律表现。随着年龄的增长及脑发育的成熟,在婴儿可引起全面性电-临床表现的某些局灶致痫性病变逐渐变为部位相关的局灶性异常[2],此时较少出现典型的高度失律,多数伴其他类型发作[9-10]。不论起病早晚,2~3岁后患儿一般不再伴有典型的高度失律图形[8]。但VEEG是否表现为高度失律并不是影响药物治疗效果的重要因素,在接受同样标准治疗的情况下,患儿疗效近似[11]。
本组144例患儿中,明确结构性异常65例(45.1%),但晚发型ES患儿中72.2%影像有结构性病变,显著高于早发型(46.1%)及经典型ES患儿(36.9%)。这与Eisermann等[8]报道的60.7%的晚发型ES为症状性癫痫、39.3%为隐源性癫痫相近,可能与潜在的脑损伤有关[7]。有研究[12]显示,晚发性ES与部分性发作和/或脑内局灶病变密切相关,推测皮质起源的部分性发作对某些皮质下结构有触发作用,从而导致ES。局部皮质在晚发性ES发病中起到了更重要的作用,因此对于ES患儿,特别是晚发性ES患儿,一旦确诊应积极寻找病因,除头颅MRI检查外,还可以进行功能神经影像检查(PET/SPECT),以发现患儿脑皮质及皮质下MRI无法显现的潜在病灶[13]。对于治疗效果欠佳的患儿可进行遗传代谢病筛查或(和)基因检查,由此确定病因[14]。
近年来随着对ES认识的深入及立体定向EEG的应用成熟,越来越多的ES患儿采用手术进行治疗。Kobyashi等[15]报道1例Aicard综合征患儿行胼胝体切开术后,ES由双侧同步发作转为双侧独立发作,提示ES本身由局灶皮质起源,而皮质下结构在ES双侧同步化过程中发挥作用。Metsähonkala等[16]报道,6例实施癫痫病灶切除手术的ES患者中,5例(82%)病理检查显示为局灶性皮质发育不良Ⅰ型(FCDⅠ型),随访手术缓解率为67%。周文静[17]总结了11例手术治疗的ES患儿的病例资料发现,术前3例为头皮局灶性棘波节律,2例颅内EEG显示发作时前导性棘波,手术切除癫痫性放电或前导性棘波皮质可消除发作,认为一部分患者ES发作由新皮质局灶的电发放点燃。因此,一些局灶皮质或皮质下病变引发的药物难治性ES患儿可以进行手术切除治疗。一些无法进行切除性手术的患者可考虑胼胝体离断术[18]。研究[19]显示,癫痫病灶切除术后癫痫缓解率显著高于无法手术治疗者,认知功能显著改善。
对于可能为皮质起源的ES发作,术前定侧、定位是至关重要的,除了需要从神经影像、功能影像方面寻找支持依据外,观察发作期电-临床表现的非对称现象及间期局灶性放电也为术前评估提供重要的定侧、定位信息[20]。本组发作间期局灶放电的67例患者中结构性异常率显著高于非局灶性放电患儿。ES患儿VEEG发作间期存在明确的局灶性放电,如一侧为主的高度失律,高度失律或多灶背景中存在一个突出部位的恒定、局灶棘波、尖波,常提示该患儿伴有一侧半球结构性异常或局灶脑部病变[2]。另外,某些ES患儿痉挛发作时表现出不对称现象,如不对称痉挛、一侧性痉挛、局灶痉挛或发作期VEEG表现为一侧或局灶棘-慢波或多相位慢波,提示局灶病变可能。本组20例痉挛发作不对称放电患儿中85%局灶结构性异常,显著高于对称放电的患儿;44例不对称痉挛发作患儿中59.1%有局灶结构性异常,显著高于对称痉挛发作的患儿。这与吴舒华等[12]报道的不对称或一侧性痉挛发作及发作期不对称或一侧性EEG异常与一侧性或不对称影像学异常有显著相关性基本一致,提示局部皮质或皮质下病变可能在痉挛发病过程中起着重要作用[20],有痉挛的局灶起源可能。因此,除了头颅影像学检查外,发作间期EEG局灶性放电及痉挛发作时非对称的电-临床特征对局灶病变的定侧、定位也有重要的提示作用。
综上,不同病因和不同年龄段的ES患儿具有不同的电-临床特征,特别是晚发型ES、发作间期局灶性放电及发作期不对称放电及不对称痉挛患儿,必要时应对其进行结构影像、功能影像及基因筛查,积极寻找病因。局灶起源的药物难治性ES还可以考虑进行手术治疗。
