枣多糖提取物对环磷酰胺所致的蛋雏鸡肠黏膜机械损伤的修复作用
2022-03-04郭林霞李树鹏赵国先河北农业大学动物科技学院河北保定071000
郭林霞,李树鹏,赵国先 (河北农业大学 动物科技学院,河北 保定 071000)
近年来,由于抗菌类药物的使用不当、饲料中霉菌毒素的影响以及免疫抑制病的广泛存在,使得动物免疫抑制越来越严重,很大程度上阻碍了畜牧业的可持续发展[1]。因此,为了消除或缓解免疫抑制、提高机体抗病力、增强动物免疫力,免疫增强剂得以广泛运用。肠道是体内最大的淋巴组织,肠道免疫作用主要通过肠黏膜屏障(机械、化学、生物和免疫屏障)功能实现,其中机械屏障是肠黏膜屏障中最重要的屏障,紧密连接是维持机械屏障的结构基础[2],由黏蛋白构成的黏液层覆盖肠上皮细胞,对紧密连接具有保护作用。有研究表明,免疫抑制会导致畜禽肠黏膜受损,紧密连接蛋白的表达量降低,肠通透性增加[3-4],而植物多糖则可以有效修复这种损伤,但是目前枣多糖提取物(jujube polysaccharide extract,JPE)对蛋雏鸡肠黏膜紧密连接蛋白的影响研究鲜见报道。因此本试验旨在通过探究JPE对环磷酰胺(Cy)所致的免疫抑制蛋雏鸡空肠紧密连接蛋白表达的影响,为JPE作为免疫增强剂的开发提供科学依据。
1 材料与方法
1.1 实验动物与试验材料1日龄京红1号蛋雏鸡,由河北环山农牧有限公司提供;JPE采用水提醇沉法提取[5],采用蒽酮-硫酸法测定[6],纯度为21.73%。相对分子质量为27.4 kDa,由森博材料技术研发中心检测(液相色谱法);单糖组成为葡萄糖(43.46%)、果糖(19.95%)、阿拉伯糖(16.45%)、半乳糖(8.35%)、半乳糖醛酸(3.71%)、木糖(3%)、甘露糖(2.8%)、鼠李糖(1.52%)、海藻糖(0.53%)和葡萄糖醛酸(0.24%),由武汉华士特工业生物技术开发有限公司进行测定(液相色谱法);Cy纯度98%,购自上海迈瑞尔化学技术有限公司。
1.2 试验设计本试验采用单因子完全随机试验设计,另设空白对照组(BC组),选取体质量相近且健康的1日龄京红1号蛋鸡750只,适应性饲养6 d后随机分为5组,每组6个重复,每个重复25只鸡。Ⅰ组为空白对照组,在7~9日龄时皮下注射0.35 mL 生理盐水,饲喂基础日粮。Ⅱ~Ⅴ组在8~10日龄时皮下注射100 mg/kg Cy[7],1次/d,诱导肠黏膜屏障损伤。分别在基础日粮中添加0,400,800和1 600 mg/kg JPE[8-9],试验期为5周。基础饲粮组成及营养水平见表1。

表1 基础饲粮组成及营养水平(风干基础) %
1.3 饲养管理进雏前对鸡舍进行全面冲洗及消毒。试验过程按养鸡场的常规管理程序进行免疫、驱虫、采光和通风。采食方式、饮水方式和鸡群密度按鸡场程序调整。各组均匀分布于4层阶梯式鸡笼,消除位置引起的误差。试验期内每天08:00和15:00各喂1次料,自由采食和饮水。每天观察鸡群健康状况,记录死鸡和病鸡数量。
1.4 测定指标及方法
1.4.1空肠分泌因子含量 于试验的最后1 d从每个重复中选取1只与平均体质量相近的鸡,颈部放血致死,剖开腹腔,迅速截取3 cm左右回肠,用生理盐水冲洗干净,放入冻存管中,-80℃保存。根据ELISA试剂盒说明书进行IL-1β和TNF-α含量测定。
1.4.2空肠紧密连接蛋白和黏蛋白的表达量 样品采集如上1.4.1,利用TRIzol法提取总RNA,电泳检测质量,使用Nanodrop 2000超微量分光光度计测定RNA浓度及纯度后,进行逆转录获得cDNA,再以cDNA为模板进行实时荧光定量PCR(qRT-PCR),每组3个重复。参考GenBank鸡Occludin、Claudins-1、ZO-1和Mucin-2基因mRNA序列,利用Primer Premier 5.0 软件进行引物设计,以GAPDH为内参基因。引物由武汉塞维尔生物科技有限公司合成,引物信息见表2。
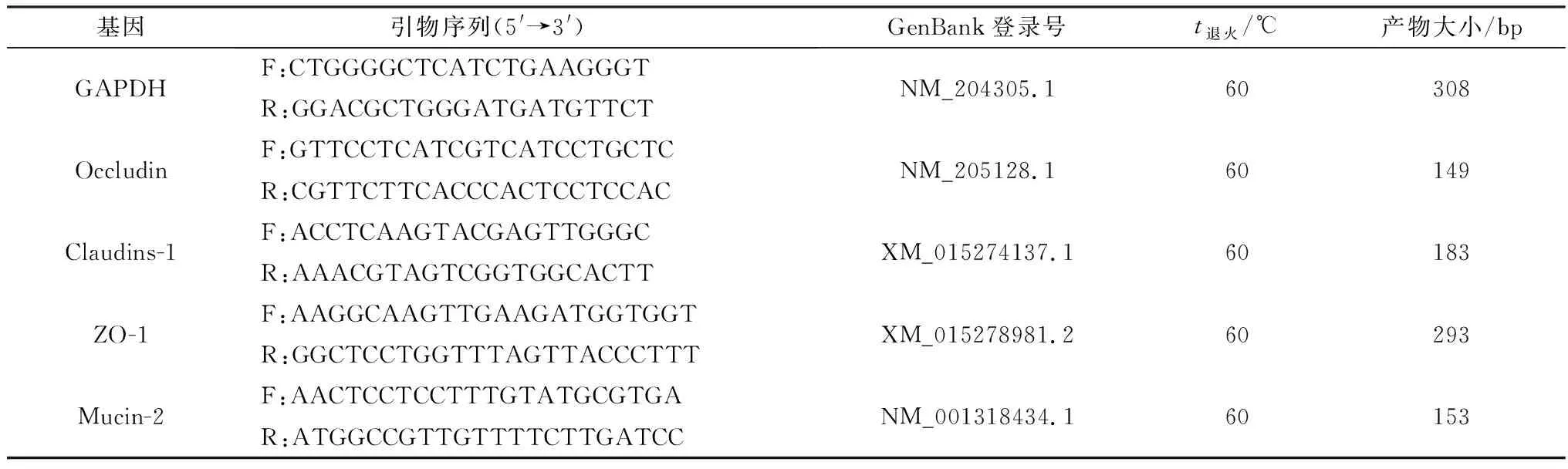
表2 引物信息
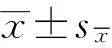
2 结果
由表3可知,就Claudin-1表达量而言,与Ⅰ组比,Ⅱ~Ⅴ组降低(P<0.01);与Ⅱ组比,Ⅲ~Ⅴ组表达升高,其中Ⅲ组差异显著(P<0.05),其他差异极显著(P<0.01);Ⅳ(P<0.05)和Ⅴ组(P<0.01)比Ⅲ组高,Ⅳ和Ⅴ组组间差异不显著(P>0.05)。对Occludin而言,与Ⅰ组比,Ⅱ和Ⅲ组降低(P<0.01),Ⅳ和Ⅴ组升高(P<0.01);与Ⅱ组比,Ⅳ和Ⅴ组升高(P<0.01);Ⅳ和Ⅴ组比Ⅲ组高(P<0.01);其他组间差异不显著(P>0.05)。对ZO-1而言,组间差异不显著(P>0.05) 。

表3 JPE对免疫抑制蛋雏鸡空肠紧密连接蛋白mRNA表达量的影响
由表4可知,对Mucin-2表达量而言,与Ⅰ组比,Ⅳ和Ⅴ组表达升高(P<0.05);与Ⅱ组比,Ⅳ(P<0.05)和Ⅴ组(P<0.01)升高;Ⅳ(P<0.05)和Ⅴ组(P<0.01)比Ⅲ组高;其他组间差异不显著(P>0.05)。
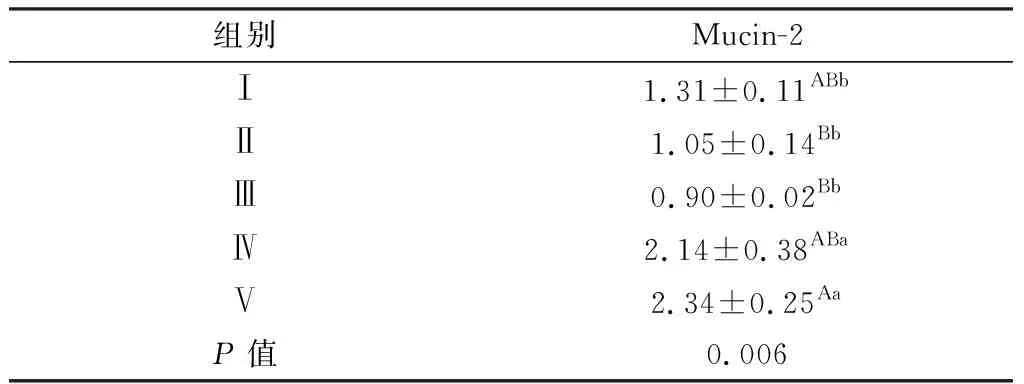
表4 JPE对免疫抑制蛋雏鸡空肠黏蛋白mRNA表达量的影响
由表5可知,就IL-1β表达量而言,与Ⅰ组比,Ⅳ组降低(P<0.01);与Ⅱ组比,Ⅲ(P<0.05)和Ⅳ组(P<0.01)降低;Ⅴ组比Ⅲ和Ⅳ组高(P<0.01),Ⅲ组比Ⅳ组高(P<0.05);其他组间差异不显著(P>0.05)。就TNF-α而言,与Ⅰ组比,Ⅲ和Ⅳ组降低(P<0.01);与Ⅱ组比,Ⅲ和Ⅳ组降低(P<0.01);Ⅴ组比Ⅲ(P<0.01)和Ⅳ组(P<0.05)高;其他组间差异不显著(P>0.05)。
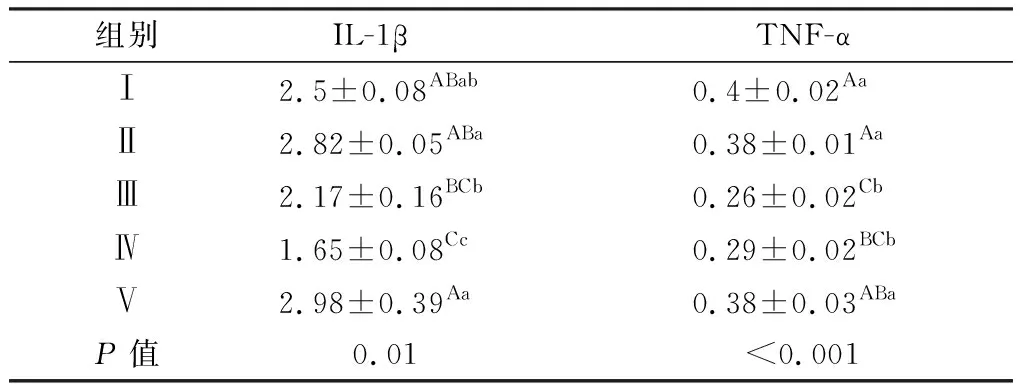
表5 JPE对免疫抑制蛋雏鸡空肠IL-1β和TNF-α的影响 ng/g
3 讨论
机械屏障是肠黏膜屏障中最重要的屏障,紧密连接是其结构基础[2]。紧密连接是一种不通透连接,只允许水分和离子选择性通过,有效抑制肠道病原微生物、有害大分子等的入侵,有效保护肠黏膜屏障的完整性[10-11]。细胞间的紧密连接蛋白的表达量越高,肠通透性越低[12],肠道通透性增加则会使肠道免疫系统接触到外来抗原,进而影响免疫屏障功能;紧密连接蛋白表达受阻会破坏肠黏膜屏障的完整性,造成营养代谢功能障碍,从而抑制畜禽生长[13]。
研究表明,Cy可以抑制ZO-1、Occludin和 Claudin-1 mRNA 表达[3-4],本试验结果与此基本一致,说明Cy可以通过增加黏膜细胞间的通透性,破坏肠道的完整性,进而增加局部免疫系统接触外来抗原的可能性,破坏肠道免疫系统。另外有研究表明,鱿鱼墨多糖可以显著增加ZO-1和Occludin的mRNA表达量[4],冬虫夏草多糖[14]、火麻仁多糖[3]、海藻多糖[15]、白术多糖和牛膝多糖等[16]均显著增加肠道Occludin、ZO-1和Claudin-1的基因表达量。本试验结果显示,与Cy组比,中高剂量组的Occludin和 Claudin-1表达量均显著增加,说明JPE可以通过促进紧密连接蛋白的表达来降低肠道的通透性,与上述结果一致。中高剂量JPE组的Occludin恢复到了BC组水平,即JPE对紧密连接蛋白表达的影响与剂量有关,800~1 600 mg/kg效果最好。
促炎因子IL-1β和TNF-α会导致肠黏膜紧密连接蛋白表达和分布发生变化,引起肠道通透性增加[17]。为了验证JPE对紧密连接蛋白的促进作用是否与IL-1β、TNF-α有直接关系,本试验测定了肠道中这2种细胞因子的含量。YING等[18]在试验8~10 d给小鼠注入80 mg/kg的Cy,模型组小肠中IL-1β、TNF-α及紧密连接蛋白表达量均显著降低。本试验中Cy对IL-1β和TNF-α的分泌均没有显著影响,与紧密连接蛋白的变化不一致。得出Cy对肠道通透性的影响可能与IL-1β和TNF-α的分泌无关,具体机理还需进一步探讨。尚庆辉等[6]研究表明,500 mg/kg苜蓿多糖可显著降低仔猪空肠和回肠TNF-α和IL-1α的表达量,显著提高小肠各段Occludin以及回肠ZO-1表达量;400,600 mg/L 的沙棘多糖显著升高Occludin、ZO-1和Claudin-1表达量同时显著降低IL-1β和TNF-α的水平[19]。本试验结果显示,与Cy组比,低中剂量JPE组的IL-1β和TNF-α表达量显著降低,与上述结果相似。且JPE各个剂量组IL-1β和TNF-α的含量均达到了BC组水平,且就TNF-α含量而言,添加量为400~800 mg/kg效果较好; IL-1β含量随着JPE添加量的增加呈现先降低后增加的趋势,即存在最佳添加量(800 mg/kg)。
黏蛋白是构成肠道化学屏障的重要骨架,由杯状细胞分泌[20]。由黏蛋白构成的黏液层覆盖在肠上皮细胞上,对紧密连接具有保护作用[21]。付羽萍等[22]试验显示,Cy对小鼠空肠和回肠中Mucin-2 mRNA表达水平没有显著性影响,本试验结果也是如此。而薛然等[3]和BAI等[23]试验显示,Cy使小鼠肠道中Mucin-2的表达水平降低,可能与Cy的注射时间及浓度有关。研究表明,浒苔多糖[24]和龙眼肉多糖[23]均可以促进小鼠肠道黏蛋白Mucin-2 mRNA表达;苜蓿多糖[6]可以提高仔猪空肠和回肠Mucin-2 mRNA表达水平。本试验结果显示,与Cy组比,中高剂量JPE组Mucin-2 mRNA表达显著升高,由此说明,JPE可以提高肠黏膜化学屏障功能,与上述结果一致。JPE的各个剂量组均达到了BC组水平,且JPE的剂量为800~1 600 mg/kg时效果较好。
JPE对黏蛋白的影响与紧密连接蛋白变化基本一致,说明JPE可能通过提高Mucin-2 mRNA表达来保护紧密连接,维持肠黏膜屏障的完整性。
