PRV感染三叉神经节细胞对PI3K/Akt信号通路的影响及其调控凋亡
2022-03-04汤德元曾智勇杨志刚晏仁潭韩超逸陈阊峥贵州大学动物科学学院贵州贵阳550025
张 森,汤德元,曾智勇,王 彬,黄 涛,杨志刚,晏仁潭,韩超逸,陈阊峥,罗 柳 (贵州大学 动物科学学院,贵州 贵阳 550025)
伪狂犬病病毒(pseudorabies virus,PRV) 属于疱疹病毒科α-疱疹病毒亚科水痘病毒属,是伪狂犬病(pseudorabies,PR)的病原。该病毒可引起猪产生呼吸道症状、神经症状和繁殖障碍等症状,猪是PRV的主要易感动物,是PRV最重要的传染源之一,其他哺乳动物以及野生动物感染后均呈致死性感染[1]。大量研究表明:大多疱疹病毒可潜伏感染于神经中,其中三叉神经节(TG)是PRV潜伏感染的关键部位[2]。TG细胞是包括PRV等α疱疹病毒的重要靶细胞,有研究表明TG细胞与其他部位的原代细胞相比对PRV感染诱导的细胞凋亡具有更强的抵抗力,说明PRV感染TG细胞可能存在不同的抑制细胞凋亡机制[3]。
磷酸肌醇-3-激酶/蛋白激酶B(PI3K/Akt)信号通路发现于20世纪80年代初期,该通路主要由PI3K、Ser/Thr蛋白激酶两部分组成。PI3K/Akt信号通路高度保守,其激活通过多步过程严格控制,该通路存在于绝大多数真核细胞中,是机体最重要的信号通路之一[4]。PI3K/Akt信号通路在抑制细胞凋亡、诱发癌症、调控机体免疫及炎症反应、促进细胞增殖并抑制细胞分化中具有重要作用,大多数病毒感染后会诱导PI3K/Akt信号通路发挥其特定作用[5]。大量研究表明,疱疹病毒体外感染会诱导细胞PI3K/Akt信号通路激活而产生一系列级联反应。例如疱疹病毒科中的诱发癌症的EBV可通过PI3K/Akt信号通路诱导HIF-1α的分泌与合成,从而诱导胃癌的发生[6]。而KIM等[7]认为,抑制PI3K/Akt信号通路可诱导由EBV引起的胃癌细胞凋亡,为胃癌的控制与治疗提供了一个新的思路。
TG细胞是疱疹病毒感染的重要靶细胞,有研究[8-9]证明TG细胞对PRV感染有一种特殊的抵抗力,主要体现在感染后可推迟发生细胞病变效应(CPE)时间,这一点同样在本实验室前期研究中已被证明[9]。目前PRV感染细胞或机体调控PI3K/Akt等信号通路的机制有一定研究,而PRV感染TG细胞所诱导的信号通路变化机制以及调控过程尚不明确,TG细胞是PRV感染的特殊靶细胞,PRV感染TG细胞的过程可能与其他细胞相比有所不同。为了探究PRV感染TG细胞对PI3K/Akt信号通路的影响以及PI3K/Akt是否在PRV感染后抑制TG细胞的凋亡中发挥作用,本试验以小鼠原代TG细胞为模型,探究PRV感染TG细胞后PI3K/Akt信号通路的激活规律及所调控的生物学作用,为进一步揭示PRV潜伏感染TG细胞的机理提供线索。
1 材料与方法
1.1 实验动物和病毒5~7周龄SPF级成年小鼠购自重庆腾鑫生物公司;PRV Guizhou-DY株由本实验室分离、鉴定和保存。
1.2 主要试剂及耗材胎牛血清(FBS)、B-27、DMEM/F12培养基购自Gibco公司;神经元基础培养基购自上海源培生物公司;多聚赖氨酸(D型)、0.25% 胰蛋白酶、AlexaFluor 555标记山羊抗兔IgG购自上海生工生物工程有限公司;山羊血清、胶原蛋白酶Ⅰ、DAPI等购自北京索莱宝生物有限公司;mRNA反转录试剂盒购自TaKaRa(大连);FastSYBR Mixture购自康为世纪生物科技有限公司;BCA Protein Quantification Kit购自诺唯赞生物科技有限公司;Anti-Pseudorabies Virus抗体(ab3534)购自Abcam公司;兔抗鼠PI3K抗体、Akt抗体、p-Akt抗体、Bcl-2抗体、Bax抗体购自CST(Cell Signaling Technology);β-Actin抗体购自上海爱必信生物科技有限公司;LY294002、Annexin V-FITC细胞凋亡检测试剂盒以及ECL化学发光试剂盒购自碧云天生物技术有限公司;培养细胞所用耗材均购自Corning;其他试剂均为国产分析纯。
1.3 引物的设计与合成于NCBI分别查找PI3K、Akt、GAPDH相关基因序列,利用Primer Premier 5.0软件分别设计引物(表1),引物于擎科生物科技有限公司合成。

表1 扩增目的基因的引物序列
1.4 小鼠TG细胞原代培养根据实验室前期研究[9]以及参考文献[10]方法进行优化,培养小鼠原代TG细胞。具体方法:取若干只成年小鼠,经麻醉后断头处死,无菌操作取两侧TG置于预冷后的PBS中,去除周围结缔组织后剪碎,加入胶原蛋白酶I于37℃消化40 min,后加入含EDTA的胰蛋白酶于37℃消化10 min。消化后加入FBS终止消化,并用无菌巴斯德吸管反复吹打,将其吹打混匀后经70 μm 细胞滤器过滤并离心去除上清液,加入含10% FBS、青链霉素双抗的DMEM/F12培养基反复吹打混匀,放入先前准备的涂过多聚赖氨酸(D型)的6孔板中,于37℃ 5% CO2条件下培养。24 h后待细胞贴壁将培养液更换为含2% B-27、10% FBS、青链霉素双抗的神经元基础培养基,3 d后换半液,待培养至5~7 d用于下一步试验。
1.5 RT-qPCR检测PRV感染TG细胞后不同时间段PI3K、Akt mRNA表达水平用1 MOI PRV感染TG细胞后,利用Trizol法分别提取不同时间段TG细胞中总mRNA,以未攻毒细胞作为对照组,严格按照试剂盒说明书进行提取,利用超微量紫外分光光度计测定所提取mRNA浓度及D值。将所提RNA用反转录试剂盒反转录为cDNA,再次测定浓度与D值。将cDNA浓度稀释后以其为模板进行PCR扩增,反应体系:2×Fast SYBR Mixture 25 μL,上下游引物各1 μL,cDNA 2 μL,ddH2O 22 μL。PCR反应条件:95℃预变性20 s;95℃变性3 s,60℃退火30 s,共计40个循环。PCR反应结束后进行熔解曲线分析以验证其特异性。重复试验3次,并根据计算公式2-△△Ct法计算PRV感染TG细胞后不同时间段PI3K、Akt mRNA的相对表达含量。
1.6 间接免疫荧光试验(IFA)将TG细胞培养于细胞爬片中,待细胞汇合至70%时对其进行攻毒,以未攻毒TG细胞为对照组,用PBS轻洗1次,加入4%甲醇固定细胞15 min,用PBS漂洗3次,每次5 min。随后在含5%山羊血清、 0.3% TritonTMX-100的PBS中封闭1 h,PBS漂洗3次后加入一抗4℃孵育过夜;PBS清洗3次,加入抗体稀释缓冲液稀释的荧光物质标记的二抗,室温下避光孵育2 h;PBS清洗3次,加入DAPI染核后荧光显微镜下镜检观察。
1.7 Annexin V-FITC法对贴壁细胞进行原位荧光凋亡检测根据参考文献[11]得知,LY294002在10 mol/L条件下即可对TG细胞内的PI3K进行有效抑制且对TG细胞毒性反应较小。试验分别设空白对照组、PRV组、PRV+LY294002组。将细胞培养至24孔板中,在攻毒前用含LY294002的培养液对TG细胞进行封闭1 h以增强抑制效果,攻毒6 h后,吸去细胞培养液,加入195 μL Annexin V-FITC结合液,5 μL Annexin V-FITC,混匀后加入10 μL 碘化丙啶染色液,室温(20~25℃)避光孵育10~20 min,随后置于冰浴中,于倒置荧光显微镜下镜检观察。
1.8 流式细胞术待TG细胞长满后用PBS多次清洗以洗去未贴壁细胞,随后进行分组攻毒。将TG细胞用无EDTA的胰蛋白酶消化后收集,用PBS将细胞洗涤2次重悬浮,随后离心收集细胞,加入195 μL Annexin V-FITC结合液、5 μL Annexin V-FITC以及10 μL碘化丙啶染色液,避光孵育后1 h 内完成检测。
1.9 Western blot检测相关蛋白表达使用含1%蛋白酶抑制剂及1%磷酸化酶抑制剂的RAPI裂解液分别提取TG细胞的总蛋白,测定PI3K、Akt、p-Akt相对表达含量以及Bcl-2、Bax的相对表达含量。经BCA试剂盒测定蛋白浓度,加入5×Loading Buffer以每孔20 μg总蛋白煮沸上样,经SDS-PAGE凝胶电泳分离后,湿转法转移至PVDF膜上,经TBST洗涤3次,每次5 min。经封闭后,分别加(PI3K,1∶1 000;Akt,1∶1 000;p-Akt,1∶2 000;Bcl-2,1∶1 000;Bax,1∶1 000,β-actin,1∶3 000)等一抗于4℃孵育过夜;经TBST洗涤3次,每次5 min;加入二抗(1∶5 000)孵育1 h,TBST洗涤后经ECL显色并拍照,用ImageJ软件进行条带灰度值分析。
1.10 统计学分析所有数据经SPSS软件进行分析处理,采用t检验或ANOVA单因素方差分析分析其差异性,P<0.05认为组间差异显著且具有统计学意义;P<0.01认为组间差异极显著,并利用GraphPad Prism 8.0绘制表格。
2 结果
2.1 TG细胞原代培养结果分别取培养后1,3,5,7 d TG细胞进行观察,结果显示,原代培养的小鼠TG细胞在12~24 h时逐渐贴壁,3 d时TG细胞快速生长,待6~7 d时细胞生长停止同时可达到90%以上汇合度(图1)。神经元细胞在培养早期个体较大呈圆形并向四周伸出突触,培养后期呈透明状圆形;神经胶质细胞以及血旺氏细胞呈纺锤形,与参考文献中原代TG细胞形态相符。TG细胞消化后无法进行传代,仅能原代培养,需现用现做。

A.TG细胞培养至1 d;B.TG细胞培养至3 d;C.TG细胞培养至5 d;D.TG细胞培养至7 d(红色箭头为神经元细胞;黑色箭头为神经胶质细胞以及血旺氏细胞)
2.2 PRV可感染TG细胞IFA结果显示,PRV攻毒TG细胞后可产生绿色荧光,说明PRV可感染TG细胞并在其内复制及增殖,且感染后48 h的荧光比24 h更为明显(图2)。
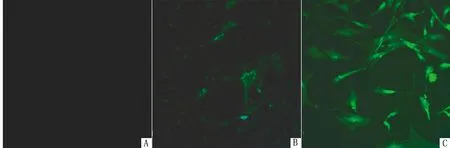
A.阴性对照;B.PRV感染24 h;C.PRV感染48 h
2.3 PRV感染TG细胞后不同时间段PI3K、Akt mRNA相对表达变化结果显示,1 MOI PRV感染TG细胞早期可显著上调细胞内PI3K、Akt mRNA表达水平(P<0.01),PI3K mRNA表达在30 min左右达到峰值,在感染2 h左右降至初始水平(与对照组相比差异不显著),随时间推移抑制PI3K mRNA表达水平;Akt mRNA在感染后15 min即上调并达到峰值(P<0.01),随后迅速下调并与对照组相比处于抑制状态(P<0.01)(图3)。且PI3K、Akt引物熔解曲线均为单峰,说明引物特异性良好。总体来说,PRV感染TG细胞后对PI3K及Akt mRNA的表达呈先促进后抑制的作用,这可能与病毒早期入侵细胞所引起的细胞自身免疫反应有关。
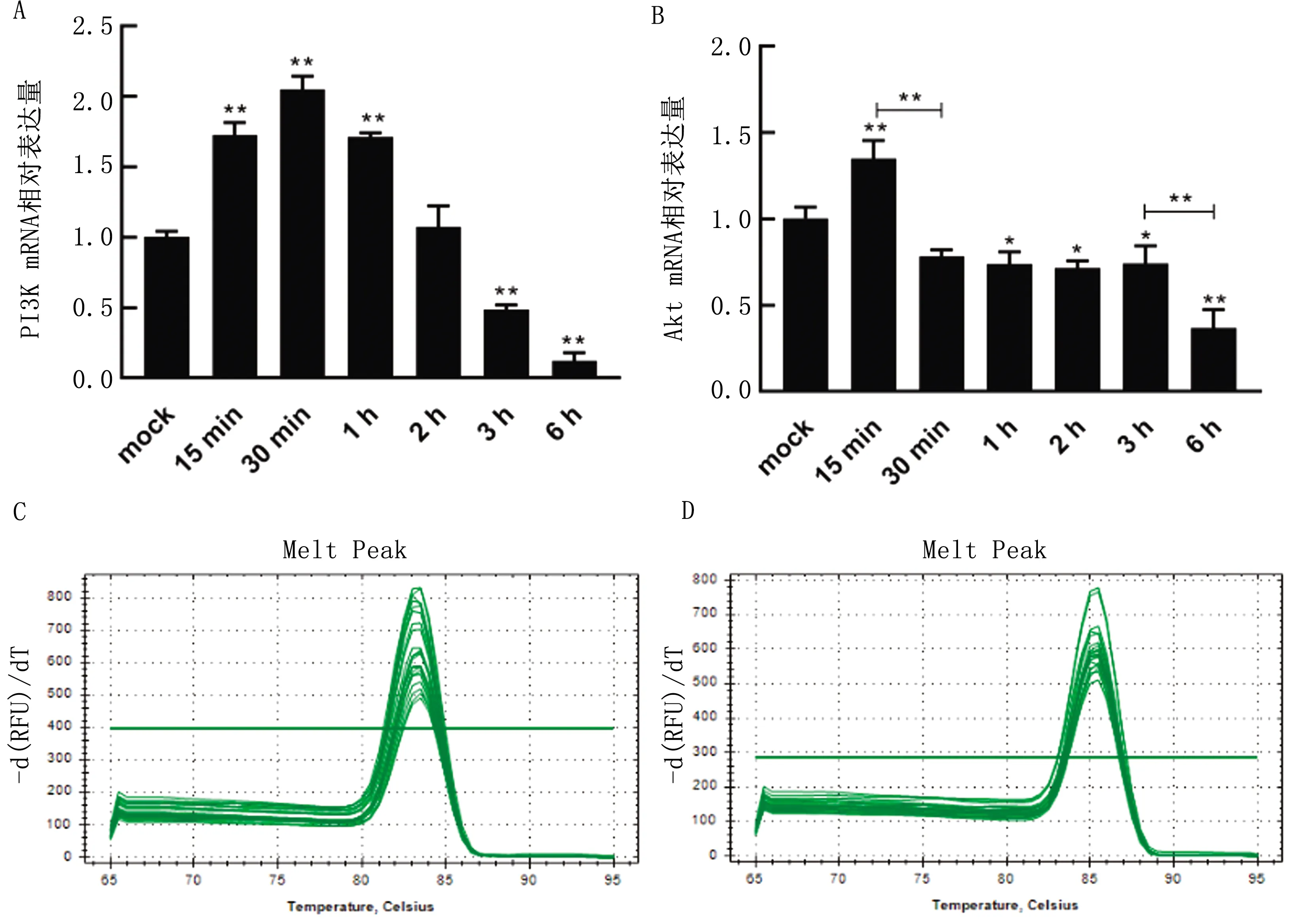
A.PI3K mRNA相对表达结果;B.Akt mRNA相对表达结果;C.PI3K熔解曲线;D.Akt熔解曲线。*.P<0.05;**.P<0.01。下同
2.4 PRV感染TG细胞后不同时间段PI3K/Akt相关蛋白表达变化1 MOI PRV感染TG细胞后在感染早期显著抑制PI3K的蛋白表达(P<0.01),但随着感染时间推移表达量无明显变化,不同时间段组间差异不显著(P>0.05);PRV感染后15 min会显著上调Akt的表达(P<0.01),随后发生抑制,与对照组相比差异显著(P<0.05),与两者mRNA表达变化结果基本相同,皆为抑制或先促进后抑制;而PRV感染TG细胞的早中期会诱导Akt发生显著的磷酸化(P<0.01),且在15 min时Akt的磷酸化达到峰值(图4)。Akt的磷酸化是PI3K/Akt信号通路激活的关键步骤,说明PRV感染TG细胞后会诱导PI3K/Akt信号通路激活并发挥一系列调控作用。
2.5 IFA观察PRV感染TG细胞后Akt的磷酸化蓝色荧光为DAPI染核,红色荧光为p-Akt在TG细胞内的表达。结果显示,PRV感染TG细胞后会诱导Akt产生明显的磷酸化,同时Akt磷酸化一般发生在TG细胞的细胞质以及细胞核内(图5)。
2.6 Annexin V-FITC法观察阻断PI3K/Akt后PRV感染TG细胞的凋亡情况磷脂酰丝氨酸(phosphatidylserine,PS)是检测细胞凋亡的关键分子之一,正常情况下PS一般存在于细胞膜里侧,当细胞出现凋亡时PS会从细胞里侧向外翻并暴露于细胞外表面,同时可与Annexin V特异性结合,故在荧光下凋亡细胞的细胞膜呈绿色。PI为红色染核染料。一般来说,细胞膜仅发出绿色荧光一般为早期凋亡细胞;细胞核发出红色荧光为死细胞;绿色以及红色共染为晚期凋亡细胞。结果显示,PRV+LY294002组与空白对照组、PRV组相比,早期凋亡细胞及晚期凋亡细胞数量均明显增多(图6);说明PRV感染TG细胞后会在一定程度上诱导细胞凋亡,同时PI3K/Akt信号通路在PRV感染TG细胞的凋亡过程中起到抑制细胞凋亡的作用。
2.7 流式细胞术结果结果显示,与对照组以及PRV感染组相比,PRV+LY294002组凋亡细胞总体数量明显增多,与原位荧光染色结果基本相符,说明PI3K/Akt信号通路在PRV感染TG细胞后抑制凋亡中发挥了重要作用(图7)。
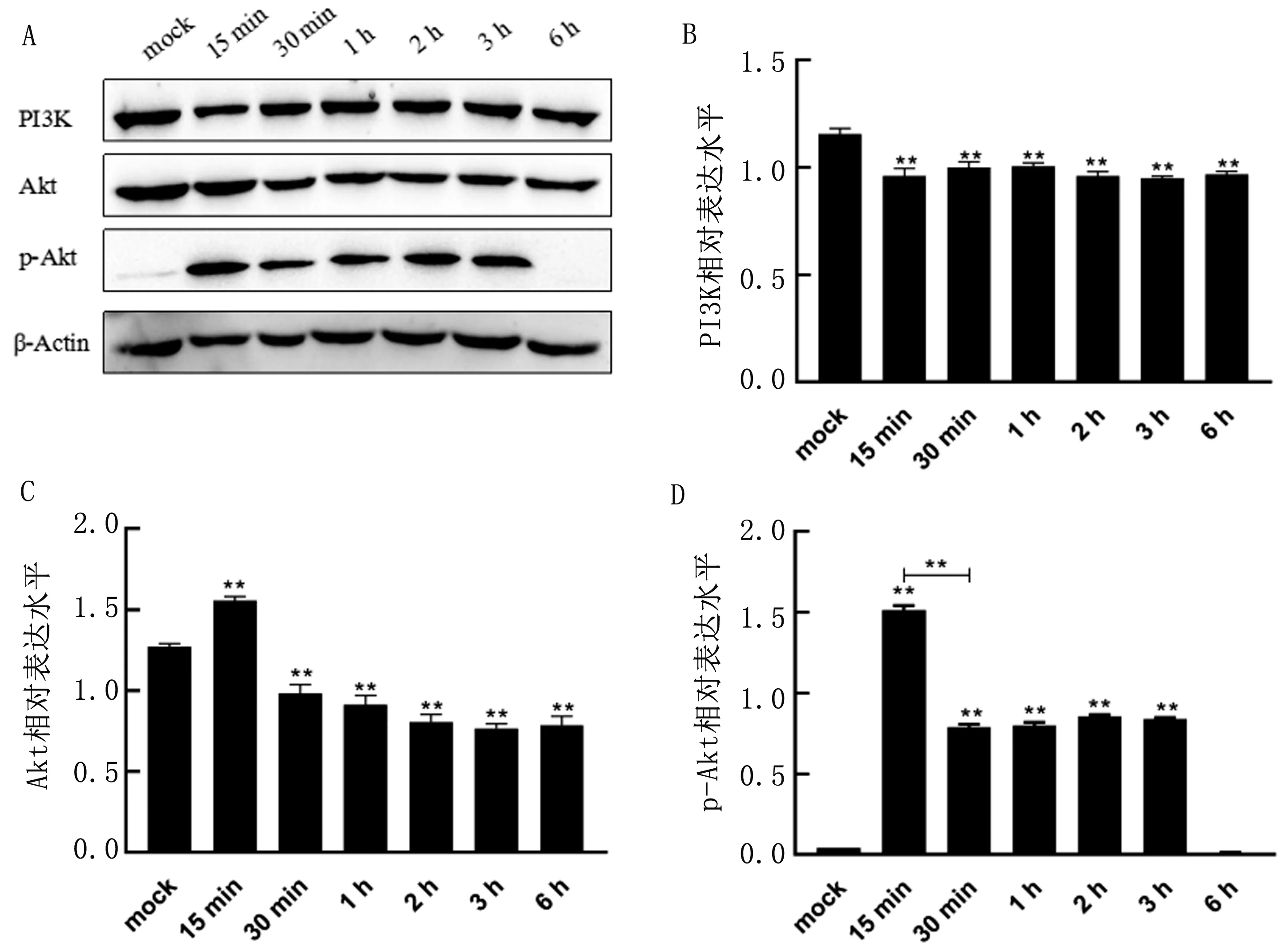
A.Western blot结果;B.PI3K蛋白条带灰度值分析结果;C.Akt蛋白条带灰度值分析结果;D.p-Akt蛋白条带灰度值分析结果

A,D.Akt磷酸化情况;B,E.DAPI染核;C,F.合并
2.8 阻断PI3K/Akt信号通路对PRV感染TG细胞Bcl-2及Bax蛋白表达的影响Western blot结果显示:与空白对照组相比,PRV组以及PRV+LY294002组Bcl-2蛋白表达量降低,同时Bax蛋白表达量提高,且Bcl-2/Bax蛋白表达比值降低(P<0.05),Bcl-2/Bax比值降低说明细胞处于凋亡过程(图8);说明PRV感染TG细胞会诱导其凋亡,并且PI3K/Akt信号通路于PRV感染TG细胞后在抑制细胞凋亡中发挥重要作用,同时PRV是通过经典的PI3K/Akt/Bax信号通路调控细胞凋亡。
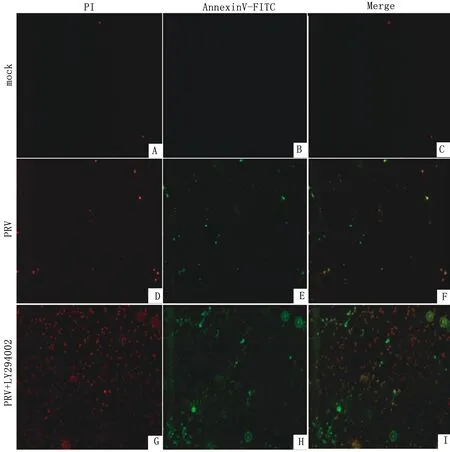
A,D,G.PI染细胞核;B,E,H.FITC染细胞质;C,F,I.合并

A.mock组;B.PRV组;C.PRV+LY294002组;D.各组细胞凋亡率比较
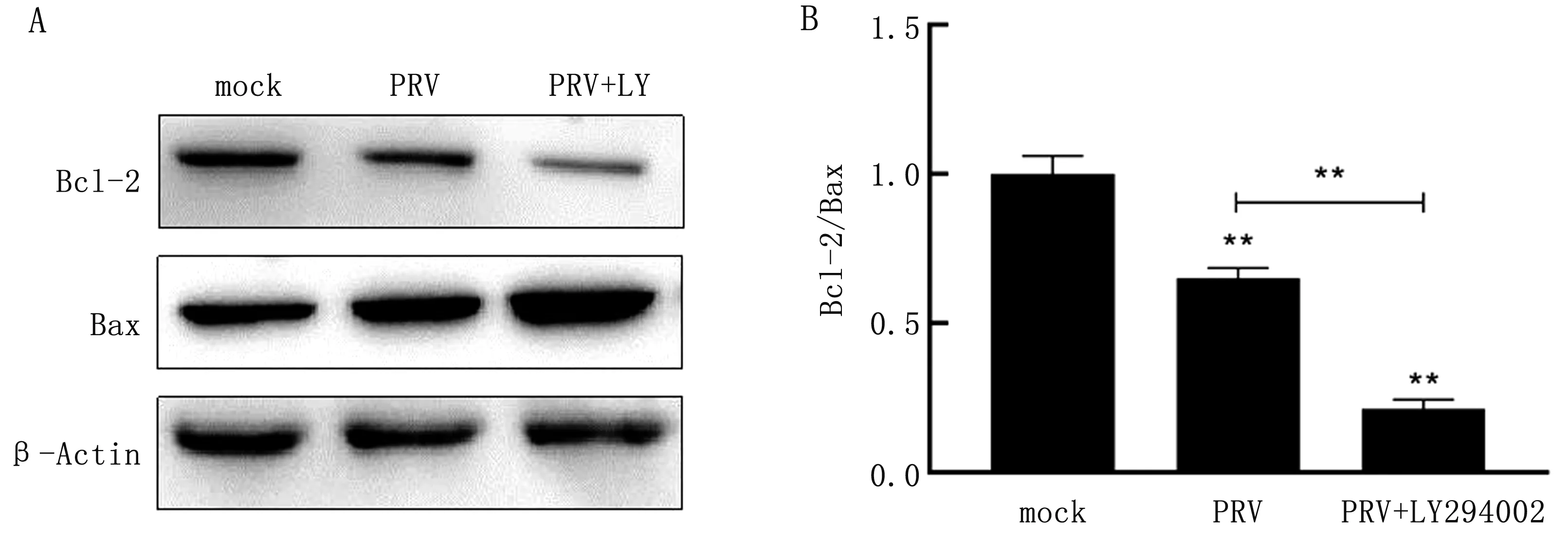
A.Western blot结果;B.Bcl-2/Bax灰度值分析结果
3 讨论
目前已有研究表明疱疹病毒感染细胞后会诱导PI3K/Akt信号通路激活并发挥生物学功能,同时疱疹病毒也会利用PI3K/Akt信号通路优化侵入、复制、潜伏感染、重新激活以及对宿主固有免疫反应的调节,且感染不同细胞发挥的作用可能有所不同[12]。Akt是一类凋亡抑制因子,在抑制细胞凋亡中起到重要作用,Akt磷酸化后可以使Bad等促凋亡相关因子发生磷酸化从而抑制凋亡[13]。Bcl家族成员在调控细胞凋亡的过程中发挥着重要的作用,而PI3K/Akt可以直接调控由Bcl-2诱导的细胞凋亡;此外,Akt直接抑制促凋亡蛋白Bax的磷酸化,后者是线粒体通透性的关键调节剂,一般以Bcl-2/Bax表达比值来间接判断细胞凋亡的过程,Bcl-2/Bax比值越高说明细胞抗凋亡能力越强,反之则易发生凋亡[14-16]。
TG是PRV潜伏感染的关键部位,本试验通过原代培养TG细胞,将其作为PRV感染的体外模型,从而探究PRV感染TG细胞诱导PI3K/Akt信号通路的变化规律。结果显示,PRV感染TG细胞无论是PI3K以及Akt蛋白的表达总体来说都处于抑制状态且与对照组相比差异显著,并且PRV感染TG细胞后的早期会诱导Akt发生磷酸化,这种磷酸化被认为是PI3K/Akt信号通路激活的必要条件。CHANG等[17]为探究PRV感染后诱导PI3K/Akt信号通路的影响,将1 MOI PRV感染PK-15细胞后在不同时间段检测PI3K、Akt以及p-Akt的蛋白表达,结果显示p-Akt的表达在4 h内出现明显降低,而在8 h时Akt的磷酸化基本消失;而PI3K、Akt的总蛋白表达与未攻毒对照组相比无明显差异,该结果可能是由于PRV感染的靶细胞不同所导致。研究发现,一些病原体感染脑内会诱导炎症反应从而影响脑神经元的代谢及存活,并抑制PI3K/Akt的蛋白表达,同时PRV感染机体后会诱导大量炎症因子的产生,这可能是PRV感染TG细胞后PI3K/Akt总蛋白表达降低的主要原因,说明PRV存在一种特殊的机制调控TG细胞内的PI3K/Akt信号通路[18-20]。
大量研究显示PI3K/Akt信号通路对病毒感染诱导的细胞凋亡中发挥了重要抑制作用,而对于PRV感染TG细胞后是否通过PI3K/Akt信号通路抑制凋亡目前暂不清楚[21]。本试验利用PI3K特异性抑制剂LY294002阻断TG细胞内PI3K/Akt信号通路,与空白对照组、PRV感染组相比,PRV感染阻断PI3K/Akt信号通路的TG细胞后早期凋亡细胞以及晚期凋亡细胞发出的荧光明显增多,说明PI3K/Akt信号通路在PRV感染TG细胞后抑制细胞凋亡中发挥了重要作用。GEENEN等[22]研究表明PRV的Us3蛋白在PRV感染细胞后抑制细胞凋亡中发挥了重要作用,与对照组相比Us3缺失株细胞凋亡相关因子更为明显,PRV可能利用PI3K/Akt信号通路抑制细胞凋亡以达到病毒在细胞内长时间大量复制的结果。Bcl-2是一种广泛表达的细胞质蛋白,在调节免疫系统和神经系统中的细胞存活以及抑制细胞凋亡起到关键作用[23-24]。Bcl-2和Bax是对凋亡具有拮抗作用的细胞质蛋白,在细胞凋亡的过程中缺乏Bcl-2会促进神经细胞的凋亡,缺乏Bax会抑制神经细胞的凋亡并促进了细胞的持续存活[25]。本试验结果显示,PRV感染阻断了PI3K/Akt信号通路的TG细胞后会诱导其发生凋亡,同时在感染的过程中抑制了TG细胞内Bcl-2的表达并促进了Bax的表达,说明PRV感染TG细胞后通过PI3K/Akt信号通路抑制TG细胞的凋亡且是通过经典的PI3K/Akt/Bcl-2/Bax途径。
细胞信号通路传导对于调控疱疹病毒的潜伏期和再激活的平衡至关重要,其中PI3K/Akt信号通路在疱疹病毒的潜伏感染起着重要的维持作用。PENG等[26]报道了PI3K/Akt信号通路与两种γ疱疹病毒潜伏感染的建立之间的关系,疱疹病毒感染细胞后会通过PI3K抑制剂以剂量依赖的方式促进病毒的复制与增殖,同时于疱疹病毒感染抑制PI3K/Akt通路的细胞中发现在感染的早期至晚期病毒的相关基因的表达均有所提高,说明PI3K/Akt信号通路在疱疹病毒的激活中起到了负调控作用[27]。本试验通过PI3K特异性抑制剂将TG细胞PI3K/Akt信号通路进行阻断,用PRV感染TG细胞后发现抑制了PI3K信号通路的TG细胞会在6 h 后迅速发生凋亡,这可能与PRV在TG细胞内再激活有关,PRV在阻断PI3K信号通路的TG细胞内激活并快速大量复制增殖,这可能是PRV诱导TG细胞发生凋亡的主要原因之一。
本研究发现PRV感染TG细胞后会以Akt磷酸化的形式诱导PI3K/Akt信号通路的激活,但会在感染中后期抑制其mRNA以及蛋白的表达;同时发现PI3K/Akt通路在PRV感染TG细胞后抑制TG细胞的凋亡中发挥重要作用,该结果为探究PRV潜伏感染TG细胞过程提供参考,同时通过靶向PI3K/Akt信号通路治疗PRV在TG细胞内的潜伏感染提供了新的思路。
