白藜芦醇纳米传递系统的研究进展
2022-03-03张文君吴梦婷张国锋陈泳霖
张文君,吴梦婷,张国锋,李 想,陈泳霖,杨 硕,*
(1.哈尔滨商业大学药学院,黑龙江 哈尔滨 150076;2.黑龙江生物科技职业学院,黑龙江 哈尔滨 150025)
白藜芦醇(resveratrol,Res),化学名3,5,4’-三羟基二苯乙烯,是一种含有芪类结构的天然非黄酮类多酚化合物,存在于藜芦、虎杖等药材中,也存在于葡萄、桑葚等食物中[1]。Res以反式异构体和顺式异构体两种形式存在,反式异构体生物活性更强但在紫外光照射下易转化为顺式异构体[2-3]。Res具有抗炎、抗氧化、抗自由基、抗心血管疾病、抗肿瘤等诸多生物活性[4],但其水溶性差、见光易分解的性质,以及体内的广泛代谢严重限制了其生物活性的发挥。近年来,纳米传递系统以其良好的生物相容性、靶向性及缓释性引起研究者的关注。Res纳米传递系统有望弥补Res自身物理性质的不足,提高生物利用度,使其充分发挥其生物活性,提高应用价值[5],并应用到药品、食品以及营养添加剂中。本文对Res的主要生物活性、药动学性质及其纳米传递系统的研究进展进行综述,以期为Res今后的研究与应用提供参考。
1 白藜芦醇生物活性及药动学性质
Res具有广泛的生物活性,如抗肿瘤、抗心血管疾病、抗菌抗病毒、抗衰老及雌激素样活性等(表1)[6-9]。Res可作为天然防腐剂延长食品的货架期,同时也可作为食品添加剂添加到食品中[10-11]。Res在人体内可发生广泛的II相代谢反应,迅速发生硫酸化和葡萄糖醛酸化,因此其在人体口服吸收率高达75%,但生物利用度不足1%,血液中只能检测到痕量原型药物[12-13]。受试者分别口服或静脉注射Res,口服后1 h观察到最大血药浓度,6 h后出现第2次峰值,而静脉注射后未出现第2次峰值,说明口服Res后,其可能在体内发生了肠肝循环[14]。Boocock等[15]给志愿者单剂量口服Res 0.5~5.0 g,口服给药0.8~1.5 h内即可出现最大血药浓度,但平均血药浓度较低。代谢产物以白藜芦醇硫酸结合物为主,此外还包括两种葡萄糖醛酸结合物,Res与其代谢物的半衰期基本相同。生物利用度是衡量制剂疗效的重要指标之一,目前改善Res物理性质、提高Res生物利用度的制剂策略包括协同给药、设计前体药物以及通过纳米传递系统制备成靶向制剂与缓控释制剂[16]。

表1 Res生物活性及作用机制Table 1 Biological activity and mechanisms of action of resveratrol
2 纳米传递系统的优势及其应用
纳米递送系统是一种粒径小于1 000 nm的新型递送系统,较常规制剂具有诸多优势,可在不改变药物活性成分的情况下弥补药物自身缺点。首先,通过不同载体材料及配比,可实现药物的缓释和靶向,减少药物的不良反应;其次,其粒径小、比表面积大且高度分散,在提高难溶性药物的水溶性和溶出速率的同时可延长药物的滞留时间,促进药物的吸收并提高了生物利用度;此外,载体所形成的封闭环境提高了药物的生物活性和稳定性[21-23]。如图1所示,现有纳米递送系统类型主要包括脂质体、聚合物胶束、纳米乳、纳米混悬剂、纳米粒和纳米囊泡等[24],根据所载药物的特性不同,纳米递送系统具有透皮给药、口服给药、黏膜给药、注射给药等诸多给药方式[22]。近年来,已有多种纳米药物上市或处于临床实验阶段[25](表2)。
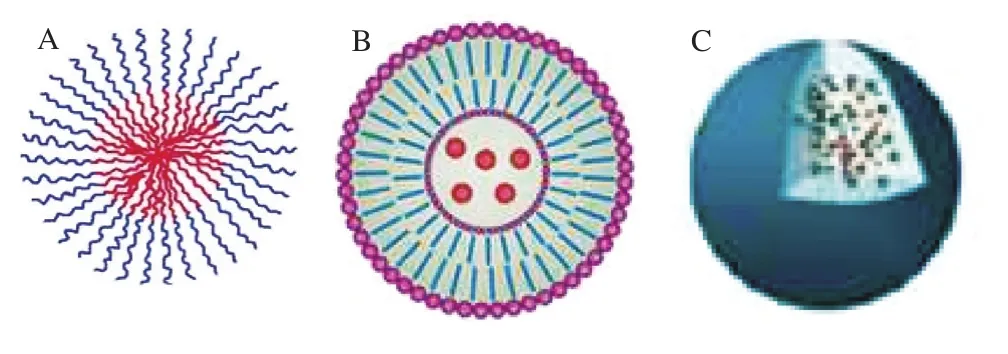
图1 药物的主要纳米传递系统[24]Fig.1 Major nano drug delivery systems[24]
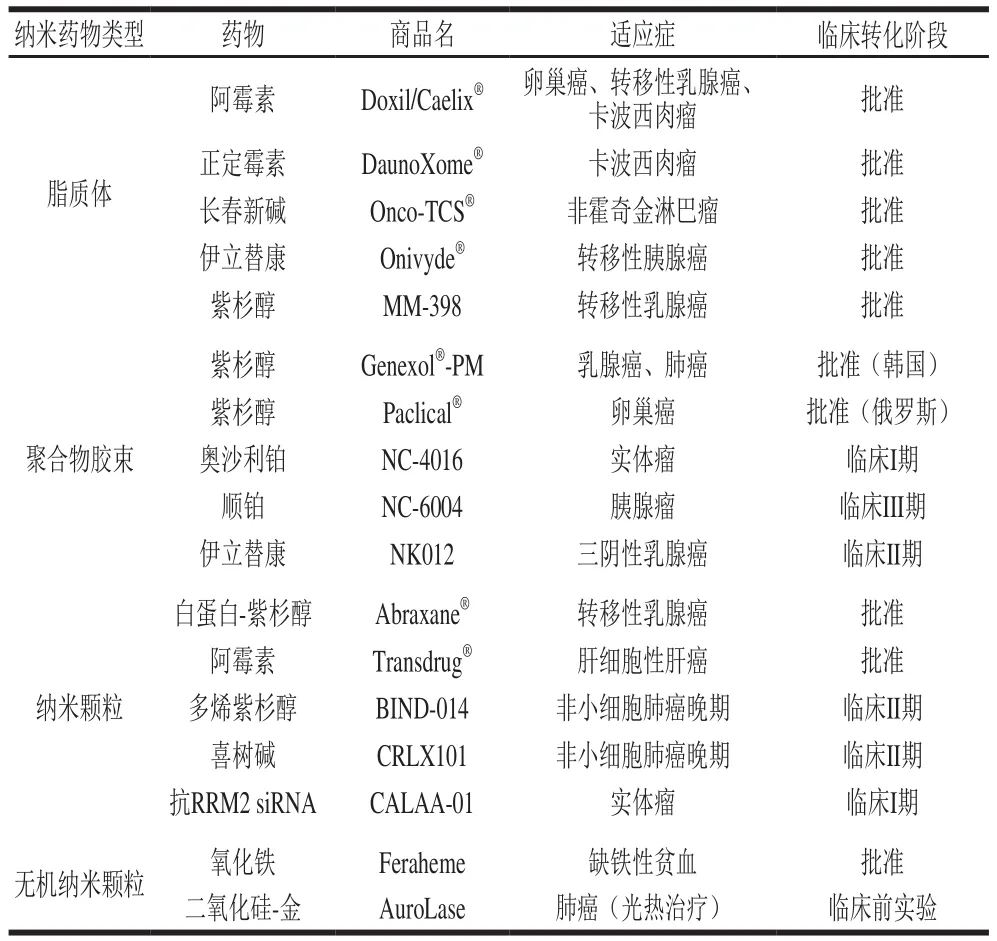
表2 临床转化中的部分癌症纳米药物[25]Table 2 Selected cancer nanomedicines in clinical translation[25]
3 白藜芦醇纳米传递系统
3.1 纳米粒
纳米粒由外壳、内核和活性物质组成,具有“核-壳”结构。其外壳材料决定稳定性、生物半衰期等性能,而内核决定纳米粒负载的活性物质类型。可通过载体对活性物质的包封作用实现缓释及靶向目的,纳米粒较常规制剂有诸多优势,首先,其可通过不同载体材料及配比实现活性物质的缓释和靶向,减少其不良反应;其次,其粒径小、比表面积大且高度分散,可使活性物质的滞留时间延长,从而促进其吸收并提高了生物利用度;此外,载体所形成的封闭环境提高了生物活性和稳定性[26]。
3.1.1 聚合物纳米粒
在活性物质应用领域中,可降解的合成高分子材料提供了诸多具有良好生物相容性的纳米载体,包括聚乳酸(polylactic acid,PLA)类共聚物、聚己内酯、聚酸酐等,这些化合物降解的最终产物为H2O和CO2,可随着人体正常代谢排出体外。
疏水性聚合物载体存在体内渗透效果不佳以及在血液循环中会被快速清除等弊端,将亲水基团在疏水性聚合物载体端基处进行修饰后,形成两亲性共聚物,克服了纳米粒与血浆蛋白表面间疏水或静电作用;聚合物链扩散和松弛的联合作用导致聚合物溶胀或溶蚀,使物质从纳米系统中释放出来[27-29]。Lindner等[30]采用乳化溶剂挥发法分别以PLA和两亲性嵌段共聚物聚乙二醇-PLA(polyethylene glycol-polylactic acid,PEG-PLA)为载体制备Res-PLA-纳米粒和Res-PEG-PLA-纳米粒,二者粒径和载药量均无显著差异(P>0.05);体外释放研究结果显示二者均符合Higuchi扩散动力学,24 h时释放率分别约18%和32%;72 h累计释放率分别为21.7%和35.5%,Res-PEG-PLA累计释放率是Res-PLA的1.6 倍左右,具有显著性差异(P<0.05)。
3.1.2 固体脂质纳米粒
固体脂质纳米粒(solid lipid nanoparticles,SLN)是以固态天然或合成的类脂如卵磷脂、单硬脂酸甘油酯等为载体,将活性物质包埋或夹嵌于载体中制备的粒径在10~1 000 nm范围内的固体胶粒包载系统,是提高难溶性物质口服吸收生物利用度的有效方法[31]。相关研究[32]以载脂蛋白E可以被血脑屏障上过表达的低密度脂蛋白受体所识别的特点,使用载脂蛋白E功能化的SLN对Res进行脑靶向递送。经表征,其包封率高达90%。对于Res浓度高达50 μmol/L的SLN,与阳性对照(EBM-2培养基)相比,未影响永生化人脑微血管内皮细胞生存力或膜完整性。与未经官能化的SLN相比,载脂白蛋白E官能化的SLN血脑屏障的通透性增加1.8 倍,这可能是Res向大脑内输送以治疗神经系统疾病的一种潜在策略。
3.1.3 无机纳米粒
研究人员依靠π-π堆积作用力,以氧化石墨烯(graphene oxide,GO)为载体经分散法制备装载Res的纳米粒(NGO-RV)[33],平均粒径98 nm,装载率约为89%。相比于游离Res,NGO-RV可使A549、NCI-H358两种人非小细胞肺癌细胞活性显著降低。体外释放实验中,NGO-RV在pH 5.0溶液中释放速率可达52.3%左右。张蓉蓉等[34]以氨基改性的介孔二氧化硅(aminomodified mesoporous silica particles,NH2-MSN)为载体材料,通过反复饱和溶液吸附法制备新型口服介孔二氧化硅载Res纳米粒(NH2-MSN-Res)。在pH 7.4 磷酸缓冲液中,4 h时基本释放完全;MSN-Res和NH2-MSN-Res在48 h内,释放率分别为81.4%和73.3%,均呈现明显的缓释特性。在跨膜转运实验中,NH2-MSN-Res的表观渗透系数远高于Res溶液和MSN-Res,表明氨基修饰之后的MSN的跨膜转运能力更强。另外,药动学实验结果表明,NH2-MSN-Res的达峰浓度明显大于Res溶液和MSN-Res,进一步说明经氨基修饰后,MSN的胃肠道吸收效果有所改善;NH2-MSN-Res的血药浓度-时间曲线下面积是Res溶液的2.58 倍,但其清除率只有Res溶液的27.6%,说明NH2-MSN-Res可提高Res的生物利用度。杜倩等[35]以油酸修饰的Fe3O4为载体,通过乳化超声分散法制备槲皮素和Res共载磁性SLN(QR-MSLN)。与槲皮素和Res共载SLN(QR-SLN)相比,QR-MSLN中槲皮素在各时间点的释放率均显著增加,Res在前6 h释放速率基本相同,之后逐渐升高,12 h内累计释放率超过80%,说明经油酸改性后,整体缓释效果有所改善。QR-MSLN与槲皮素和Res原药、QR-SLN相比,QR-MSLN对肝癌细胞(H22)的肿瘤抑制率显著增高(P<0.05)。
3.1.4 仿生型纳米粒
仿生型药物递送系统将纳米粒与细胞或蛋白等重组,模拟自身结构功能或人体内源性物质,避免机体将药物视为外源性物质排出体外[36]。Geng Tao等[37]将肿瘤靶向分子精氨酸-甘氨酸-天冬氨酸通过PEG修饰在人血清白蛋白(human serum albumin,HSA)包载的Res表面,制备负载Res的HSA纳米粒,并考察对胰腺肿瘤PANC-1细胞的细胞毒性。与游离Res和未经PEG、氨基酸修饰的Res HSA纳米粒相比,其不仅对正常细胞几乎无细胞毒性,且细胞摄取率最高,对PANC-1细胞的细胞毒性更高;此外,PEG和HSA特有的性质使得其延长了Res的血液循环时间,较游离Res在血液中的循环时间延长了约5 倍;静脉注射后,Res在肿瘤组织中的含量比游离Res组高8 倍,结果表明其具有更高的抗癌作用。不同类型的纳米粒具有各自的特点(表3)。

表3 纳米粒类型及特点Table 3 Types and characteristics of nanoparticles
3.2 纳米乳
纳米乳是由水相、油相、乳化剂、助乳化剂以适当比例形成的平均粒径50~1 000 nm的热力学稳定体系。纳米乳安全性高且制备简单,包括剪切法、高压均质法和超声法等[45-46]。与传统输送系统相比,纳米乳可提高亲脂性活性化合物的水溶性、避免发生降解反应并促进细胞摄取[47]。研究人员[48]以制备鼻腔给药的脑靶向Res纳米乳剂,与Res混悬液相比,纳米乳剂体外释放率显著提高至(78.53±4.70)%;纳米乳剂12 h内体外经皮渗透后释放率达(63.95±4.70)%。相比于口服纳米乳的最大血药浓度和药时曲线下面积经鼻腔给药分别提高2.23 倍和8.05 倍(P<0.05),且对鼻黏膜安全。Sessa等[49]采用高压均质法制备Res纳米乳,在通过Caco-2细胞单层运输过程中由于Res在脂质相中受到亲水性和亲脂性乳化剂的双重保护,对基底外侧的样品进行高效液相色谱分析时未发现Res代谢物。
虽然近年来国内外有关纳米乳的研究不断深入且有产品上市,但其推广应用也存在诸多局限性,如稳定性较差、工业生产受限以及(助)表面活性剂具有一定毒性仍是导致上市品种少的主要因素。
3.3 纳米囊
纳米囊是一种粒径在10~1 000 nm内以高分子聚合物薄层如磷脂、小单室脂质体及具有衣架式结构的表面活性剂将药物包埋在其膜壳内的新型纳米传递系统[50]。制备纳米囊的方法主要包括乳化聚合法、天然高分子凝聚法、液中干燥法、盐析法、界面沉淀法等[51]。与普通的微囊相比,纳米囊更小的粒径使其可直接注射进入血液循环。与基质纳米球相比,该系统优点在于其形成纳米囊包膜的聚合物含量低且对药物具有更高载药量,此外,纳米囊将药物限制在囊心可避免药物与组织直接接触,减少了给药部位的刺激并更好地实现缓释作用[52]。Jeon等[53]根据表面的亲水材料壳聚糖(chitosan,CS)和γ-聚谷氨酸(γ-poly(glutamic acid),γ-PGA)可以将疏水性Res与水性环境分离的原理,采用离子凝胶法制备负载Res的CS/γ-PGA纳米囊(CS/γ-PGA-Res),随着CS/γ-PGA比的降低,较高的静电相互作用引起CS/γ-PGA纳米粒子的交联,导致结构更紧密,粒径显著减小至100~200 nm,从而提高了水溶性和细胞摄取率。当暴露于紫外线下时,由于CS/γ-PGA为Res提供了可抵御紫外线诱导降解的物理屏障,CS/γ-PGA-Res纳米囊在紫外线暴露3 h后trans-Res的质量分数仍可保持73%左右。
3.4 纳米脂质体
NLs是一种粒径范围在10~1 000 nm的脂质体,粒径小,且兼备脂质体良好的生物相容性。NLs的制备方法主要包括超声波分散法、溶剂乳化-蒸发法、薄膜蒸发法和冷冻干燥法[54]。王新春等[55]采用乙醇注入法制备Res-NLs,大鼠在体肠吸收实验结果显示,Res原料药在各肠段均被吸收,但吸收速率常数(Ka)方差分析结果无显著性差异,Res-NLs在回肠段Ka高度显著高于其他肠段(P<0.001),结肠段Ka极显著低于其他肠段(P<0.01),但Res-NLs在各肠段的Ka均高度显著高于Res原料药(P<0.001),由此说明Res-NLs可实现缓释作用,并且促进了Res在小肠的吸收。相关研究[56]同样以乙醇注入法制备Res-NLs,经噻唑蓝分析,Res-NLs和Res在48 h内的半数抑制浓度分别为49.2 μg/mL和105.4 μg/mL。与Res相比,Res-NLs对HepG2人肝癌细胞具有显著的抑制作用。在细胞周期分析结果中发现,经Res-NLs处理的HepG2细胞中G2/M期的比例显著增加,而即Res-NLs可有效抑制HepG2细胞的增殖并阻断G2/M期,最终诱导细胞凋亡。
3.5 纳米混悬剂
纳米混悬剂是指在少量的表面活性剂或高分子聚合物等稳定剂作用下,将药物分散于水中形成的给药系统,具有粒径小、载药量高、服用剂量准确等优点。可提高大多数难溶性药物的溶解度,进而提高生物利用度;此外,也可对其进行修饰,实现药物的靶向和长循环。纳米混悬剂可作为最终剂型应用,也可作为中间体进一步制成可用于口服、注射、经皮、肺部和眼部等给药途径的其他剂型。纳米混悬剂的制备方法主要包括溶剂沉淀法、高压均质法、沉淀法-高压均质联合技术以及介质研磨法[57-58]。
Sinico等[59]通过介质研磨法制备了白藜芦醇纳米混悬剂。粒径分析和差示扫描量热分析结果显示,其平均粒径在200~300 nm范围内,粒径的减小既未使药物结晶发生改变,也未使反式双键异构化,纳米结晶均匀分散无聚集现象;相比于原料药,白藜芦醇纳米混悬剂晶体纳米尺寸提高药物饱和溶解度近10 倍。此外,评估纳米混悬剂中Res的皮肤递送效果时发现,与原料药粗混悬液相比,白藜芦醇纳米混悬剂渗透到皮肤中的Res含量均有所提高,且使用质量分数0.5%泊洛沙姆188制得的纳米混悬剂渗透到皮肤中的Res含量最高。
3.6 纳米醇质体
醇质体是一种新型脂质体,由高质量分数(20%~45%)、低分子质量的醇以及水和磷脂组成,具有多层囊泡结构,能包封多类药物,如亲脂性、亲水性的小分子和蛋白类大分子药物[60]。相比于传统脂质体,醇质体粒径较小,结构稳定,包封率高。此外,醇质体的有效化学位移各向异性更小,极性磷脂头基运动性更强,磷脂双层具有更高的流动性和更低的转变温度。醇质体中磷脂堆积不如脂质体紧密,膜具有较高的阳离子通透性。乙醇可引起皮肤脂质双层排列紊乱,使流动性增强,随后,可延展性的醇体囊泡透过被扰乱的角质层双层,增加药物的透皮性能,使得药物能够到达皮肤深层或进入体循环,使其成为经皮给药较为理想的载体[61]。Zhang Zhen等[62]通过乙醇注入法制备白藜芦醇纳米醇质体,分别用DPPH自由基清除能力、ABTS阳离子自由基清除能力以及铁离子还原法来评价其体外抗氧化作用。所制得白藜芦醇纳米醇质体呈类球形囊泡结构,粒径为(121.5±2.4)nm,平均包封率为85.84%。白藜芦醇纳米醇质体对DPPH自由基和ABTS阳离子自由基的清除率明显高于原料药,总抗氧化能力测定法结果显示空白醇质体几乎无还原性,而同浓度的白藜芦醇纳米醇质体的FeSO4当量为原料药的1.82 倍,说明醇质体能明显增强白藜芦醇的抗氧化能力。
醇质体虽然可促进生物活性分子透过皮肤和细胞膜进行传递,但仍有弊端亟待解决,如高浓度醇对某些药物的影响、不稳定的结构使药物易在透皮过程中渗漏等,因此今后还需对醇质体进行更深入的研究,使其更好、更广泛地应用于药剂学领域及临床。
3.7 聚合物纳米胶束
聚合物纳米胶束是指由可生物降解且具有生物相容性的两亲性嵌段聚合物在水溶液中自组装形成的具“核-壳”结构的聚合物分子聚集体,在胶束形成过程中,疏水性药物分子与聚合物链段发生协同作用,被包裹进疏水内核而形成载药纳米胶束。聚合物纳米胶束粒径较小(介于10~200 nm之间),有片状、棒状、管状等形态,以球形最为常见;其种类包括两亲性嵌段共聚物胶束、接枝共聚物胶束、聚电解质胶束和非共价键胶束等[63-64]。Nie Mingjun等[65]以mPEG-PLA为载体合成了负载白藜芦醇的聚合物纳米胶束,结果表明,纳米胶束的粒径为(52.87±3.80)nm,载药量和包封率分别为(11.0±2.3)%和(72.8±2.4)%。该制剂在长时间内还显示出白藜芦醇的两相持续释放。另外,与游离白藜芦醇相比,纳米胶束制剂中的白藜芦醇具有更高的生物利用度。在去卵巢大鼠模型中,纳米胶束在与游离白藜芦醇等效剂量下显著提高了骨矿物质密度和骨强度,加强了骨钙蛋白和I型胶原的C端远端肽等骨转换标志物的修复。
聚合物纳米胶束由于具有亲水端,在一定程度上可避免药物被网状内皮系统吞噬,但因其是动力学不稳定体系,一定程度上制约了聚合物胶束纳米药物的应用。因此,对聚合物结构进行修饰或设计聚合物前药,进一步提高聚合物纳米胶束的稳定性具有十分重要的意义。
纳米传递系统具有诸多类型,在食品、药品等领域中的创新研究中,要结合不同传输系统的结构与特点选择传递系统进行开发与应用(表4)。

表4 不同纳米传递系统的比较Table 4 Comparison of different nanodelivery systems
4 结 语
随着生活水平不断提高,以天然活性物质为主要成分的营养健康食品和药品越发受到关注。白藜芦醇具有抗炎、抗病毒、抗氧化、抗心血管疾病和抗肿瘤等诸多生物活性作用,尤其以优良的抗肿瘤效果使其成为继紫杉醇后又一天然抗肿瘤活性物质,近年来可利用新型纳米传递系统改善其水溶性差、易光解的性质。但目前研究仍存在不足之处,个别载药系统载药量低、性质不稳定以及纳米药物制备技术成本高且工业化生产难度大等问题仍需更深入地探索。根据白藜芦醇的生物活性以及作用部位,可考虑与其他活性物质联合使用,并采用合理的剂型种类,使其更好地发挥治疗效果。相信随着研究的不断深入,负载白藜芦醇的纳米传递系统服务于临床和食品应用指日可待。
