体外诊断试剂真实世界研究的进展与思考
2022-03-03刘东来
刘东来
中国食品药品检定研究院
王佑春
中国食品药品检定研究院
许四宏*
中国食品药品检定研究院
真实世界研究是围绕相关科学问题,综合运用流行病学、生物统计学、循证医学等多学科方法技术,利用真实世界数据开展的研究,相比于传统临床试验,对纳入患者病情限定更少、覆盖人群更广、样本量可能较大、研究结果的外推性可能较好。近年来,真实世界研究产生的真实世界证据,作为直接或辅助的临床证据,用于支持药品和医疗器械的监管决策,成为医疗卫生领域的热点话题。真实世界证据在体外诊断试剂(in vitro diagnostic,IVD)临床评价和监管中的应用,在行业广泛、积极的探索下,也展现出了巨大的潜力。
真实世界证据来源于真实世界数据,真实世界数据是指传统临床试验以外的,从多种来源收集的各种与患者健康状况和(或)常规诊疗及保健有关的数据[1]。相较于传统临床试验,真实世界数据具有来源广泛、患者多样性和还原真实应用场景等特点。真实世界研究由于其特性,常常回答的是与临床试验所不同的临床问题。如何更好地挖掘真实世界数据的价值,在遵循伦理原则、符合法规要求的基础上,探索真实世界研究的方法、应用和边界,是监管机构、研究者和医药企业等各方共同关注的焦点。
1 真实世界研究的监管法规和审批实践
国内外监管机构陆续出台了多个法规和指导原则,对真实世界数据的研究加以引导和规范。以下简单梳理国家药品监督管理局(National Medical Products Administration,NMPA) 出台的相关法规。在药品审评方面,2020年1月,NMPA 发布《真实世界证据支持药物研发与审评的指导原则(试行)》,梳理了利用真实世界证据支持药物研发和评价的基本原则和研究方法[2]。2020年8月,NMPA 发布《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》,着重介绍了真实世界研究应用于儿童药物研发这一特定应用上的关注点[3]。2021年4月,国家药品监督管理局药品审评中心发布《用于产生真实世界证据的真实世界数据指导原则(试行)》,关注真实世界研究的根本(即真实世界数据),并从多个方面对真实世界数据给出了具体要求和指导性建议,以帮助申办者更好地进行数据治理,评估真实世界数据的适用性[4]。
在医疗器械审评方面,2020年11月,NMPA 发布《真实世界数据用于医疗器械临床评价技术指导原则(试行)》[1],强调了应在遵循相关法规的前提下使用指导原则,详细介绍了真实世界数据的来源和质量评价、真实世界研究的设计常见类型和统计分析方法,同时列出了将真实世界证据用于医疗器械临床评价的11种常见情形,包括用于支持产品注册,作为已有证据的补充;支持适用范围、适应症、禁忌症的修改;支持附带条件批准产品的上市后研究;作为单组试验的外部对照等。
我国监管部门也在不断探索将真实世界证据应用于审批实践。2018年10月,国家药品监督管理局药品审评中心基于3家医院患者的回顾性数据研究获得真实世界证据,扩大了贝伐珠单抗的适应症[5]。2020年3月,NMPA 批准了一款“青光眼引流管”产品的注册。该产品在注册中使用了在海南博鳌乐城国际医疗旅游先行区收集的临床真实世界证据进行人种差异评价,成为国内首个使用境内真实世界数据的医疗器械产品[6]。另有多个药物和器械进入海南临床真实世界数据应用试点[7]。海南的试点工作属于《真实世界数据用于医疗器械临床评价技术指导原则(试行)》明确的真实世界证据用于医疗器械临床评价的常见情形之一,即临床急需进口器械在国内特许使用中产生的真实世界数据,可用于支持产品注册,作为已有证据的补充。
在法规引领和相关案例的启示下,围绕药品和医疗器械真实世界研究方法和应用的探索方兴未艾,而真实世界数据在体外诊断试剂监管领域的应用和探索却未受到充分关注。虽然《真实世界数据用于医疗器械临床评价技术指导原则(试行)》中明确医疗器械包括体外诊断试剂,但由于体外诊断试剂临床试验要求的特殊性,如何开展与之相适应的真实世界研究仍有待进一步探索。
2 体外诊断试剂的临床评价要求和真实世界研究适用性
探索真实世界研究在体外诊断试剂领域的应用潜力和价值,需要先考察体外诊断试剂传统临床试验的研究方法。通常情况下,体外诊断试剂临床试验采用试验体外诊断试剂与临床参考标准(或已上市同类产品)进行比较研究的方法,以直接(或间接)评价试验体外诊断试剂的临床灵敏度和临床特异度,从而证明其临床性能满足预期用途的要求。临床试验受试者应来自产品预期用途所声称的适用人群(目标人群),如具有某种症状、体征、生理、病理状态或某种流行病学背景等情况的人[8]。
2.1 受试者选择和样本收集
《体外诊断试剂临床试验技术指导原则》建议,体外诊断试剂的临床试验受试人群应能够代表目标人群的特征,包括人口学特征(性别、年龄)、症状、体征、合并症以及疾病的阶段、部位和严重程度等;同时受试者应排除不适合该临床试验的生理或病理特征[8]。
如受试者样本的收集是基于其他临床研究的受试者选择要求,或并未依据任何临床研究的规定,则该类样本对于本次临床试验为既往样本。对于罕见遗传病、罕见肿瘤基因突变和一些低发病率的病原体感染等体外诊断试剂而言,使用既往样本可以有效地拓宽临床研究的路径、提高实操的可行性。通过前瞻途径寻找罕见阳性病例样本往往耗时漫长、成功率低,回顾性地收集既往罕见阳性病例样本可以有效地解决灵敏度性能评价的问题。既往样本的问题在于,其受试者入排标准和样本采集、处理过程都不是针对临床目的而预先规定,因而可能存在异质性和偏倚。《体外诊断试剂临床试验技术指导原则》对于既往样本的使用,有较为明确的提示:特定情况下,申办者可考虑纳入,但需格外注意充分论证可能的选择偏倚等问题。
回归到真实世界数据的定义,真实世界数据是传统临床试验以外的,从多种来源收集的各种与患者健康状况和(或)常规诊疗及保健有关的数据[1]。真实世界数据和既往样本有着相通之处,可以说,既往样本的信息即属于一类特殊的真实世界数据。使用既往样本须符合《医疗器械临床试验质量管理规范》《体外诊断试剂临床试验技术指导原则》等法规规定及相关产品技术审查指导原则的要求,以合法性为前提。此外,对真实世界研究而言,真实世界数据的相关性和可靠性是前提条件。只有明确与研究目的相关的临床问题,预先制定好数据采集方案,才能够得到高质量的真实世界数据,准确、充分地回答临床问题。因此,既往样本的选择和使用,都需要围绕临床问题展开,并预先确定样本选取范围、规定样本采集流程和数据分析方法,以保证数据的真实性、完整性,控制相关偏倚。
2.2 体外诊断试剂临床试验设计类型
根据在临床试验过程中是否依据试验体外诊断试剂检测结果对受试者加以干预,可以将体外诊断临床试验大致划分为2 种类型:干预性研究和观察性研究。
干预性研究中,研究者会在试验体外诊断试剂检测结果的基础上,对患者进行对应的治疗干预或疾病管理,通过评价治疗效果或患者受益,为支持体外诊断试剂安全有效性的判定提供证据。这种研究设计往往花费和工作量较大、周期较长,通过临床试验的方式去开展的可行性较低。
观察性研究中,试验体外诊断试剂的检测结果不用于患者的管理,不影响临床决策。临床试验中通过评价该检测结果与受试者临床参考标准(或已上市同类产品)判定结果的一致性,确认产品临床性能。临床性能研究需要获得2 个关键信息:一是试验体外诊断试剂的检测结果,此时可能需要受试者在临床常规诊疗外提供额外的样本以完成检测;二是受试者的目标状态,此时可能需要让受试者接受临床参考标准的检查(或比对体外诊断试剂的检测)。根据以上信息的获取方式不同,观察性研究又可大致分为2 种设计类型[9]。
第一种为前瞻性研究。此时研究者将会对受试者的样本采集和(或)疾病诊断流程进行干预。也就是说,受试者可能需要专门为临床试验进行样本采集和(或)专门为临床试验而做临床参考标准的确认检查。这也是体外诊断试剂临床试验最常见的一种情形。前瞻性研究存在的问题包括罕见病例的收集困难、临床参考标准的依从性差或随访周期长等。第二种为回顾性研究。这种类型的研究不会对受试者做任何干预,包括样本采集和受试者目标状态的确认,即在符合伦理要求的前提下,直接使用受试者的剩余样本和疾病诊断结果(或比对试剂检测结果)。回顾性研究使用的即为既往样本,一定程度上属于真实世界研究的范畴。
干预性研究和部分的前瞻性研究,由于临床试验的执行难度高、投入大、周期长,使申办者不得不权衡其中的风险而不敢轻易投入,从而造成了某些创新和临床急需产品延迟上市。当采取一定研究设计和统计分析方法,从原本可能存在偏倚和缺陷的真实世界数据中提炼出有效科学证据时,真实世界研究就为这些创新和临床急需产品提供了一个补充证据的途径。美国食品药品监督管理局(Food and Drug Administration,FDA)依据真实世界证据,已经批准多个体外诊断试剂产品[10]。
3 真实世界证据支持体外诊断试剂临床评价和监管决策的案例
3.1 利用生物样本库和医疗记录进行新生儿罕见病筛查产品的有效性评价
FDA 于2014年批准EnLite Neonatal TREC Kit 上市。 该产品使用干血斑标本,半定量检测T 细胞受体重排删除环DNA(T-cell receptor excision circle,TREC), 用于新生儿严重联合免疫缺陷病(severe combined immunodeficiency,SCID)的筛查。TREC 是T 细胞在胸腺发育过程中形成的DNA环,反映T 细胞的胸腺输出功能,SCID 患儿TREC 水平显著降低[11]。SCID 患儿若没有及时干预治疗并重建免疫系统,将在1年内由于感染而死亡;若能早期发现并对患儿进行及时干预,可以显著改善患儿预后[12]。SCID在美国的发病率为 1/58 000(95%CI:1/80 000~1/46 000)活产婴儿,我国也将此疾病列入《罕见病诊疗指南(2019年版)》[12]。由于发病率低,EnLite Neonatal TREC Kit 通过真实世界研究开展有效性评价,并作为关键证据支持FDA 上市批准。该研究的信息摘要简述如下[11]。
3.1.1 研究类型
观察性研究,与真实世界医疗记录随访的临床结局比较,评价考核试剂的灵敏度、特异度。
3.1.2 开展地点
丹麦史坦顿血清研究所(Statens Serum Institute,SSI)。
3.1.3 样本来源
新生儿筛查样本来源于丹麦生物样本库;同时回顾性纳入来自美国的17 例阳性样本。
3.1.4 临床结局获取
通过丹麦医疗记录进行12~17 个月的随访。
3.1.5 研究结果和统计分析
入排情况:2012年6月26日~2012年8月6日期间,SSI生物样本库按顺序接收的样本6389 例,全部纳入研究。排除42 例:取样时间超期29 例,质量不合格样本1 例,无法通过医疗记录获取随访数据1 例,重复性样本2 例,偏离试验标准操作流程9 例。剩余6347 例样本按照试剂盒标准操作流程完成检测。
随访情况:6347 例样本全部为SCID 阴性。通过疫苗接种和医院医疗记录确认5437 例,剩余910例通过其他登记系统数据确认。
灵敏度:来源于美国的17例阳性样本,考核试剂检测结果无效1 例( 内标扩增不合格),阳性结果16 例,灵敏度为100%(16/16,95%CI :79.4%~100%)。
特异度:通过疫苗接种和医院医疗记录确认的5437 例阴性样本,考核试剂检测结果无效11 例,阳性结果16 例,特异度99.7%(5410/5426,95%CI:99.4%~99.8%)。另一真实世界数据确认的910 例阴性样本,特异度99.5%。
3.1.6 真实世界研究特点
新生儿罕见病筛查、生物样本库、真实世界随访,尤其是真实世界中生物样本库和医疗记录信息关联性好,数据质量高,仅有1 例样本无法通过医疗记录随访到结果。整体研究偏倚小:特定时间段内接收的全部样本,避免了选择偏倚;排除样本量只有42 例(0.66%);考核试剂检测失败率低(0.2%)。
3.2 在真实世界中开展干预性研究进行新生儿筛查产品的有效性评价
FDA 于2017年 批 准SEEKER 系统(仪器+ 试剂)上市。该产品使用干血斑标本,定量检测表1中的4 种酶活性,用于4 种溶酶体贮积症的新生儿筛查[13]。

表1 SEEKER 系统检测的4 种酶活性及对应疾病、发病率[13]
SEEKER 系统的有效性验证完全依托真实世界筛查过程开展,属于真实世界研究设计类型之一的实用性临床试验。研究信息摘要简述如下。
3.2.1 研究类型
干预性研究,嵌入真实世界的新生儿筛查流程,与真实世界筛查所得到的临床结局进行比较,评价考核产品的灵敏度、特异度,同时获得考核产品真实世界场景应用的鲁棒性,以及4 种疾病的发病率。
3.2.2 开展地点
密苏里州公共卫生实验室(Missouri State Public Health Laboratory,MSPHL)。
3.2.3 样本来源
嵌入MSPHL 的常规筛查程序,所有收到的新生儿筛查样本。
3.2.4 临床结局获取
首次检测结果为阳性的,应按筛查流程复测并进行相应风险评估。综合判定为筛查阳性的转入后续确诊程序,获得确诊和排除结果;综合判定为筛查阴性的进入随访。
首次检测结果为阴性的,判定为筛查阴性,进入随访。
随访依托密苏里州卫生和高级服务部门(Missouri Department of Health and Senior Services,MDHSS)的主动监测项目开展,跟踪假阴性报告,随访时间15 个月。
3.2.5 研究结果和统计分析
样本量:预试验阶段(初始6 个月)入组48 813 名新生儿的干血斑标本,对产品进行了改良。关键性试验阶段(后续18 个月)入组105 599 名新生儿的干血斑标本,其中510 名因样本不合格或检测无效予以剔除,剩余105 089 名。
随访情况:根据MDHSS 的主动监测项目,研究期间未有假阴性报告。
灵敏度和特异度:关键性试验中SEEKER 系统筛查阳性结果329 例,经风险评估后136 例转入确诊程序,其中7 例脱落,剩余得到37 例临床真阳性,具体结果见表2。随访期间未有假阴性报告,故考核试剂盒灵敏度100%;4 种检测物的特异度在99.903%~99.965%。

表2 真实世界数据用于新生儿溶酶体贮积症的筛查分析[13]
4 种新生儿溶酶体贮积症的发病率:合并初始6 个月的数据,24 个月内SEEKER 系统筛查后共确诊73 个患者,对应4 种疾病的数量和发病率分析见表3。
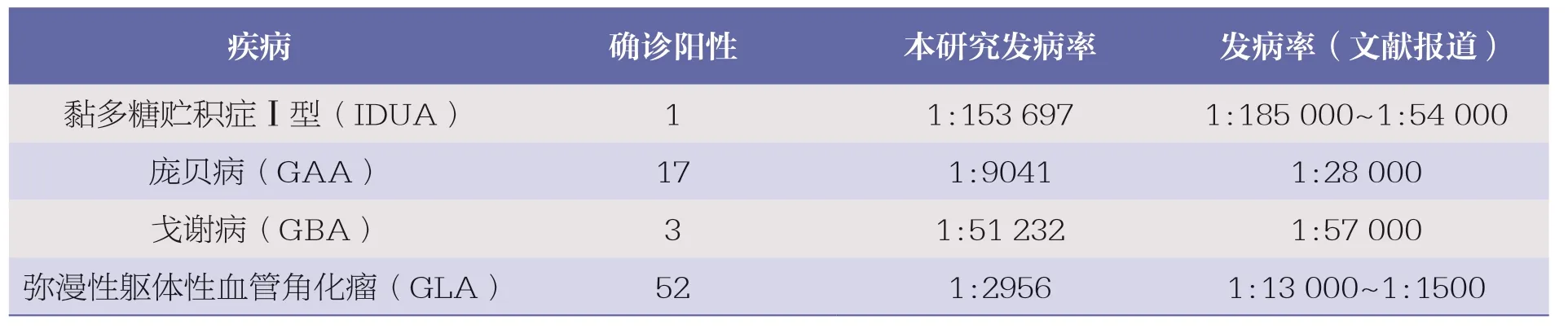
表3 真实世界数据用于新生儿溶酶体贮积症的发病率分析[13]
3.2.6 真实世界研究特点
实用性临床试验,完全依托真实世界新生儿筛查流程开展,兼具临床试验和真实世界研究的要素。研究不另行设置入组标准,入组的受试者即为研究期间密苏里州所有接受筛查的新生儿,目标人群的代表性强。研究对筛查阳性的受试者进行了干预,这部分新生儿样本将被送去第三方实验室做确认检测,并按照确认检测结果判定临床结局。对于筛查阴性的新生儿,研究则利用MDHSS 的公共卫生监测数据来关联到临床结局。
研究同时融合了真实世界应用的场景和条件,加入复测过程、剔除离群值和风险评估等步骤,立体地构建了考核产品的评价体系,全面地评价了考核产品的临床性能、预测价值和鲁棒性。
3.3 公共数据库用于遗传病辅助诊断及携带者筛查产品的有效性评价
FDA 于2013年批准了Illumina MiSeqDx Cystic Fibrosis Clinical Sequencing Assay(K132750)[14]和Illumina MiSeqDx Cystic Fibrosis 139-Variant Assay(K124006)[15]上市。产品采用外周血样本,检测囊性纤维化跨膜转导调节因子(cystic fibrosis transmembrane conductance regulator,CFTR) 基因变异,K132750 用于囊性纤维化(cystic fibrosis,CF) 的辅助诊断,K124006 用于育龄成人的携带者筛查、新生儿和儿童的确诊性检测、疑似囊性纤维化患者的初步检测辅助诊断[14-15]。根据《罕见病诊疗指南(2019年版)》:囊性纤维化新生儿发病率1/25 000~1/1800;CFTR 基因是目前已知唯一的囊性纤维化致病基因,基因突变导致蛋白功能减少或缺失,所在的上皮细胞分泌氯离子和水减少,造成上皮细胞内高渗环境,引起多系统疾病;目前已发现超过 2000 种CFTR基因突变[12]。发病率低、突变位点多的特点,导致临床试验的开展异常困难。
两款FDA 批准的囊性纤维化检测产品,并未开展临床有效性验证试验。CFTR2 公共数据库为变异致病性确定的有效科学证据来源,根据数据库计算的临床灵敏度和特异度,是FDA 批准上市的唯一临床有效性证据[10]。CFTR2 研究者收集了北美和欧洲的39 696 名囊性纤维化患者的基因型和表型数据,筛选出159个等位基因频率≥0.01%的突变患者,结合临床表型(汗液氯离子浓度高)和基因功能分析(影响蛋白表达或者功能),确定了127 个明确致病位点。之前研究已发现的23 个明确致病位点,在此研究中也全部重现,侧面证明了研究方法的准确性,104 个位点为新发现致病位点。灵敏度分析显示,全部患者中,99.79%存在上述127 个变异。对孕龄夫妇进行携带者筛查时,23 个位点增加到127 个位点后,敏感性从72%增加到91%[16]。突变位点的致病性可以在CFTR2 公共数据库中查询,随着科学认知的发展,数据库持续更新[16]。
本案例凸显了高质量的公共数据库在罕见病、多位点检测产品临床有效性评价中的价值。但需要指出的是,FDA 要求公共数据库对于位点致病性的定义标准要公开、透明、可溯源,检测产品的结果解读需要经认证的临床分子遗传学家或同等人员解释,并应与其他可用信息(包括临床症状、其他诊断检测和家族史)一起使用[17]。两款产品均不适用于独立诊断、胎儿或胚胎植入前检测、新生儿筛查[14-15]。
3.4 数据库用于肿瘤伴随诊断及病原体耐药检测的临床结局研究
伴随诊断方向,FDA 于2014年采用附条件的方式批准了BRACAnalysis CDx 上市[18]。BRACAnalysis CDx 通过检测卵巢癌患者全血样本中的胚系BRCA1/2基因变异,并对检测到的变异进行分类,用于奥拉帕利片的相关用药指导。所有检测到的变异将按照一个申请人定义的分类标准划分到如下5 种类别,分类等级由高到低分别为1(有害/致病)、2(疑似有害/疑似致病)、3(意义不明确)、4(疑似无害/疑似良性)以及5(无害/良性)。单个样本可能检测到多个变异,而不同的变异对应的类别可能不同,此时样本的分类结果将被报告为分类等级最高的变异所对应的类别。
随着临床证据的不断变化和更新,分类标准也会随之变化、更新。当分类标准发生变化时,同一个变异可能会被划分到与之前不同的类别。作为这项批准所附加的条件之一,申请人被要求在BRACAnalysis CDx 上市后,持续地监测和评估检测到的所有变异分类,并与之前的分类进行比较,以验证变异分类的鲁棒性。由于已发现的BRCA1/2基因变异有数千种,且不存在突变热点,注册临床试验中只验证了一小部分有害或疑似有害变异的药物疗效。随着越来越多的BRCA1/2基因变异种类被发现与奥拉帕利用药相关,作为另一个附加条件,申请人被要求上市后继续评估变异分类是否与用药效果一致。
病原体检测方向,FDA 在2019年批准首个基于高通量测序技术的人类免疫缺陷病毒(human immunodeficiency virus,HIV)耐药检测试剂盒Sentosa®SQ HIV-1 Genotyping Assay上市,共检测342 个耐药位点。由于变异位点分布广泛,难以通过培养或者临床试验一一验证。除了FDA 的《HIV 耐药基因分型体外诊断试剂》指导原则列出的明确耐药变异,其他变异位点的临床有效性证据来源于斯坦福大学艾滋病毒耐药数据库(Stanford HIV drug resistance database)v8.5 版[19]。此公开数据库精心设计,用于描述、存储和分析HIV耐药性数据,包括基因型和表型、治疗及临床结局相关性查询[20]。
上述案例表明在肿瘤伴随诊断、病原体耐药检测领域,高质量的数据库在高通量测序检测试剂的临床有效性验证中,是重要的有效性证据来源。
4 体外诊断试剂真实世界研究的应用
综合前述体外诊断试剂的临床评价特点和相关审批案例,可以发现真实世界研究在体外诊断试剂评价的多个场景下都可能带来巨大的价值,包括但不限于如临床结局研究等执行困难的情形、加快罕见病上市、临床上需要随访以确定疾病状态、临床有效性证据更新较快的情形等。结合我国法规要求和真实世界研究在体外诊断试剂领域的发展程度,应注意开展真实世界研究用于支持监管决策必须以合法合规为前提,重点关注数据的相关性和可靠性,严格进行质量控制,制定好研究方案和数据采集计划,保障数据的真实性和完整性,并主要探索其作为临床试验的补充证据的价值。下面以几种情况为例对真实世界研究在体外诊断试剂监管中的潜在应用进行探讨。
4.1 罕见病诊断试剂的临床评价
罕见病由于发病率极低,相关产品临床试验过程中难以获得足够的病例数量,临床试验存在困难,生产企业对该类产品的研发、生产和注册申报缺乏积极性[21]。2018年,NMPA 发布了《国家药品监督管理局关于发布用于罕见病防治医疗器械注册审查指导原则的通告》[22],以患者受益为中心,科学解决用于罕见病防治医疗器械的临床评价难点,合理减免临床,以附带条件批准方式促进该类产品尽快用于临床,使罕见病患者受益。真实世界数据对于罕见病的上市前评价,以及附条件批准的上市后研究,都可以发挥作用。前述SCID 的案例展示了从生物样本库或大型专科医院、相关研究机构获得罕见病阳性病例样本,可以更充分地评价产品的检测性能。
4.2 疾病辅助诊断试剂的预期用途增项研究
某已获批体外诊断试剂产品,其批准预期用途为针对某疾病疑似人群的辅助诊断。在临床常规实践中,该产品检测为阳性的人群,需转诊临床参考标准进行确认,确认为该病的患者将接受治疗,排除的患者则后续进行随访。该产品检测为阴性的人群不经转诊,进入随访流程,见图1。
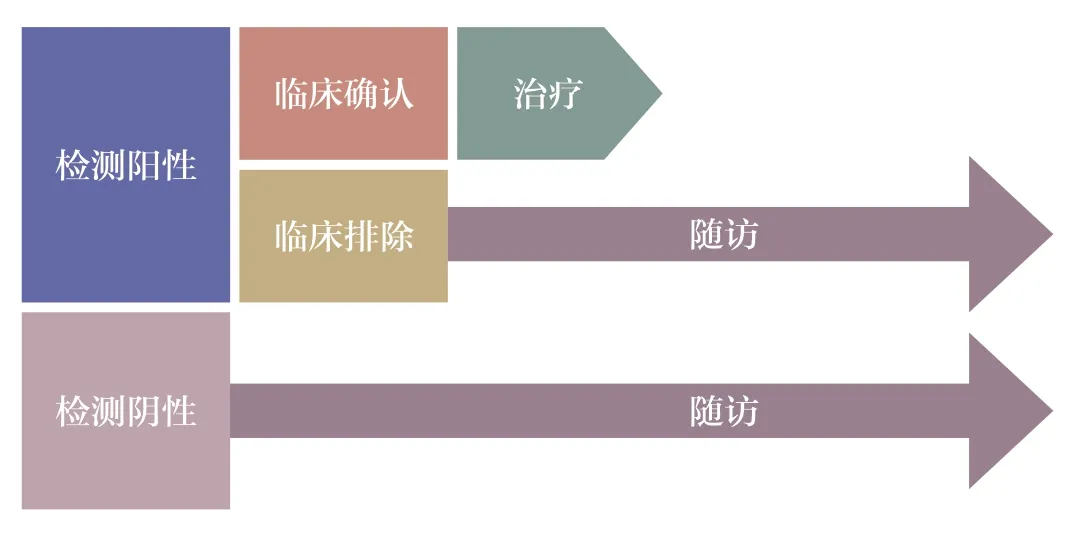
图1 某已获批辅助诊断试剂产品临床常规实践示例
如上述疾病辅助诊断试剂变更增项预期用途为风险评估和(或)预后的适用人群,可利用上述真实随访数据,对风险评估和预后的适用人群进行临床评价。他们都是在基线时没有该疾病的患者(检测阴性组可通过该产品辅助诊断用途的临床试验中的特异度指标,计算得到其中真正没有该疾病的人数),经过随访一段时间,通过比较基线时检测结果阳性但是没有该疾病的人群和基线时检测结果为阴性的人群在最终发病率上的差异,从而评价该产品用于风险评估/疾病预后的有效性[9]。
4.3 深度学习诊断模型的性能补充研究
随着深度学习在诊断领域的发展和应用,基于多个指标联合检测的算法显现出更优的临床性能,也成为产品开发的热点。例如,临床上经常同时进行多个标志物的检测,以确认一种疾病的状态。为了评估胃癌的风险,可能同时检测胃蛋白酶原、胃泌素17 和幽门螺杆菌抗体等指标;为了诊断卵巢癌,可能同时检测糖类抗原CA125 和人附睾蛋白4。在这类产品的开发上,如果产品包含的各单项指标都是临床常用的指标,在满足算法训练方案设计要求的前提下,探索部分研究可以采用真实世界数据进行算法的训练和临床验证。申办者可以选择若干家已开展相关指标检测的临床单位,收集一定符合要求的病例数的各指标检测结果用于不同数据集,对诊断模型进行补充验证。
4.4 病原宏基因组高通量测序等复杂新技术产品的评价应用探索
近年来,随着生物检测技术的不断创新以及个体化医疗和精准医疗的临床需求逐渐增加,生物医药行业的新技术、新成果从研发向临床应用快速转化落地需求迫切。如病原宏基因组高通量测序检测试剂,可检测并分析不同临床来源样本中细菌、真菌、病毒、寄生虫等已知及未知的病原体,特别是未知新发病原体,对不明原因发热、重症监护病房(intensive care unit,ICU) 的急危重症患者等具有显著临床意义。但宏基因组高通量测序检测试剂由于其可检测病原体数量较多,难以找到全部真实临床样本进行分析性能及临床评价。借鉴FDA 应用真实世界证据审评经验,对复杂的新技术新产品,探索采用真实临床样本加数据库联合进行临床前研究;在临床研究方面,探索采用注册临床试验加真实世界数据验证方式进行临床研究综合评价。
5 结语
真实世界研究包括了资料、方法和使用,即真实世界数据的治理和规范、真实世界研究的设计和实施、真实世界证据的要求和应用。本文主要探讨了体外诊断试剂的一些应用可能性和基本路径,但就真实世界研究在体外诊断领域的落地和发展而言,仍然脱离不了基础建设和方法提升。真实世界研究的根本是真实世界数据。就体外诊断试剂而言,可提供有价值数据的来源广泛,如医院信息系统数据、登记研究数据、组学数据等。如何解决这些数据的互联互通、共建共享,如何保证这些数据的正确使用、全面评价,是决定真实世界研究长远发展的基础问题。真实世界研究的设计、对偏倚的预判和控制、统计学方法的应用,乃至于与监管机构的事先沟通,都是决定研究能否产生有效科学证据的关键因素。
体外诊断试剂的临床评价有自身的特点和需求,把握这些需求有助于更好地应用真实世界数据,产生真实世界证据。与此同时,真实世界研究也有本身的规律,利用好这些规律可以更快地推动体外诊断试剂真实世界研究的发展,转化为监管决策的依据,并最终让体外诊断行业、监管机构、临床机构和患者都从中受益。
