甲醇蒸汽重整制氢催化剂的研究进展(上)
2022-03-03周文强程载哲蓝国钧
周文强,程载哲,蓝国钧,李 瑛
(浙江工业大学 工业催化研究所,浙江 杭州 310014)
为了缓解对石油、天然气等日益枯竭的化石能源的依赖,减少化石燃料燃烧带来的环境污染和温室效应等问题,大力开发清洁可再生能源已成为大多数国家的战略选择。氢能作为清洁高效的新型能源,在2019年首次列入政府工作报告中,在新能源领域具有广阔的前景。针对目前氢能商业化过程中存在的氢气存储和运输等问题,采用甲醇重整制氢是一条切实可行的产氢路径[1-2]。以甲醇作为氢能载体主要有以下优势:1)甲醇来源广泛且价格低廉,除传统的煤制甲醇外,还可通过工业废气中二氧化碳加氢生成,减少碳排放;2)易于储存和运输,能够在现有加油站系统的基础上完成甲醇的运输、储存和加注等过程;3)具有较高的氢/碳比,不含碳碳键,保证在较宽的温度范围内提供足够的产氢能力[3-4]。
甲醇重整制氢途径主要有甲醇蒸汽重整、甲醇部分氧化重整和甲醇自热重整三种。甲醇蒸汽重整反应条件温和,制得的重整气中氢气含量高,副产物少,在工业上有成熟的应用[5-6]。除主反应甲醇蒸汽重整反应外,还存在甲醇分解和逆水汽变换两个副反应。
催化剂是甲醇蒸汽重整技术的关键,目前用于甲醇蒸汽重整制氢的催化剂主要有两类:一类是非贵金属催化剂,主要包括Cu基催化剂(如CuO/ZnO/Al2O3等)和非Cu基催化剂(如Zn-Cr、Ni系等);另一类是贵金属催化剂,如Pd基催化剂。与贵金属催化剂相比,Cu基催化剂的低温重整活性较好,在温和条件下可高选择性地生成氢气和二氧化碳,因此广泛用于甲醇蒸汽重整制氢,但由于金属Cu的塔曼温度较低,催化剂存在稳定性差等问题。
本文综述了近几年国内外甲醇蒸汽重整制氢催化剂的研究进展,分别归纳总结了不同催化剂体系的制备方法、助剂和载体等对甲醇蒸汽重整制氢性能的影响,介绍了不同催化剂的活性位点、失活原因以及甲醇蒸汽重整反应机理,并对甲醇蒸汽重整制氢催化剂未来的应用和发展方向做出了评述和展望。
1 Cu基催化剂
Cu是为数不多的对水解离和甲醇等碳一物种活化都具有催化活性的金属,因此Cu基催化剂是最常用的甲醇蒸汽重整制氢催化剂。与贵金属催化剂相比,Cu基催化剂具有成本低、低温活性高、副产物CO选择性低等优势,但它的热稳定性较差、易烧结失活[7]。为了进一步提升催化剂的活性和稳定性,研究者主要采用改进制备方法、添加助剂和选择合适的载体等方法对催化剂进行改进[8]。
1.1 制备方法对Cu基催化剂性能的影响
催化剂制备方法影响催化剂的表面结构、组分间的相互作用等,从而最终影响催化剂的催化性能。沉淀法是制备Cu基催化剂最常用的方法,通过金属盐溶液和碱液(NaOH、Na2CO3等)共同沉淀来合成催化剂前体。除沉淀法外,浸渍法和固相研磨法等制备方法同样十分重要。
1.1.1 共沉淀法
沉淀过程中涉及的影响因素主要有沉淀温度、pH等。降低沉淀温度,溶液过饱和度增大,有利于晶核的生成,得到的催化剂晶粒较小,有助于提高Cu的分散度。升高沉淀温度,会使过饱和度下降,有利于晶体生长,但不利于晶核的生成[9]。房德仁等[10-11]研究了沉淀温度对Cu/ZnO/Al2O3催化剂前体性质的影响,认为沉淀温度主要影响前体中(Cu,Zn)2CO3(OH)2、(Zn,Cu)5(CO3)2(OH)6相的转变速率及Cu2+、Zn2+的同晶取代速率,升高沉淀温度有利于焙烧后CuO-ZnO固溶体的形成。当沉淀温度为80 ℃时,催化剂中Cu的晶粒尺寸最小、分散程度最高。溶液的pH可能通过影响前体的晶粒大小和原子排列来影响催化剂的比表面积和孔结构。Behrens等[12]研究发现,Cu2+在pH为3时开始沉淀,Zn2+和Al3+在pH约为5时开始沉淀,因而溶液pH不应低于5,以确保Zn2+和Al3+完全沉淀。另一方面,沉淀pH应保持在9以下,否则碱性铜锌沉淀物种将被分解氧化为CuO。Li等[13]认为,pH维持在7.0、温度为70 ℃时,能得到理想的前体和高活性的催化剂。
Ahmadi等[14]采用超声共沉淀法制备了CuO/ZnO/ZrO2/Al2O3催化剂,对老化前的前体沉淀物进行了超声处理,与未超声处理得到的催化剂相比,CuO晶粒尺寸变小、Cu分散度有所提高。Zhou等[15]通过分馏沉淀法制备了Cu/ZrO2催化剂,与共沉淀法制备的催化剂相比,该催化剂具有更高的Cu比表面积、更多的Cu+物种、更好的催化活性和稳定性。此外,表面活性剂辅助共沉淀同样可以提高催化剂性能,在CuO-ZnO-ZrO2催化剂制备过程中加入表面活性剂十六烷基三甲基溴化铵能够改善Cu与ZnO、ZrO2之间的相互作用,提高Cu与ZnO、ZrO2的界面接触面积,从而增加Cu-ZnOx和Cu-ZrOx物种的数量[16]。等离子体辅助共沉淀法也被用于制备CuO/ZnO/Al2O3催化剂,并取得了不错的效果[17]。
1.1.2 浸渍法
Mohtashami等[18]采用乙酸改性浸渍法制备了铜锌锆浸渍的MCM-41催化剂。与常规浸渍法相比,改性浸渍法对MCM-41进行了修饰,在表面形成了更多的含氧官能团,可以防止金属颗粒聚集,改善金属的分散,提高了CuO颗粒的还原性。在同一评价条件下,改性浸渍法制备的催化剂具有最佳的催化性能,甲醇转化率为97.8%、H2选择性为99.0%、CO选择性仅为0.4%。Danwittayakul等[19]以氧化锌纳米棒为载体浸渍硝酸铜溶液,并在浸渍过程中添加尿素。尿素水解逐渐生成氢氧根离子,使得溶液中的Cu2+与氧化锌纳米棒提供的Zn2+均匀沉淀,改善了Cu在氧化锌纳米棒上的分散,提高了催化剂的甲醇蒸汽重整活性,同时与商业催化剂Cu/ZnO/Al2O3相比,降低了反应活化能。
1.1.3 固相研磨法
与湿化学法相比,固相研磨法无需溶剂,避免了废液的排放且制备过程简单,在制备多相催化剂方面应用前景广阔。Wang等[20]将硝酸铜、硝酸锌和草酸混合后进行研磨,得到的草酸盐前体在空气气氛下热分解制得CuO/ZnO催化剂,该催化剂具有更高的Cu分散度和更强的铜锌相互作用。在240 ℃下反应,固相研磨法制得的CuO/ZnO催化剂相比共沉淀法制备的催化剂,甲醇转化率由48.6%提高到70.9%。Li等[21]对草酸盐前体的焙烧气氛(N2和空气)进行了考察,发现在N2气氛中焙烧,草酸盐前体分解为CuO和ZnO,同时释放出大量的CO将CuO原位还原为Cu;前体的分解和CuO的还原同时发生,抑制了活性Cu0物种的生长和催化剂颗粒的聚集,该结果得到了Lu等[22]的证实。
1.1.4 其他制备方法
除Cu的比表面积外,催化剂表面合适的Cu0/Cu+比同样对提高催化活性十分重要,部分研究者通过合适的催化剂制备方法合理调变Cu物种不同价态的比例以提高催化剂的性能。Ge等[23]利用模板辅助的原子层沉积法制得TiO2纳米管限域的Cu团簇(如图1所示),之后通过还原和再氧化的方式来获得Cu+物种,通过控制Cu沉积的循环数调控Cu+物种的比例。此外,采用蒸氨法合成Cu/SiO2催化剂时,利用硅胶中羟基与铜氨络合物的离子交换,可以增强金属与载体之间的相互作用,调变Cu+/(Cu0+Cu+)比例,进而提高催化剂的性能[24-25]。

图1 Cu/TiO2催化剂合成示意图(m为Cu的ALD循环数)[23] Fig.1 Schematic illustration of the synthesis of Cu/TiO2 catalyst(m is the ALD cycle numbers of Cu)[23]. CNF:carbon nanofiber;ALD:atomic layer deposition.
表1总结了不同制备方法对Cu基催化剂甲醇蒸汽重整制氢性能的影响。
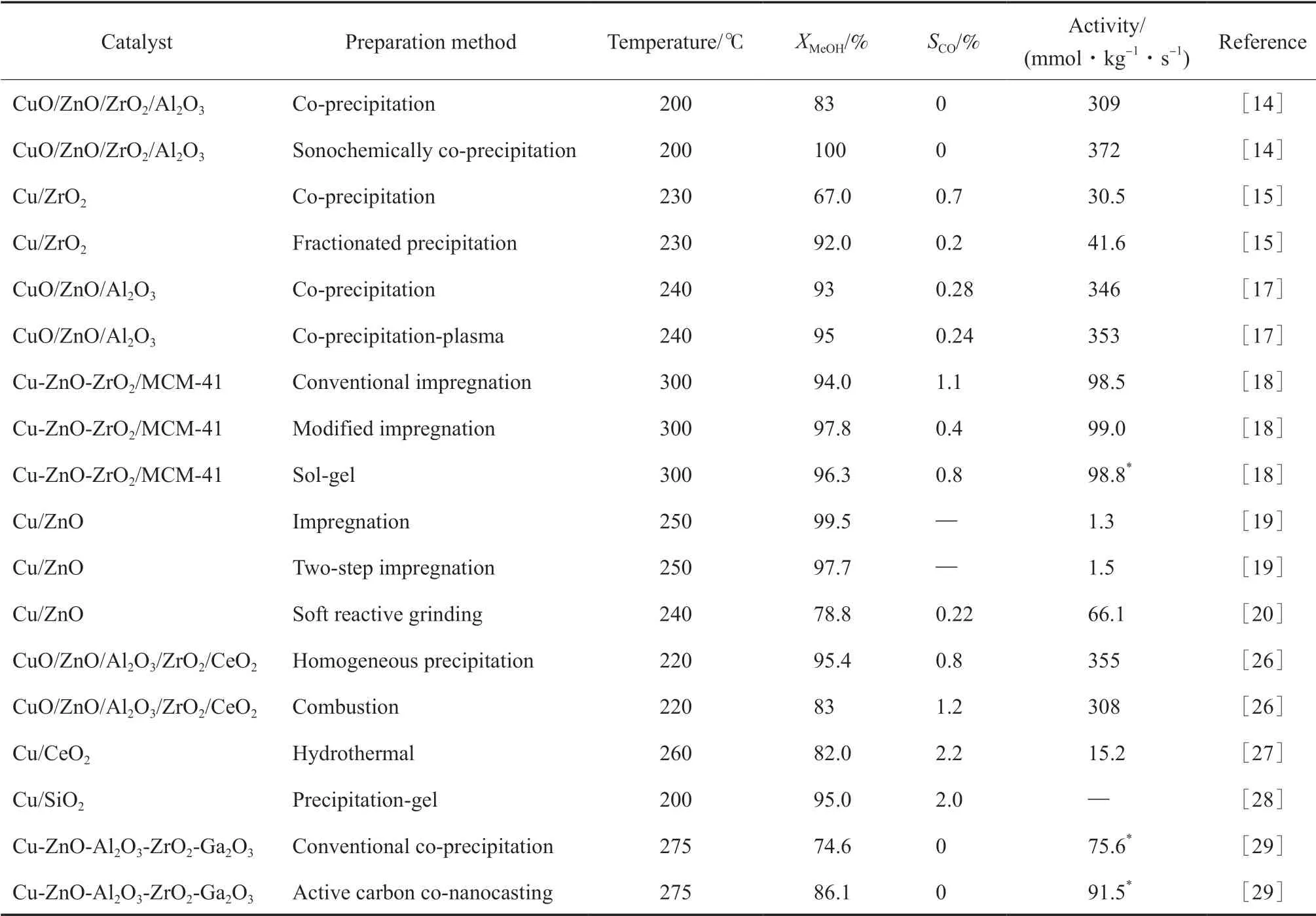
表1 制备方法对Cu基催化剂甲醇蒸汽重整性能的影响Table 1 Influence of the preparation method on the performance of different Cu-based catalysts for methanol steam reforming
1.2 助剂对Cu基催化剂性能的影响
助剂的添加可以增强金属与载体间的相互作用,进而提高催化剂的活性和稳定性[30-31]。Cu基催化剂中常见的助剂有ZnO,Ga2O3,ZrO2,Y2O3,La2O3,Fe2O3等。
1.2.1 ZnO助剂
ZnO是Cu基催化剂常用的助剂,ZnO的加入不仅可以促进Cu的分散,也可以通过铜锌协同作用显著提高Cu基催化剂活性。但目前铜锌相互作用的机理尚不明确,研究者们提出了以下几种可能的理论模型:氢溢流模型[32]、金属-氧化物界面模型[33]和CuZn合金模型[34-36]。其中,氢溢流模型认为铜锌协同作用与Cu/ZnO体系中Cu与ZnO的双向溢流有关。ZnO能够捕获最初在Cu表面产生的氢原子,并作为储氢器,促进了氢在催化体系中的溢出。而CuZn合金模型认为溢流效应是存在的,但并不是ZnO起主要作用,ZnO在体系中主要作为隔离物分离Cu颗粒,催化剂中形成的Cu-Zn或Cu-O-Zn表面合金才是铜锌相互作用的原因。
1.2.2 Ga2O3助剂
Ga2O3助剂掺杂的Cu基催化剂在低于473 K的温度下表现出优异的活性、稳定性和选择性[37-40]。Yu等[37]采用共沉淀法合成了混合氧化物CuZnGaOx,在150 ℃下可以催化重整制氢反应,产氢量为63.3 mmol/(kg·s)。Ga2O3的掺杂促进了ZnGa2O4尖晶石的形成,并在缺陷ZnGa2O4尖晶石氧化物表面形成更多小尺度、高度分散的Cu团簇,促进了Cu物种的稳定和分散[38]。与工业催化剂CuO/ZnO/Al2O3相比,CuO/ZnO/Ga2O3催化剂的甲醇转化率约为工业催化剂的2.2倍,在连续工作80 h后甲醇转化率仍为工业催化剂的1.7倍[39]。对于CuO/CeO2催化剂,Ga2O3的添加使Cu的晶粒尺寸变小,并在CeO2表面上高度分散,进而提高了甲醇转化率[40]。
1.2.3 ZrO2助剂
在Cu基催化剂中添加ZrO2助剂,可以增加Cu的分散度,改善催化剂的氧化还原能力,进一步增强催化性能和稳定性。Jeong等[41]比较了Cu/ZnO/Al2O3和Cu/ZnO/ZrO2/Al2O3催化剂的性能,发现ZrO2的掺杂能够提高甲醇转化率,降低CO选择性,表征结果显示ZrO2的掺杂提高了Cu的分散度。Sanches等[42]发现在CuO/ZnO催化剂中添加Zr助剂抑制了CuO和ZnO晶粒的长大,促使CuO和ZnO晶格产生微应变,该作用促进了易还原CuO物种的形成,有利于提高Cu基催化剂的催化性能。另外,CuO/ZnO/ZrO2催化剂中存在的单斜相ZrO2对CO的吸附能力较强,较大程度地抑制了副产物CO的生成。
1.2.4 其他助剂
助剂Y2O3的引入能够稳定Cu物种,提高Cu的比表面积,使催化剂表现出良好的活性和稳定性[43]。Khani等[44]研究了Zn和La对Cu/γ-Al2O3催化剂的影响,发现在较高温度下Zn对催化活性有不利影响,在较低温度下有积极影响;La在较高温度下对甲醇转化率和CO2选择性的提高有促进作用。Sharma等[45]以Al2O3-Zn-ZrO2为载体,制备了Cu-Fe/Al2O3-Zn-ZrO2双金属催化剂,研究了助剂Fe在催化剂中的作用(如图2所示)。由于Fe与Cu有着相似的原子尺寸和较小的电负性差异,两者形成了CuFe合金,从而降低了金属颗粒尺寸,提高了催化活性。XRD表征结果显示存在CuFe2O4尖晶石物相,合金和尖晶石结构的存在有利于提高催化剂活性和CO2选择性。Zhang等[46]将碳纳米管(CNT)分散在Na2CO3溶液中,与金属盐共沉淀制备了CNT掺杂的Cu/Zn/Al/Zr催化剂。由于CNT的高导热性,催化剂的热导率由0.4 W/(m·K)提高到20 W/(m·K),有利于消除反应中的热点,提高催化剂的稳定性。
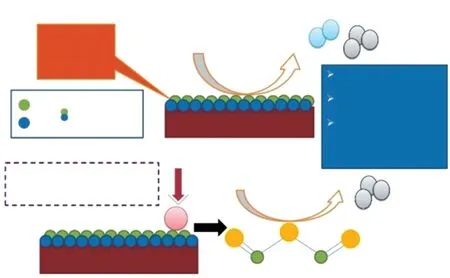
图2 Cu-Fe/Al2O3-Zn-ZrO2双金属催化剂上的反应机理[45]Fig.2 Reaction mechanism on the Cu-Fe/Al2O3-Zn-ZrO2 bimetallic catalyst[45].
1.3 载体对Cu基催化剂性能的影响
选择合适的载体可以增强Cu与载体的相互作用,提高Cu在载体表面的分散程度,从而提高催化剂的活性,并延长催化剂的使用寿命。
1.3.1 氧化物载体
以工业催化剂CuO/ZnO/Al2O3为例,Al2O3作为载体时有利于提高Cu的分散度、总比表面积和催化剂的机械强度。ZrO2由于具有优良的热稳定性和多种表面性质常作为金属催化剂的载体[47],在甲醇蒸汽重整制氢反应中,ZrO2表面被部分羟基化和完全氧化,形成亚单层的ZrOxHy物种[47-49],ZrOxHy物种覆盖层与Cu之间会产生特殊的相界面,促进了水的活化以及中间产物甲醛的完全氧化,最终提高CO2选择性。Witoon等[50]研究ZrO2载体三种晶型的影响作用时发现,与立方晶型和四方晶型相比,单斜晶型ZrO2表面羟基的浓度最大,有利于提高Cu的分散度,提高催化剂的活性。
1.3.2 非氧化物载体
CNT、分子筛等材料也被用作Cu基催化剂的载体[51-52]。Yang等[53]以CNT为载体制备了Cu/ZnO-CNT催化剂,通过浓酸对CNT的预处理构造表面缺陷,并添加乙醇改善了CNT的亲水性,促进了制备过程中金属颗粒的均匀分散。Cu/ZnO-CNT催化剂在反应温度为320 ℃、水醇比为1.5时,氢气产量达到426.7 mmol/(kg·s)。Deshmane等[54]将Cu浸渍在高比表面积的有序介孔材料MCM-41上制得Cu/MCM-41催化剂,该催化剂表现出很强的抗烧结能力,这归因于Cu纳米颗粒在高比表面积MCM-41载体中的均匀分布和孔道的限域作用抑制了Cu颗粒的团聚。表2总结了助剂和载体类型对Cu基催化剂甲醇蒸汽重整性能的影响。
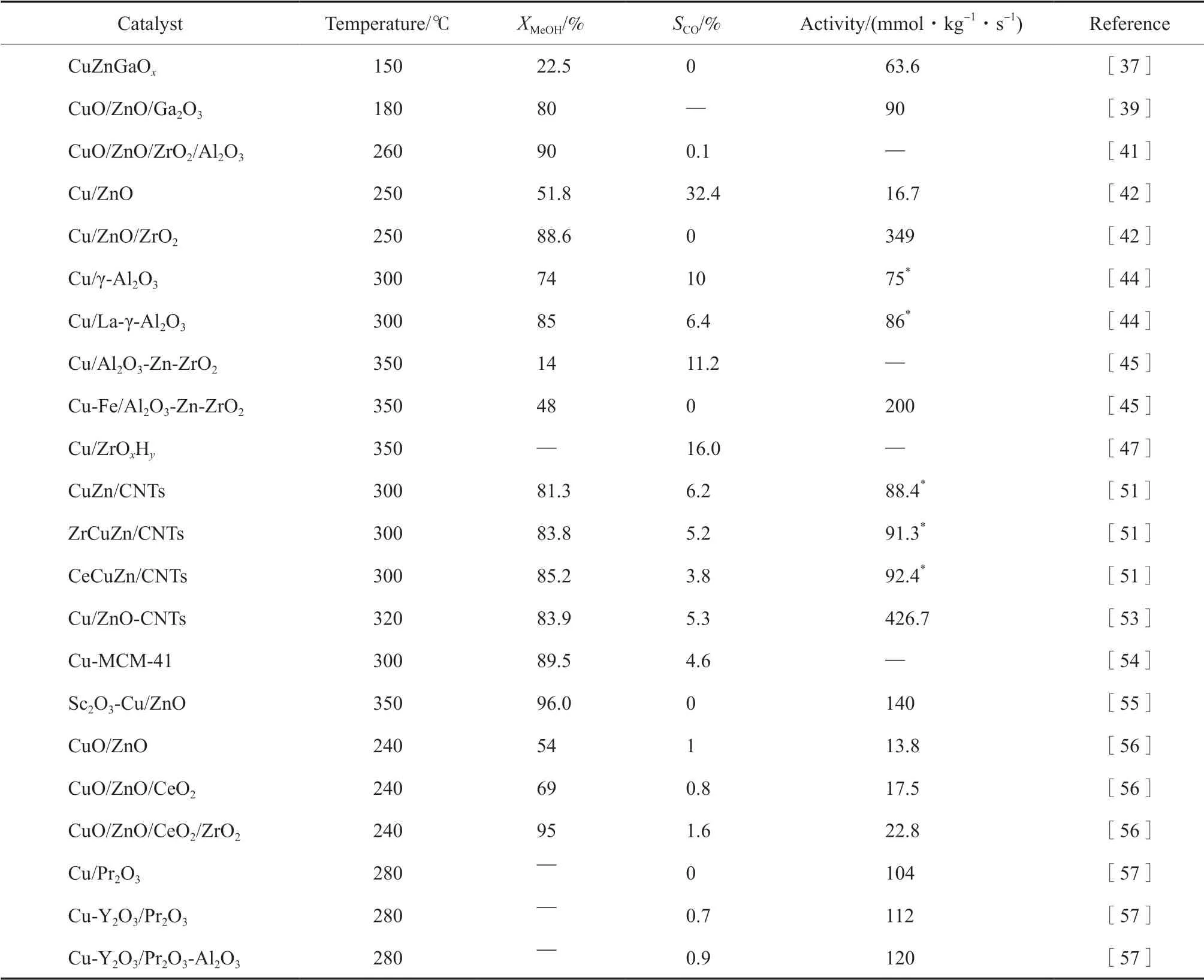
表2 助剂和载体类型对Cu基催化剂甲醇蒸汽重整性能的影响Table 2 Influence of the type of promoter and support on the performance of different Cu-based catalysts for methanol steam reforming
1.4 Cu基催化剂上甲醇蒸汽重整反应机理
对于Cu基催化剂催化甲醇蒸汽重整反应的机理研究很多,早期认为甲醇先分解产生CO,然后通过水汽变换反应生成CO2,具体反应机理见式(1)和式(2)。

因此,产物中CO浓度应高于根据热力学平衡计算的重整气中CO的浓度,然而实验中测得的CO浓度远小于理论值[58-59]。李言浩等[60]利用原位红外光谱对反应机理进行了研究,发现反应过程中CO2并非在CO之后产生。随着对反应机理的研究逐渐深入,研究者提出了另外一种机理[61],认为甲醇和蒸汽首先生成CO2和H2,然后部分CO2和H2通过逆水汽变换反应生成CO,见式(3)和式(4):
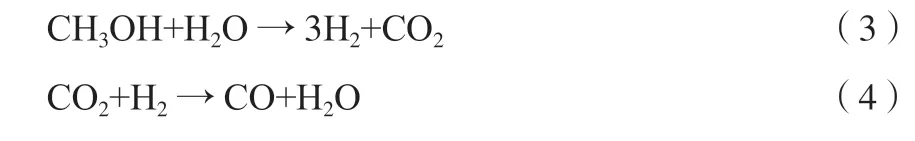
此外,Takahashi等[62]认为甲醇蒸汽重整反应中甲醇先解离生成甲酸甲酯,甲酸甲酯再水解生成甲酸,甲酸分解生成CO2和H2,反应式如式(5)~(7)所示。
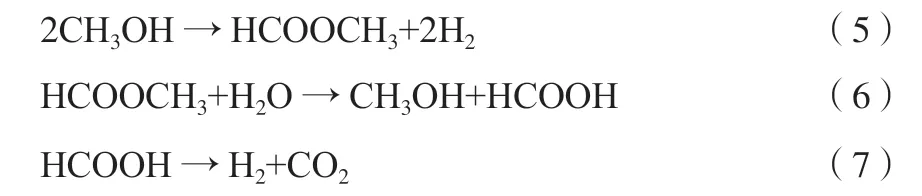
CO则是由CO2和H2发生逆水汽变换反应生成,此机理也较好地解释了实验中重整气CO浓度较低的现象。
对于Cu基催化剂的活性中心,研究者们[5,63]普遍认为Cu0的存在必不可少,但对于Cu+所起的作用存在争议。一些研究人员认为Cu+在抑制逆水汽变换方面具有积极作用[64-66],Matsumura等[65]指出反应过程中Cu表面部分氧化生成Cu+,Cu+的存在可以通过抑制逆水煤气变换反应减少CO的生成。另外,有研究人员认为Cu+能直接催化甲醇蒸汽重整,并推测Cu0与Cu+之间存在协同作用[25,67-69]。Idem等[67]认为Cu+有利于断裂醇类的O—H键,促进甲醇的裂解,Cu0起到断裂C—H键的作用,两者共同构成了活性中心。当Cu+/(Cu++Cu0)的比例为0.5时,催化剂具有最高的活性和最低的CO选择性[69-70]。Ma等[25]设计和制备了Cu0和Cu+活性位点可控的Cu/SiO2催化剂体系,通过调节Cu0/Cu+的比例,确定了两者协同的反应机理(如图3所示)。其中,Cu0位点负责氢原子的转移和解吸,Cu+则有助于吸附氧化物中间体。催化循环从甲醇的解离吸附开始,甲氧基脱氢生成甲醛,表面羟基进攻甲醛形成二氧亚甲基作为反应中间体,然后脱氢生成甲酸基团,最终脱氢生成CO2。脱氢产生的所有氢原子由于反向溢流通过载体迁移到Cu0附近,最后以气态H2的形式脱附。

图3 二甲醚蒸汽重整反应在Cu催化剂双活性位点上的反应机理[25]Fig.3 Reaction mechanism of dimethyl ether steam reforming on the dual-sites of copper catalyst[25].
1.5 Cu基催化剂的失活原因
Cu基催化剂失活的原因主要有烧结、积碳、中毒等,其中,烧结是甲醇蒸汽重整反应中导致Cu基催化剂失活的主要原因。Hughes[71]总结了部分金属的热稳定性顺序:Ag<Cu<Au<Pd<Fe<Ni<Co<Pt<Rh<Ru<Ir<Os<Re。由此看出,Cu基催化剂相比其他甲醇制氢催化剂(Ni、Pd)更容易受温度的影响。金属Cu的塔曼温度较低(407 ℃),高温下Cu晶格易发生原子迁移,使晶粒聚集从而导致烧结。虽然加入ZnO,Al2O3,ZrO2等助剂可以提高催化剂的热稳定性,但Cu基催化剂的使用温度一般低于300 ℃。
催化剂的中毒主要与硫化物、氯化物有关。硫化物会与金属Cu生成Cu2S,覆盖催化剂的活性中心,进而导致催化剂的失活。具体表现为在室温环境下,催化剂中的氧原子会与Cu(110)晶面发生反应,引起表面异构,从而形成稳定的-O-Cu-O-Cu-O-链[72]。但当环境中存在硫化物时,硫原子会取代链中的氧原子,破坏Cu基催化剂表面稳定的结构,且由于反应活化能(<18 kJ/mol)和反应温度(105~173 K)均低,该反应几乎自发进行[73]。而氯化物中毒导致Cu基催化剂失活,根据文献可分为以下四种机理[74]:1)反应生成可以阻塞或改变活性位的Cl原子;2)反应生成熔点低、高迁移性的CuCl,加速Cu基催化剂的烧结;3)微量CuCl会加剧催化剂的硫中毒进程;4)与ZnO反应生成ZnCl2,使Cu失去ZnO的保护作用,加快了失活过程。
当水醇比较低或反应温度较高时,甲醇蒸汽重整中Cu基催化剂容易发生副反应生成积碳导致失活。积碳一方面来源于反应过程中形成的碳氢化合物,另一方面由CO通过Boydouard反应转化为单质碳[75],这些积碳会堵塞催化剂的孔隙及覆盖催化剂表面活性物种从而降低催化剂的甲醇蒸汽重整制氢性能[76]。Agarwal等[77]对Cu/ZnO/Al2O3催化剂在甲醇蒸汽重整制氢中的积碳行为进行了研究,发现失活催化剂表面存在石墨碳和碳氢化合物两种积碳物种,在将催化剂的积碳量与催化剂活性关联后,发现催化剂失活速率与积碳层数有关,但主要受单层积碳控制。Thattarathody等[75]的程序升温氧化结果也显示失活催化剂上存在两种碳物种,燃烧温度为260 ℃和400 ℃的积碳为碳氢化合物,燃烧温度为700 ℃的积碳为催化剂表面上的石墨碳。为了提高催化剂的性能和抑制催化剂失活,Zhang等[56]向Cu基催化剂中添加CeO2,利用CeO2的储放氧能力消除催化剂表面的积碳。
