基于网络药理学的黄芪-水蛭药对治疗肺纤维化作用机制探析△
2022-03-03贺晋芳张迪郑佳昆张沂金译涵晏军
贺晋芳,张迪,郑佳昆,张沂,金译涵,晏军
北京中医药大学 第一临床医学院,北京 100700
肺纤维化(pulmonary fibrosis,PF)是以异常的损伤修复伴成纤维细胞增殖及大量细胞外基质沉积,复杂的肺泡网络逐渐被纤维化瘢痕所取代为特征的进行性致命性疾病[1]。患者常表现为呼吸功能受损,病情进行性发展,终至呼吸功能衰竭而危及生命[2-3]。迄今为止PF 的治疗仍是一大难题,主流方法为抗炎、抗纤维化等,虽能延缓肺功能衰退速度,但效果并不理想,不能减少并发症且具有明显的不良反应。近年来中药治疗PF 的效果在基础和临床研究中均得到肯定。中医认为PF 属于“肺痹”“肺痿”范畴,医家普遍认为肺络是患病之所[4],气虚是基本病机,而血瘀是核心病理环节[5-6],正如“肺气衰便成气嗽”[7]、“人身气道,不可有壅滞。内有瘀血则阻碍气道,不得升降,是以壅而为咳”[8]之言。气虚与血瘀相互影响,血不得气则行之无力而瘀滞,气不得血则无所依附而虚耗,此两者是PF 病情进展的关键,虚瘀胶结难解,缠绵难愈,久可酿生痰浊、热毒,诸邪痹阻肺络,败坏肺脏,终致肺络脉蔓行不整,肺体失用。因此,采用益气化瘀法对本病进行干预,是阻断疾病恶化的有效措施。
黄芪,味甘,性微温,“内补,虚喘”,被誉为补气之圣药,又可“逐五脏间恶血”,补而不滞[9]。张秉成[10]谓之“(黄芪)之补……以营卫气血太和,自无瘀滞耳”;水蛭,其味咸、苦,性平,具有破血消瘀、通络消癥之效,是化瘀而无耗气之良药,张锡纯有谓:“凡破血药多伤正气,惟水蛭味咸,专入血分,于气分丝毫无损,而瘀血默消于无形”[11]。两药合用,补虚而无留邪之痹,袪瘀而无耗气之虞,在PF 的治疗中发挥着重要作用。临床研究发现,黄芪注射液可降低PF 患者血清纤维化相关因子水平,发挥一定治疗作用[12]。水蛭通络胶囊可提高PF 患者的肺功能,改善其运动耐力和生活质量[13-14]。而以水蛭和黄芪为主药的中药复方可调节转化生长因子-β1(TGF-β1)、层黏连蛋白(LN)水平,发挥抗炎和免疫调节作用,抑制PF 的恶化[15]。现代药理研究进一步表明,黄芪具有抗炎、抗氧化、扩张血管等作用[16],有效成分如黄芪多糖、黄芪甲苷、黄芪总黄酮等可调控TGF-β1、核转录因子-κB(NF-κB)、血管内皮生长因子(VEGF)/VEGF受体2(VEGFR2)等多种信号通路,参与自噬和焦亡过程,从而抑制肺纤维化[17-21]。水蛭具有抗炎、抗纤维化、抗血栓等作用[22],水蛭及其有效成分水蛭素可降低肺组织纤溶酶原抑制剂-1(PAI-1)、TGF-β1的表达和纤维蛋白的沉积,抑制PF 病情进展,该作用可能与调控炎症及凝血功能相关[23-25]。可见,以黄芪-水蛭药对治疗PF 具有重要意义,但目前尚缺乏黄芪-水蛭药对治疗PF的相关机制研究,一定程度上限制了这2 味药在PF治疗中的应用与推广。
网络药理学是融合了系统生物学、传统药理学、生物信息学、计算机技术等多学科而形成的新学科,其整体性、系统性的药理研究特点符合中药多成分、多靶点、多通路的整体作用理念[26],这为阐明黄芪-水蛭药对治疗PF 的具体机制提供了新的思路与方法。本研究应用网络药理学方法,构建黄芪-水蛭药对化学成分数据库,基于SwissTargetPrediction 数据库预测其作用靶点,通过与GeneCards、TTD 等数据库中与抗PF 相关的靶点对比,筛选黄芪、水蛭抗PF的有效成分及相关靶点,通过蛋白质-蛋白质相互作用(PPI)挖掘、基因本体(GO)分析和京都基因与基因组百科全书(KEGG)通路分析等生物信息学分析及网络分析,全面、深入、系统地分析黄芪-水蛭药对抗纤维化的有效成分及作用机制,为后续研究提供参考。
1 资料与方法
1.1 主要化学成分的收集与筛选
应用中药系统药理学数据库与分析平台(TCMSP,https://tcmspw.com/tcmsp.php)[27-28],根据化合物药动学参数中口服生物利用度(OB)≥30%、类药性(DL)≥0.18 的标准[29]收集黄芪的主要化学成分,将其结构保存为.sdf 格式文件;通过文献检索收集水蛭的化学成分,借助PubChem数据库(https://pubchem.Ncbi.Nlm.Nih.gov/)获取相关成分的化学结构,针对PubChem 平台未收录的成分,采用ChemDraw 软件绘制,所有化学结构文件均保存为.sdf格式,将水蛭化学成分的.sdf格式结构文件上传至SwissADME 数据库(http://www.swissadme.ch/)进行成分筛选,条件如下:GI absorption 为High,Druglikeness(Lipinski、Ghose、Veber、Egan、Muegge)5 种规则中符合2 项,表明此化学成分具有较高的口服利用度和类药性。
1.2 药物作用靶点的筛选
通过SwissTargetPrediction 数据库(http://www.Swisstargetprediction.ch/)预测候选化学成分的潜在靶点,将黄芪、水蛭化学成分结构的.sdf 格式文件上传至该平台进行靶标预测,物种选择“Homo Sapiens”。
1.3 黄芪-水蛭药对治疗PF的靶点搜集
通过检索GeneCards 数据库(https://www.genecards.org./)、TTD 数据库(http://db.idrblab.net/)、OMIM 数据库(http://www.omim.org/)和DrugBank 数据库(https://www.drugbank.ca/)获取PF 相关靶基因,检索词为“Pulmonary fibrosis”。将4 个数据库的基因整合,去除重复项得到PF 相关靶基因。利用Venny 2.1(https://bioinfogp.cnb.csic.es/tools/venny/index.html),将PF 靶基因与药物作用靶基因映射筛选,最终获得的交集基因即为黄芪-水蛭药对治疗PF的潜在靶基因,绘制韦恩图。
1.4 网络的构建与分析
1.4.1成分靶点网络的构建 采用可视化Cytoscape 3.7.2 软件构建黄芪-水蛭药对治疗PF 的活性成分-靶点网络。在该网络中,化合物和靶点由节点(node)表示,化合物-靶点的相互作用由边(edge)表示。采用“Network analyzer”功能分析网络的拓扑属性,依据度(degree)值调节节点大小,度值越大节点越大。同时利用度值、介度(betweenness centrality)及紧密度(closeness centrality)3 个重要的网络拓扑特征值,分析黄芪-水蛭药对治疗PF 的主要活性成分。
1.4.2PPI 网络的构建 在STRING 11.0 数据库[30](https://string-db.org/)构建PPI 网络,物种设为“Homo Sapiens”,最低相互作用阈值设为中等置信度“Medium confidence”0.4,其余参数保持默认设置,去除单个游离靶蛋白,将剩余结果保存成.TSV格式。将.TSV 格式的文件导入Cytoscape 3.7.2 软件,对网络进行拓扑属性分析,依据其节点度值大小调节节点的大小和颜色深浅,获得PPI 网络图,并以度值≥2 倍中位数为条件筛选PPI 网络中的核心靶蛋白。
1.5 基因功能和通路富集分析
将黄芪-水蛭药对治疗PF 的潜在靶点导入DAVID 数据库(https://david.ncifcrf.gov/),选 择Functional Annotation 功 能,设 置Select Identifier 为“OFFICIAL_GENE_SYMBOL”,List Type 和Background 为“Gene List”,进行GO 分析和KEGG通路分析,以P<0.01为条件,富集基因数由大到小进行排序,筛选出排名前20 的生物过程和通路。使用微生信网站(http://www.bioinformatics.com/)绘制GO 信息柱状图,OmicShare 网站(http://www.omicshare.com/)绘制通路信息的气泡图。
1.6 成分-靶点-通路网络的构建
通过查阅文献,从KEGG 富集分析基因富集数前20 的通路中,筛选出与治疗PF 相关的靶向通路,找出富集在这些通路上的潜在靶点,并找出与靶点相对应的药物活性成分。以活性成分、靶标、通路为节点,导入输入Cytoscape 3.7.2软件,构建黄芪-水蛭药对治疗PF相关的成分-靶点-通路网络图。
2 结果
2.1 黄芪-水蛭药对主要活性成分的筛选
通过TCMSP 数据库检索到黄芪化学成分87 个,根据OB≥30%、DL≥0.18 的筛选标准,并结合文献报道[31-34],补充OB、DL值虽低,但研究证实含量较高、有药理活性的成分黄芪皂苷,最终得到候选活性成分24 个;根据相关文献报道共收集了水蛭化学成分61个[35-41],经SwissADME数据库筛选得到36个具有良好ADME性质的潜在活性化学成分。黄芪-水蛭药对主要活性成分的基本信息见表1。

表1 黄芪-水蛭药对活性成分基本信息
2.2 黄芪-水蛭药对潜在靶点预测
将SwissTargetPrediction 平台获得的1310 个黄芪作用基因靶点、977 个水蛭作用基因靶点删除重复项,得到黄芪457 个潜在靶点、水蛭439 个潜在靶点。通过检索GeneCard、OMIM、DrugBank 和TTD 数据库,整合并剔除重复项得到PF 相关基因靶点共846 个,与药物靶点进行匹配,最终得到化合物与疾病交集靶点95 个(图1),预测为黄芪-水蛭药对治疗PF 的靶基因,其中74 个归属于黄芪,67 个归属于水蛭,两者共有靶基因46 个,提示黄芪、水蛭配伍治疗PF,既能独自发挥作用,又可协同作用。
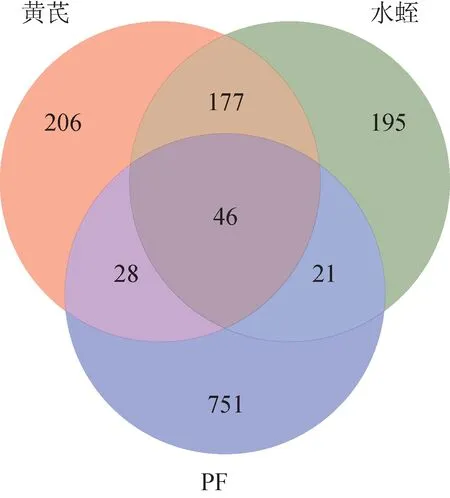
图1 黄芪、水蛭、PF疾病靶标映射
2.3 网络图分析
2.3.1成分-靶点网络 如图2 所示,以95 个靶点作为黄芪-水蛭药对治疗PF 的靶点,建立成分-靶点网络,该网络包含了139 个节点、379 条边,共有黄芪活性成分23个、水蛭21个,同一活性成分可作用于多个靶点,不同成分也可作用于同一靶点,网络图充分体现了黄芪-水蛭配伍以多成分、多靶点、协调整合的方式发挥治疗PF的作用。经计算,该网络平均度值为8.61,平均介度为0.03,平均紧密度为0.32。熊竹素、槲皮素、山柰酚、水蛭素啶A、熊果酸等16 个成分度值、介度、紧密度均≥其平均值,提示这些成分可能是黄芪-水蛭药对治疗PF 的主要活性成分。主要活性成分的拓扑参数见表2。

表2 黄芪-水蛭治疗PF主要活性成分拓扑参数
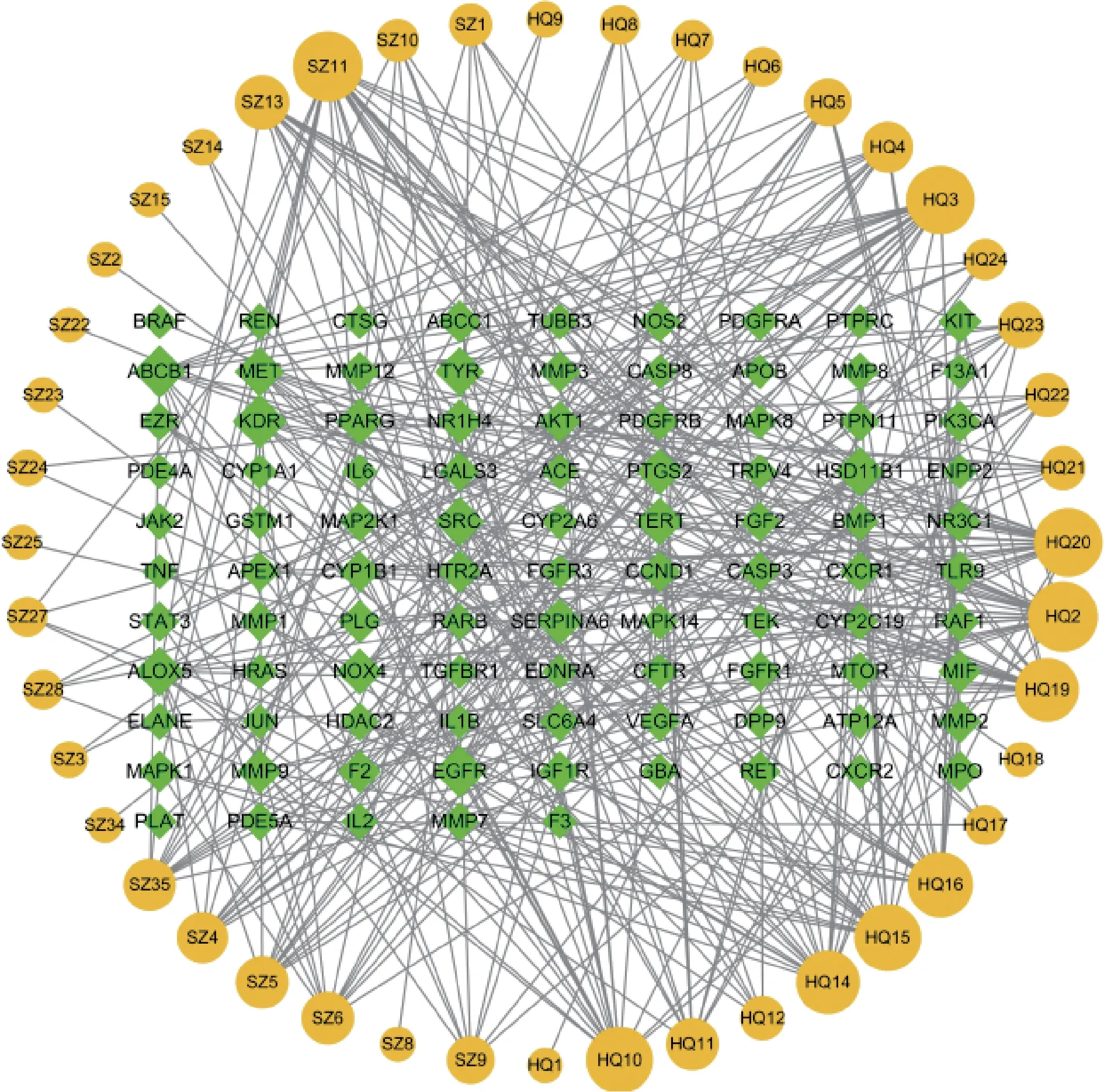
图2 黄芪-水蛭治疗PF成分-靶点网络
2.3.2靶蛋白PPI 网络 将95 个交集靶点导入STRING 11.0数据库获取相互作用关系网络,去掉1个游离靶点,将剩余结果保存为TSV 文本后导入Cytoscape 3.7.2 软件。如图3A 所示,PPI 网络共有94 个节点,1240 条相互作用连线。经计算,整个网络节点度值中位数为23,以度值≥2 倍中位数值(度值≥46)的节点作为关键靶点,共筛选得到黄芪-水蛭药对治疗PF的关键靶点18个(图3B)。
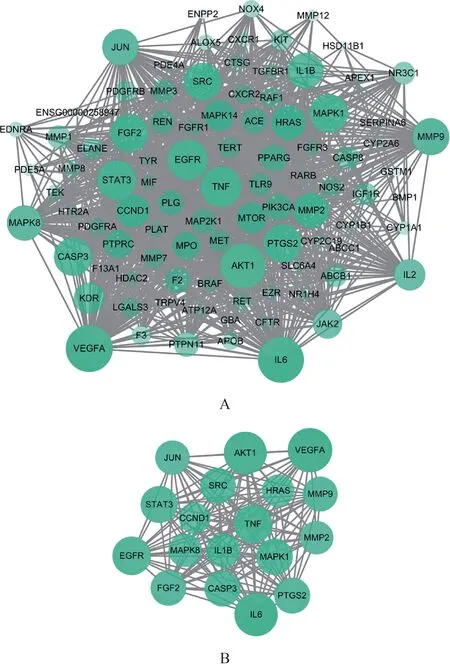
图3 黄芪-水蛭药对治疗PF靶蛋白PPI网络及关键靶点
如表3 所示,在Metascape 数据库(http://metascape.org/)中获得18 个靶基因对应的蛋白功能。表明转录因子、信号通路和酶等相关蛋白物质参与了黄芪-水蛭药对治疗PF的途径。
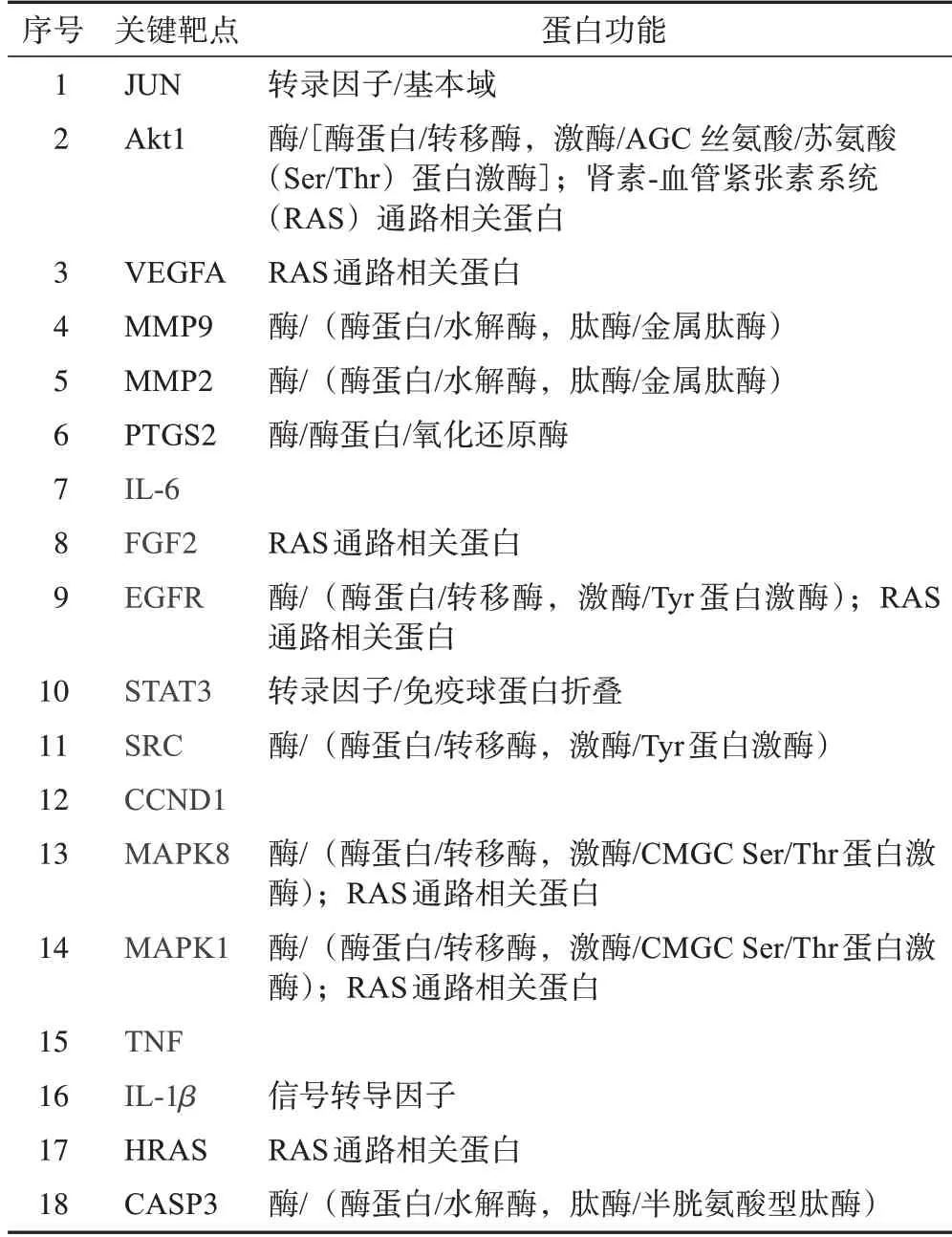
表3 黄芪-水蛭药对治疗PF关键靶点的蛋白功能
2.4 GO注释分析和KEGG富集分析
使用DAVID 数据库对黄芪-水蛭治疗PF 的95 个潜在靶点进行GO 注释分析和KEGG 通路分析,并通过微生信和OmicShare网站将结果可视化。
GO 注释分析由分子功能(molecular function,MF)、生物过程(biological process,BP)、细胞组成(celluar component,CC)3 部分组成。由图4 可知,BP 分析中排名靠前的有激酶活性的正调控、细胞增殖的负调控、凋亡过程的负调控、对脂多糖的调节等;CC分析主要是膜筏、基底外侧质膜、溶酶体、蛋白质细胞外基质等,主要体现在细胞膜和蛋白复合物上;MF 分析靠前的是细胞因子活性、蛋白丝氨酸/苏氨酸激酶活性、激酶活性、肝素结合等,主要集中在调节细胞因子、蛋白激酶活性。

图4 黄芪-水蛭活性成分治疗PF潜在靶点的GO富集分析
KEGG 通路分析(图5)显示,黄芪-水蛭药对治疗PF 富集基因数靠前的通路主要有癌症通路、磷酯酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)信号通路、RAS 信号通路、丝裂原活化蛋白激酶(MAPK)信号通路、VEGF 信号通路、微小RNA(microRNA)信号通路、缺氧诱导因子-1(HIF-1)信号通路等。

图5 黄芪-水蛭活性成分治疗PF潜在靶点的KEGG富集分析
2.5 成分-靶点-通路网络的构建
综合GO 和KEGG 通路富集分析结果,筛选出黄芪-水蛭药对治疗PF 的潜在通路,并与活性成分和靶点一一对应。将相关数据录入Cytoscape 3.7.2,构建黄芪-水蛭药对治疗PF 的成分-靶点-通路网络(图6)。网络图包含86 个节点、321 条边线,黄芪-水蛭药对治疗PF 与槲皮素、熊竹素、山柰酚、黄芪紫檀烷苷、hirudinoidine A、熊果酸等35个活性成分有关,与VEGFA、白细胞介素-6(IL-6)、表皮生长因子受体(EGFR)、基质金属蛋白酶-9(MMP-9)、MAPK1 等43 个靶标有关,与PI3K-Akt 信号通路、MAPK 信号通路、microRNA 通路、VEGF 信号通路、RAS信号通路HIF-1信号通路等8条通路有关。
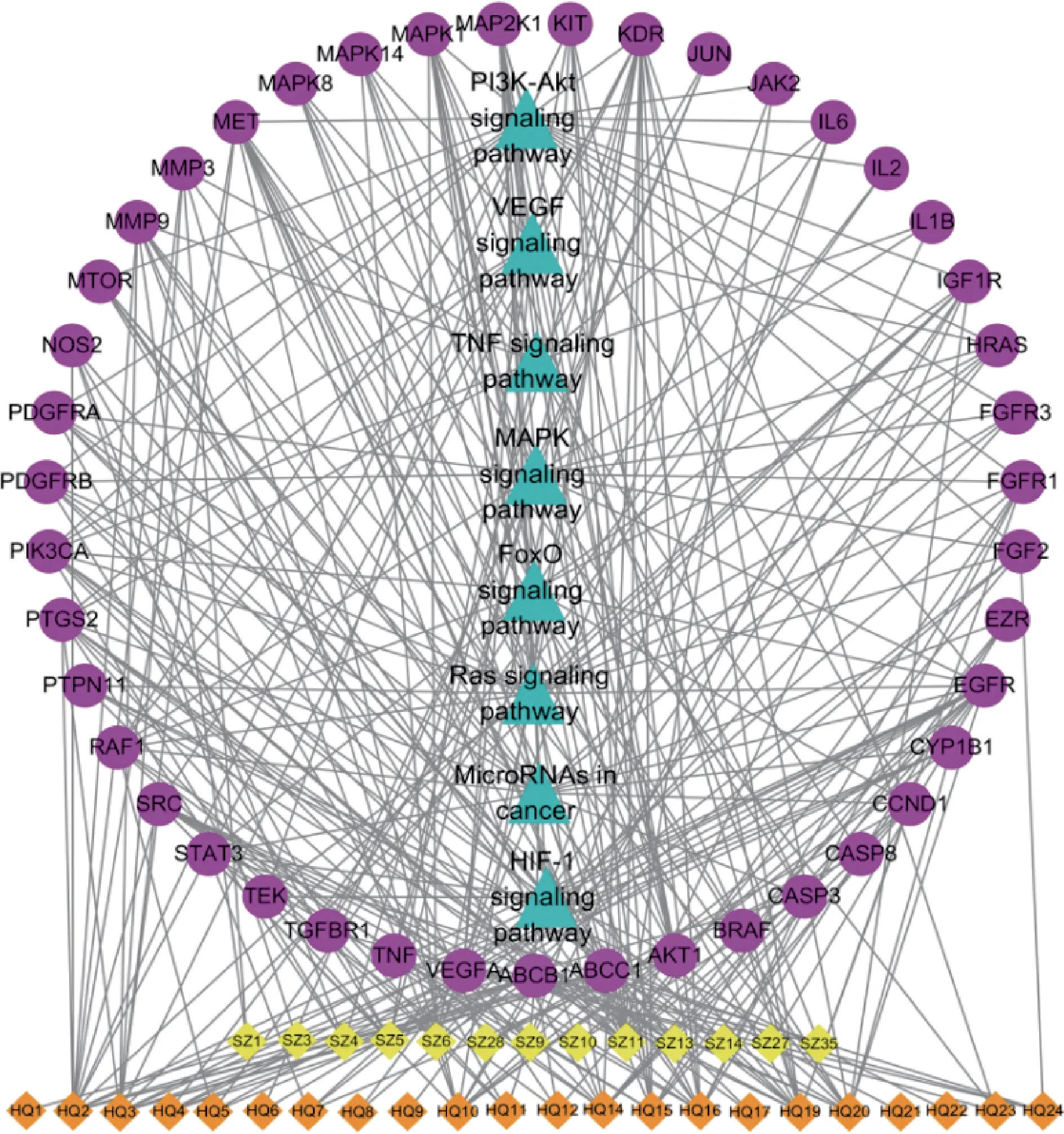
图6 黄芪-水蛭治疗PF成分-靶点-通路网络
3 讨论
3.1 黄芪-水蛭药对治疗PF 的主要活性成分与关键靶点探讨
PF 作为一大类肺系疾病终末期表现,在国内外的发病率呈显著上升趋势,恶性程度甚至高于某些恶性肿瘤[42],已成为全世界广泛关注的健康问题。其致病机制复杂且尚不明确,是一个世界性的医学难题。近年来,以黄芪和水蛭为主要药物的中药复方在治疗PF 方面疗效显著[43-44]。本研究通过网络药理学方法系统分析了黄芪-水蛭药对抗PF 的作用机制,筛选主要作用成分及关键靶点,分析生物过程及信号通路,构建了成分-靶点-通路网络,阐释了其抗PF的成分基础和作用机制。
成分-靶点网络显示槲皮素、山柰酚、二氢异黄酮、黄芪紫檀烷苷、异鼠李素、熊果酸、水蛭素啶A等18 种成分可干预多靶点发挥协调作用,可能是黄芪-水蛭药对治疗PF 的重要成分,可进行深入研究。彭海兵等[45]研究发现,槲皮素可抑制p38 MAPK 通路,抑制肿瘤坏死因子-α(TNF-α)、TGF-β1的表达,对硅诱导的PF 起抑制作用。槲皮素能发挥抗炎作用,抑制TNF-α、IL-1β和IL-6 的表达,减轻肺胶原蛋白的沉积[46]。Liu 等[47]研究发现,山柰酚可通过抑制细胞自噬,抑制炎症因子的表达,减少细胞凋亡,对PF 大鼠起治疗作用。Zheng 等[48]发现,对经博来霉素处理的小鼠和TGF-β处理的肺泡上皮细胞给予异鼠李素处理,可抑制内质网应激(ERS)和蛋白激酶R样内质网激酶(PERK)的激活,逆转上皮细胞-间质转分化(EMT)进程、减少胶原蛋白沉积。研究显示,水蛭素可降低纤溶酶原激活物抑制剂-1(PIA-1)的基因和蛋白表达水平,从而增加胶原降解、抑制纤维蛋白沉积,发挥治疗PF 的作用[49]。熊果酸能抑制Toll 样受体4(TLR4)/NF-κB信号通路的激活,减少肺组织IL-6、TNF-α和IL-1β的表达,延缓大鼠PF病情进展[50]。
PPI 网络分析结果发现,黄芪-水蛭药对治疗PF可能涉及VEGFA、MAPK1、Akt1、IL-6、TNF、IL-1β、MMP-9、MMP-2等18个核心靶蛋白。EGFR磷酸化可促进EMT、ERS 和氧化应激[51-52],在PF 发病机制中发挥重要作用。VEGF 能刺激血管的生成,对肺血管床发育至关重要,IL-5、IL-1、TNF是促炎因子,而炎症反应和血管重构是PF 发生的重要危险因素[53]。MAPK1是MAPK 家族的重要组成部分,在肺成纤维细胞的增殖和凋亡过程中具有重要作用,且参与肺血管新生[54]。MMPs 既参与纤维化过程的早期炎症损伤,又在晚期异常修复发挥重要作用,从而诱导PF的发生。
3.2 黄芪-水蛭药对治疗PF的信号通路探讨
GO 注释分析和KEGG 通路富集结果发现,黄芪、水蛭药对中有效成分可通过调节PI3K-Akt 信号通路、MAPK 信号通路、microRNA 通路、VEGF 信号通路、RAS 信号通路、HIF-1 信号通路等,参与炎性免疫反应、氧化应激、细胞凋亡和血管新生等生物过程,进而对PF发挥治疗作用。PI3K-Akt信号通路可调控下游哺乳动物雷帕霉素靶蛋白(mTOR)、HIF-1α及活性氧(ROS)系统[55-56],其中mTOR 介导的自噬活性降低与成纤维细胞高增殖、抗凋亡特性相关[57],HIF-1α可促进纤维母细胞增殖及EMT 过程[58-59],从而参与PF 过程。在PI3K-Akt信号通路的过程中还可以使MEK1/2 上的丝氨酸磷酸化,激活MAPK通路,两者协同参与PF的发生、发展[49]。研究表明,含有黄芪、水蛭药对的复方可调控PI3K,减轻PF 程度[60-61],本研究也得出了相似结果,为这一理论提供了依据。MAPK 是生物体内信号传递的关键途径之一,该通路可促进炎症介质表达、细胞凋亡和血管新生,是PF 发生、发展的病理机制[62]。参与细胞生理、病理进程的microRNA可能通过调节炎症反应、EMT、细胞外基质沉积等途径,调控肺纤维的发生[63]。研究发现,miR-155通过增强TNF-α的产生而在炎症发生中发挥关键作用[64],反过来炎性小体亦可促进miR-155的表达,且miR-155是促使纤维化发生的关键miRNA[65]。本研究结果显示,黄芪-水蛭药对能够通过microRNA 通路调节炎症因子的表达,抑制肺泡上皮细胞的损伤,从而发挥抗PF 作用。RAS 系统是体内重要的体液调节系统,主要包括血管紧张素转化酶(ACE)-血管紧张素Ⅱ(AngⅡ)和血管紧张素转化酶2(ACE2)-Ang-(1-7)双轴,前者可与TGF-β1协同作用参与PF 的发生,可上调TGF-β1的表达,并通过AngⅡ受体促进成纤维细胞分泌ECM[66];后者发挥相反的作用,还能抑制MAPK 途径,延缓PF 的形成与发展[67]。HIF-1 是一种氧依赖转录激活因子,活性亚基HIF-1α是应答缺氧反应的关键因子,参与调控VEGF、TGF-β1、MMP-9、MMP-2等靶基因的表达,促进PF 模型动物新生血管生成、炎症免疫反应、成纤维细胞增殖等病理过程[68],提示黄芪-水蛭药对可作用于HIF-1信号通路,发挥抗PF作用。
VEGF 既参与维持肺组织的结构和功能,又可加速PF的进展。研究发现,VEGF在PF患者的血清和肺泡灌洗液中强表达,组织病理的特点是肺新生血管形成及血管重构[69],而VEGF 的特异性阻滞剂CBO-P11 可减弱博来霉素诱导的大鼠PF[70]。另一方面,过表达的VEGF 可以保护肺泡结构、促进修复,是PF 过程中的“保卫者”[71]。这表明VEGF 过多或过少表达都可能参与PF 发生。已有文献报道了黄芪甲苷可通过抑制VEGF 表达对PF 大鼠发挥保护作用[72]。不同浓度的水蛭可对血管新生发挥双向调节作用,保护机体免受病理损伤[73]。推测水蛭可以调节VEGF 的表达发挥保护肺脏功能的作用,该类研究未有报道,尚不清楚其抗PF 的作用与促进或抑制VEGF 的表达相关,今后的研究可围绕这一内容进行深入分析。
综上所述,本研究通过网络药理学的方法发现黄芪-水蛭药对通过多成分、多靶点、多通路发挥协同抗PF的作用,为后期的验证性研究提供了理论依据。两者主要通过调控PI3K-Akt、MAPK、microRNAs、RAS、HIF-1、VEGF 等信号通路发挥减轻PF 的作用,但具体的分子作用机制仍需要实验深入研究,为PF的治疗提供更多支持。
